灭菌型乳酸菌饮料调节肠道功能研究
2021-06-27郭慧田粟陆淳刘丽王清波耿云惠
郭慧,田粟,陆淳,刘丽,王清波,耿云惠
(1.石家庄君乐宝乳业有限公司,石家庄 050200;2.河北医科大学,石家庄 050200)
0 引 言
乳酸菌是一种肠道有益菌,具有维持肠道微生态平衡[1]、抑制肠道有害菌生长繁殖[1]、调节肠道免疫功能[2]、改善肠道屏障功能[3]等多种保健功能。乳酸菌益生作用的机理一般分为两种:一是直接作用,菌体本身及其活性代谢物对有害物质的黏附或降解;二是间接作用,乳酸菌及其代谢产物调节肠道菌群及其代谢酶活性、调节机体免疫活性及机体部分酶活性,起间接益生作用。
本研究通过让志愿者分别饮用灭菌型和活菌型乳酸菌饮料产品,分析其饮用前后的排便情况,粪便中短链脂肪酸含量变化,通过16SrDNA V4区测序分析肠道菌群结构和丰富度的差异,探究肠道菌群和粪便脂肪酸的联系,从而评价灭菌型乳酸菌饮料调节肠道健康的功能。
1 实 验
1.1 材料及仪器
灭菌型乳酸菌饮料、活菌型乳酸菌饮料,石家庄君乐宝乳业有限公司;7890B气相色谱仪(带火焰离子检测器),美国Agilent公司;超低温冰箱,美国Thermo公司;低温高速离心机,美国Thermo公司;产物纯化Gene-JET胶回收试剂盒,美国Thermo公司;Ion Plus Fragment Library Kit 48 rxns建库试剂盒,美国Thermo公司;Ion S5TMXL测序系统,美国Thermo公司。乙酸、丙酸、正丁酸、异丁酸、正戊酸、异戊酸和正己酸标准品,上海阿拉丁生化科技股份有限公司;16S V4区引物515F-806R,北京诺禾致源科技股份有限公司;Phusion®高保真DNA聚合酶,美国New England Biolabs公司。
1.2 方法
1.2.1 实验设计
本研究采用的是随机对照的交叉设计。招募健康志愿者70人,性别是随机的,其中男性18人,女性52人,年龄范围是22~26岁。采用随机对照的交叉设计,将受试人群随机分为两组,分别饮用灭菌型乳酸菌饮料和活菌型乳酸菌饮料各10 d,每天一瓶(200 mL);然后经过2周的洗脱期,再进行第二阶段,原来饮用灭菌型乳酸菌饮料的受试人群改变为饮用活菌型乳酸菌饮料,原来饮用活菌型乳酸菌饮料的受试人群开始饮用灭菌型乳酸菌饮料,持续10 d,每天1瓶(200 mL)。交叉实验设计的目的是消除受试人群的个体差异。干预之前进行基线测量,包括记录身高和体重、连续3天的膳食日记,以及食物频率、运动习惯、饮水量、排便习惯的调查,并提供粪便样本,保存在-80℃冰箱中直至测定处理。干预后进行食物改变情况、排便情况的调查,收集粪便用于pH值、含水量、短链脂肪酸含量和肠道菌群16S的测定。最终完成调查问卷70人,粪便收集70人,在保证数据样本量达到最低限度的情况下,随机选择其中25人的粪便用于肠道菌群16S的测定。
1.2.2 调查问卷
排便情况的调查使用的是Cleveland便秘评分系统。排便次数的调查,受试者直接回答饮用前后的排便次数。采用布里斯托大便分类法来评价排便形状。
1.2.3 粪便中短链脂肪酸的测定
将来自-80℃冰箱的湿粪便物质称量1.0 g,放入15 mL管中,加入纯净水2 mL,旋涡混匀后,将此匀浆4 000 r/min离心10 min,将上清液14 000 r/min离心10 min,取上清液500μL,加入磷酸125μL,制成17%磷酸溶液,再次14 000 r/min离心10 min,取上清液490μL,加入200 mmol/L 2-乙基丁酸10μL,混匀,经0.2μm滤膜过滤入进样瓶中,采用气相色谱仪进行检测。气相色谱条件:HP-FFAP柱(30 m×0.25 mm×0.25μm);载气为高纯氮气,流量1.0 mL/min;辅助气为氢气和空气;色谱柱升温程序:初始温度50℃保持3 min,以8℃/min升至120℃,以5℃/min升至170℃,以15℃/min升至240℃,保持3 min;进样口温度:250℃;检测器温度:250℃;进样体积:1μL,分流比5∶1。
1.2.4 肠道菌群的分离和16SrDNA扩增子
采用CTAB法[4]对已处理样本的基因组DNA进行提取,用琼脂糖凝胶电泳检测DNA的纯度和浓度,样本浓度1 ng/μL,对16SV4区进行PCR扩增,PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测,根据PCR产物浓度进行等量混样,充分混匀后使用1×TAE浓度2%的琼脂糖胶电泳纯化PCR产物,剪切回收目标条带。文库构建使用Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行,将构建好的文库经过Qubit定量和文库检测合格后,用Ion S5TMXL高通量测序系统上机测序。
1.2.5 数据统计
采用EpiData 3.1进行数据录入,并进行一致性检验以保证双录入信息的准确性。采用SPSS13.0软件进行统计分析,对所得数据做正态性及方差齐性检验,并根据相关结果进一步分析,统计分析方法包括描述性统计、方差分析、t检验、Kruskal-Wallis Test等方法,P<0.05为差异有统计学意义。
2 结果与分析
2.1 受试人群两次基线排便习惯的比较
交叉实验设计过程中,受试人群两次基线排便习惯的比较,结果如表1所示。表1是交叉实验设计过程中,受试人群排便习惯各指标两次基线数据的比较结果。结果显示,受试人群这两次排便习惯各指标,差异不具有统计学意义,表明洗脱时间是合理的,洗脱效果是成功的。考虑到交叉实验设计过程中,同一种饮品是两部分人在不同的时期饮用的,为了数据的严谨,下述两种饮料饮用前后排便习惯的比较时,基线数据都是每个人在喝该种饮品时相对应的当时的基线结果,而非两个时期的基线的结果。
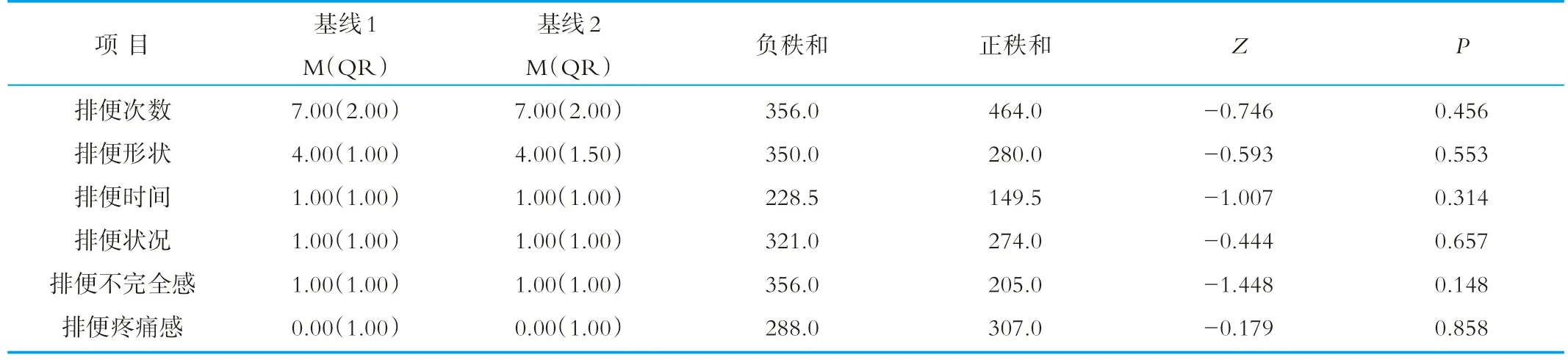
表1 受试人群两次基线排便习惯结果的比较
2.2 排便情况变化
受试人群排便习惯各指标的变化情况见表2~表4。其中,配对秩和,是将饮用后的数据与饮用前数据相减,得到差值,然后对差值绝对值排序,正数的秩次加起来是正秩和,负数的秩次加起来是负秩和。正秩和占优,表明饮用后得分上升,负秩和占优,表明饮用后得分下降。结果显示,饮用灭菌型乳酸菌饮料后,受试人群的排便次数显著增加,排便不完全感和排便困难程度得到了改善;饮用活菌型乳酸菌饮料后,可以显著改变排便不完全感和排便形状;但是从饮用后两者各指标比较的结果看,灭菌型和活菌型是没有差异的(P>0.05)。
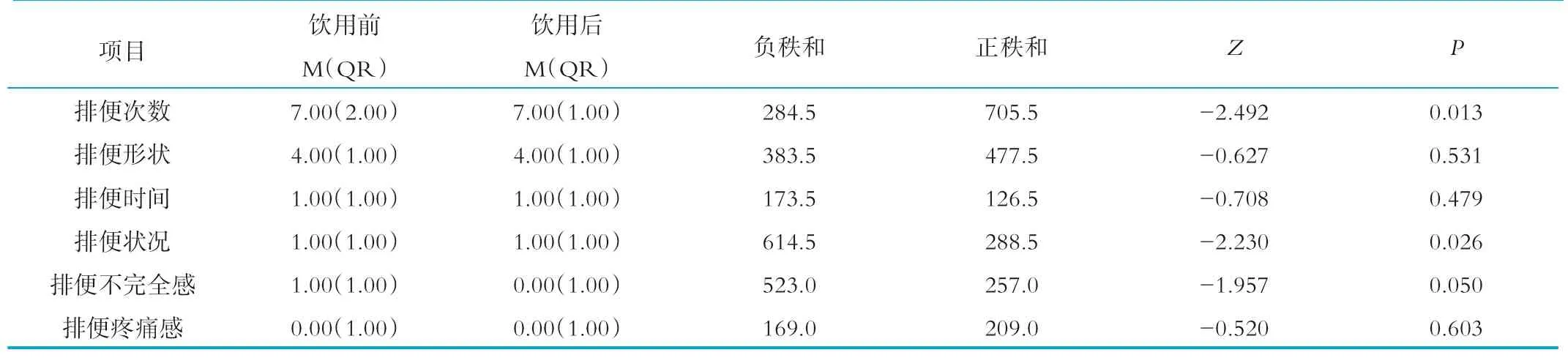
表2 饮用灭菌型乳酸菌饮料前后比较结果
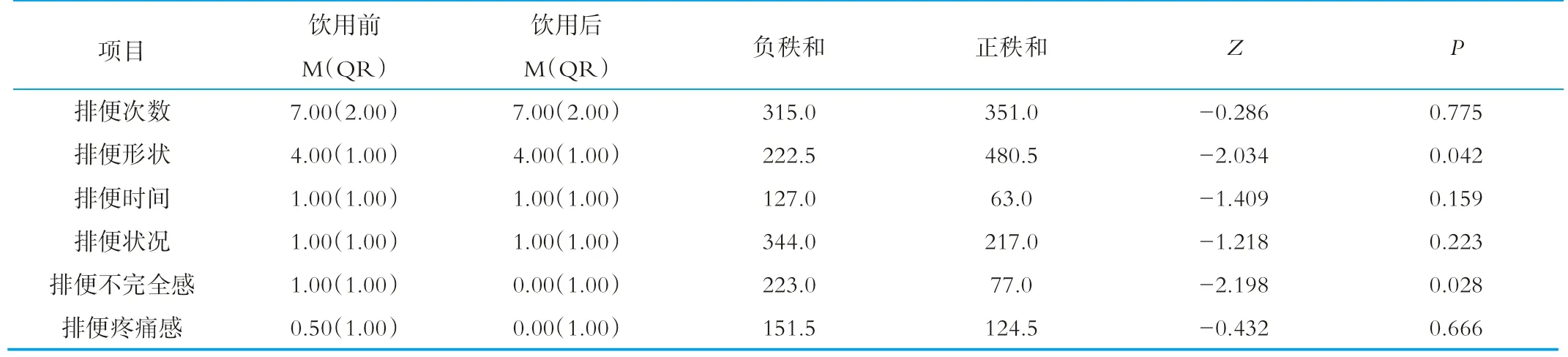
表3 饮用活菌型乳酸菌饮料前后比较结果
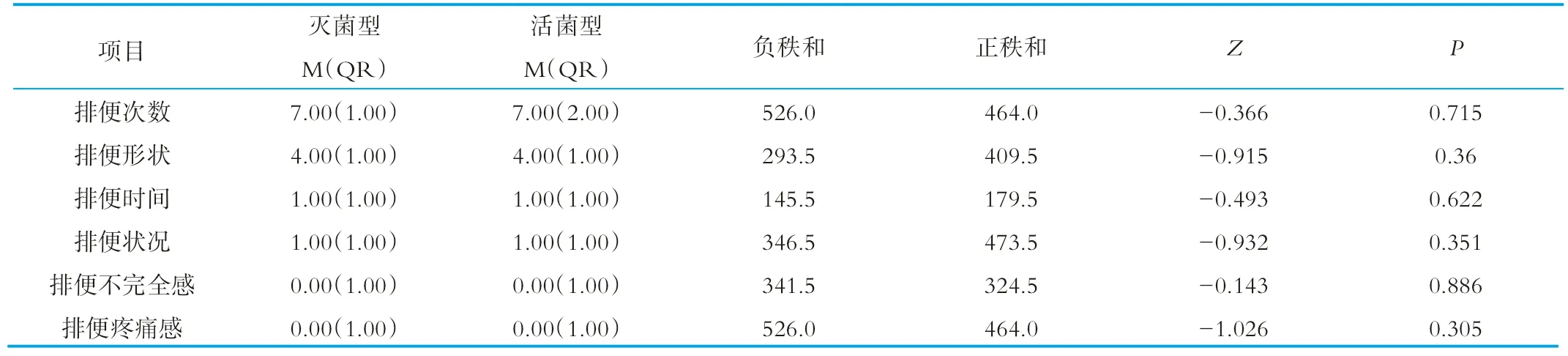
表4 饮用灭菌型和活菌型乳酸菌饮料排便习惯的比较
2.3 粪便中短链脂肪酸质量分数变化
如表5显示,与基线数据比较,饮用灭菌型乳酸菌饮料后,短链脂肪酸中的乙酸、丙酸、正戊酸以及总短链脂肪酸的质量分数都有显著性的降低,且乙酸、丙酸和总短链脂肪酸质量分数显著性低于饮用活菌型乳酸菌饮料的结果。饮用活菌型乳酸菌饮料后,受试人群粪便中短链脂肪酸的质量分数与基线没有出现显著性差异,但是,数据显示有增加的趋势,这可能与样本量不够多有关。
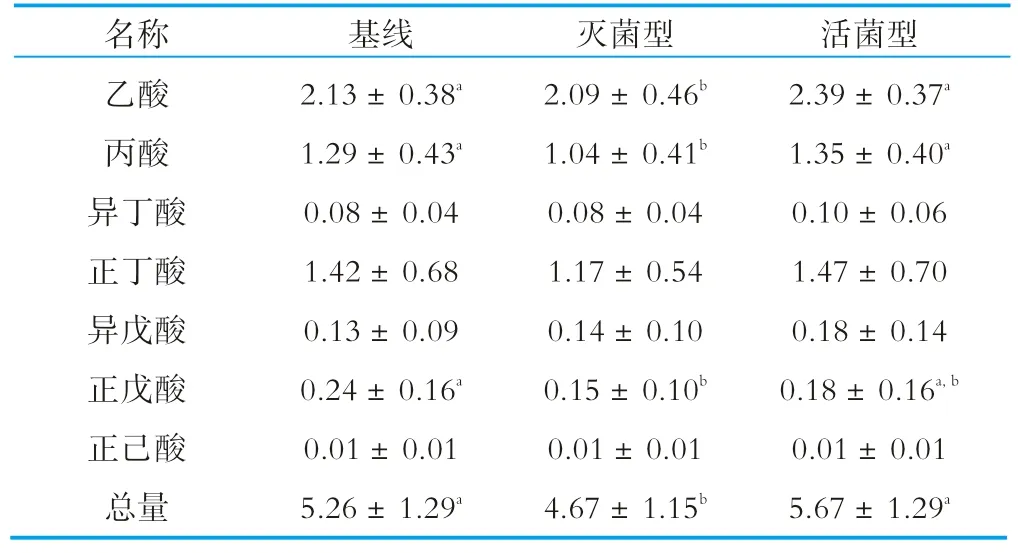
表5 粪便中短链脂肪酸质量分数变化 mg/g
结肠是人体内短链脂肪酸的主要产生部位,多是由未消化吸收的碳水化合物经结肠内厌氧菌酵解产生,主要包括乙酸、丙酸、丁酸[5],约占短链脂肪酸总量的90%~95%。丁酸是人类结肠、盲肠上皮细胞最重要的能量来源[6],还被认为是抗生素的潜在替代品,能抑制结肠癌细胞的生长[7-8],丁酸水平的增减会影响肠道上皮细胞的正常功能。本研究结果表明,饮用灭菌型和活菌型乳酸菌饮料后,样本粪便中丁酸的质量分数没有显著性变化,不会对肠上皮细胞造成影响。
乙酸可降低肠道内的pH值,抑制腐败菌的生长,减少结肠癌的发生[9];丙酸可抑制胆固醇的合成,提高高密度脂蛋白胆固醇和甘油三酯水平,降低血糖和胰岛素水平[10]。目前的研究表明,超过95%肠道产生的短链脂肪酸被宿主吸收,粪便中乙酸、丙酸水平的下降可能是吸收增加或产量下降的结果。
2.4 肠道菌群多样性分析
2.4.1 Alpha多样性分析
在人体肠道微生物菌群中,主要以拟杆菌门、厚壁菌门的细菌为主[11]。Alpha多样性用于度量群落生态单样本的物种多样性,是反映物种丰富度和均匀度的综合指标,如图1所示。通过Wilcoxon秩和检验,发现测得的物种数在灭菌型乳酸菌饮料组-活菌型乳酸菌饮料组、基线组-灭菌型乳酸菌饮料组两组间具有明显的差异(P<0.05),显著性P值分别为0.0003和0.0377。测得的物种数在基线组-活菌型乳酸菌饮料组不具有明显的差异(P>0.05),P值为0.0741。结果表明,灭菌型乳酸菌饮料可以增加受试人群肠道菌群的丰富度。
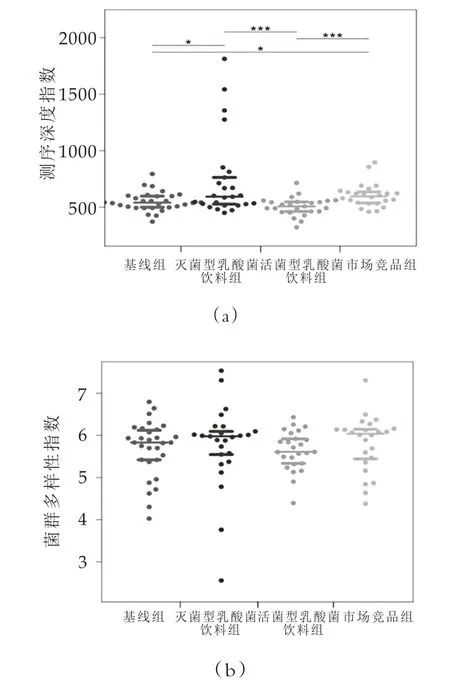
图1 所有样本不同组别间物种总数的散点分布
2.4.2 Beta多样性分析
Beta多样性用于不同环境群落之间物种差异性的比较。图2显示的是微生物群落的组间差异,反映不同微生物群落的Unweighted Unifrac Beta多样性(b)的结果表明灭菌型乳酸菌饮料与基线、活菌型乳酸菌饮料饮用时的微生物群落是存在差异的,差异具有统计学意义(P<0.001);如果考虑到菌群丰度[12]的Weighted Unifrac Beta多样性(a)结果也显示灭菌型乳酸菌饮料与基线、活菌型乳酸菌饮料存在着显著性差异(P<0.001)。
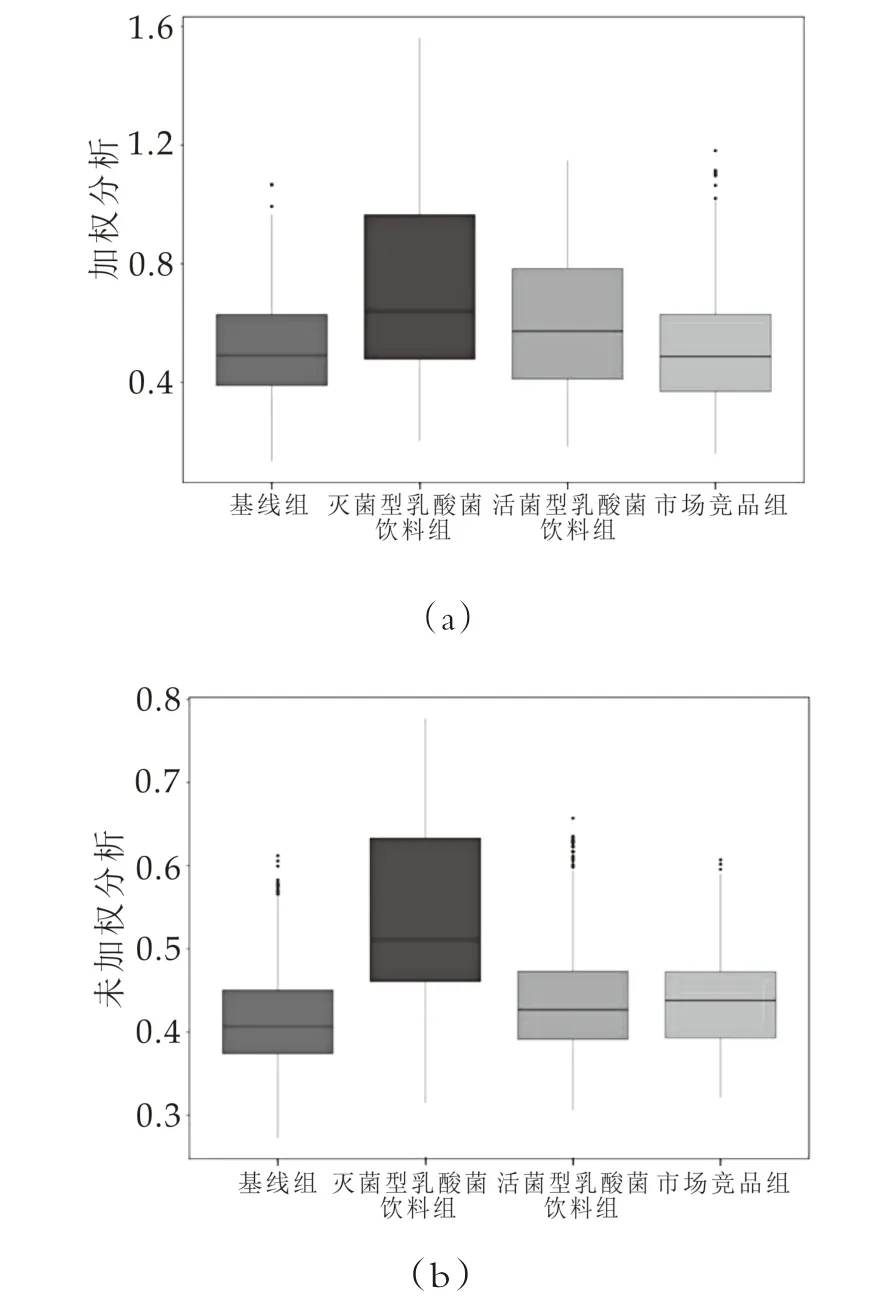
图2 多样性的箱形图
2.4.3 饮用灭菌型乳酸菌饮料后肠道菌群的变化
如图3和图4所示,饮用灭菌型乳酸菌饮料后,在门水平下肠道菌群中厚壁菌占总菌的比例较基线时降低,而变形杆菌门和放线菌门占总菌的比例增加,差异具有统计学意义。结果也显示出灭菌型乳酸菌饮料可以抑制厚壁菌和拟杆菌的生长。研究表明,厚壁菌主要帮助宿主从膳食中吸收能量;拟杆菌具有碳水化合物发酵,参与多糖代谢、胆汁酸和类固醇代谢,维持肠道正常生理等诸多功能。有研究认为,肥胖人群厚壁菌门占优势,厚壁菌/拟杆菌门比值较高[13],而且经过饮食方式干预(使用低脂肪或低碳水化合物,限制能量摄入)后,肥胖者的F/B值会随着体重的降低而减小[14]。本研究结果显示,饮用灭菌型乳酸菌饮料后参与人体吸收能量的厚壁菌比例减少,以及厚壁菌厚壁菌与拟杆菌比例下降,提示君畅灭菌型乳酸菌饮料对降低体重可能有一定的作用。

图3 微生物物种(Top 10)在不同水平上的差异
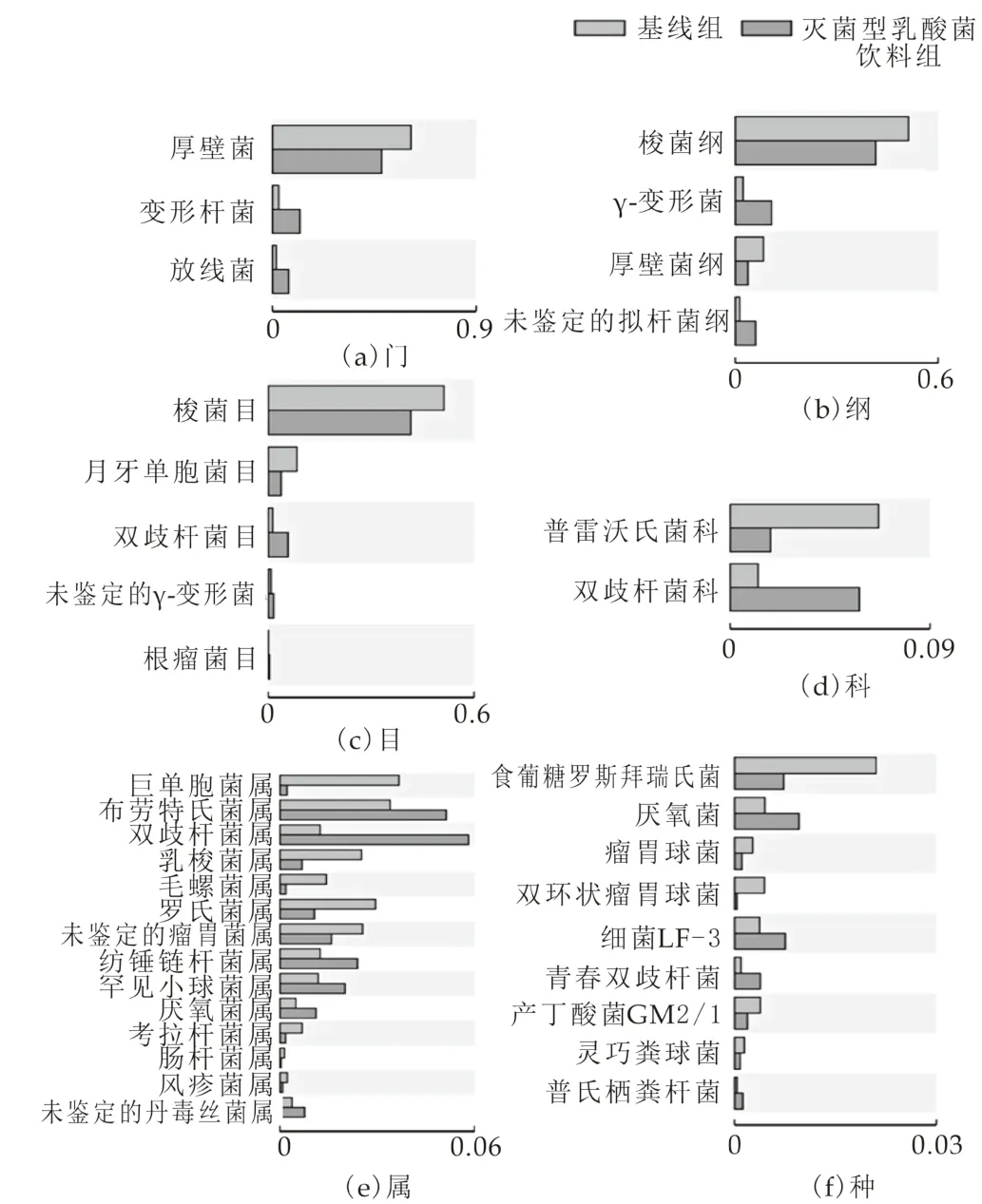
图4 饮用灭菌型乳酸菌饮料(蓝色)后的微生物物种与基线(橙色)的差异
结合纲水平的结果显示,灭菌型乳酸菌饮料组厚壁菌的丰度降低主要表现在Clostridia梭菌纲和negativicutes菌纲方面。Clostridia梭菌纲在目水平上进一步表现出Clostridiates梭菌的丰度降低,在属水平的Blautia丰度增加和Lachnoclostridium丰度下降,种水平的Ruminococcaceae瘤胃菌科的丰度降低。negativicutes菌纲菌群不同水平的丰度改变表现为目水平的Selenomonadales、科水平的Veillonellaceae、属水平的Megamonas的丰度的降低。其中,Megamonas和Lachnoclostridium菌属的作用是发酵各种碳水化合物,其终产物是乙酸、丙酸和乳酸,饮用灭菌型乳酸菌饮料后Megamonas菌属丰度的显著下降,这与饮用灭菌型乳酸菌饮料后粪便中乙酸和丙酸含量显著低于基线的结果是一致的。而厚壁菌门梭菌属中的Blautia,Lachnospira和Roseburia与丁酸的生成密切相关,饮用灭菌型乳酸菌饮料后粪便中丁酸的含量比基线比较没有显著性差异,考虑可能与Blautia丰度增加,而Lachnospira和Roseburia丰度下降的综合作用有关。如图4所示,在种水平上,还显示出饮用灭菌型乳酸菌饮料后Faecalibacterium prausnitzii普拉梭菌的丰度的增加,普拉梭菌是肠道具有重要保护作用的益生菌,其减少会导致肠道抗炎能力和免疫调节能力的减弱,也与加强肠上皮屏障有关,还具有治疗肠易激综合症腹痛的潜力等有益肠道健康的作用[15]。
除了厚壁菌和拟杆菌之外,饮用灭菌型乳酸菌饮料后,变形菌和放线菌的丰度显著增加了。其中,放线菌门的大多数细菌为有益菌,如双歧杆菌,可产生抗生素、各种酶、维生素B12和有机酸等活性物质。本研究的结果也显示饮用灭菌型乳酸菌饮料后,双歧杆菌占总菌的比例在目水平、科水平、属水平和种水平,都比基线时高,这个结果提示君畅具有提高肠道健康的可能性。有关慢性便秘的人群研究显示,便秘患者的梭菌属丰度增加,而且益生元可以通过增加双歧杆菌数量和减少梭菌数量来治疗慢性便秘,本研究饮用灭菌型乳酸菌饮料后,双歧杆菌丰度的增加和梭菌属丰度的下降也提示灭菌型乳酸菌饮料润肠通便的效果。
2.4.4 饮用活菌型乳酸菌饮料后肠道菌群的变化
饮用活菌型乳酸菌饮料后,与基线相比,肠道菌群的变化主要体现在拟杆菌门的丰度下降和放线菌丰度的增加上。它们都参与乙酸和丙酸的生成,考虑两者的共同作用,受试人群粪便中乙酸、丙酸和丁酸的含量与基线没有出现显著性差异。值得注意的是,饮用后乳酸杆菌和双歧杆菌、Coriobacteriale这样的放线菌的丰度都增加了,而它们与肠道健康密切相关,这些结果提示活菌型乳酸菌饮料可能会对肠道健康发挥有益作用。

图5 饮用活菌型乳酸菌饮料(蓝色)后的微生物物种与基线(橙色)的差异
3 结 论
综上所述,本研究发现饮用灭菌型乳酸菌饮料后可以调节肠道菌群的种类、数量、比例等,并影响肠道微生物稳态;排便习惯的调查结果显示灭菌型乳酸菌饮料具有一定的增加排便次数、改善了排便困难程度和排便不完全感的润肠通便的效果,但是润肠通便的效果不是因为产生了更多的短链脂肪酸引起的,考虑可能是因为饮用灭菌型乳酸菌饮料后梭菌属丰度的下降和双歧杆菌丰度的增加所致。饮用灭菌型乳酸菌饮料后普拉梭菌的丰度的增加和双歧杆菌丰度的增加,也提示君畅具有有益肠道健康的可能性。
