氯氟吡啶酯水解产物的鉴定及其检测方法的建立
2021-06-21屠王满措马有宁潘九月黄思琦陈铭学
屠王满措 马有宁 潘九月 黄思琦 陈铭学
(中国水稻研究所农业农村部稻米及制品质量监督检验测试中心,农业农村部稻米产品质量安全风险评估实验室,杭州310006)
水稻是我国第一大粮食作物,保证其产量与品质意义重大,而稻田杂草是影响水稻产量的主要原因之一[1~3]。除草剂具有效率高、效果好、成本低等优点,是现代农田杂草防除的主要手段[4]。然而农药不管以何种方法施用,都不可避免农药亲体及其降解产物在环境中的迁移、转化和积累[5]。农药在环境中通过各种方式进行降解,其中水解是许多农药降解的主要方式之一,同时也是评价农药在环境中稳定性的一个重要指标[6]。由于很多农药亲体及其代谢产物在环境中的富集作用,对非靶标生物和整个生态系统存在很大的潜在危害[7]。因此,农药在环境中的迁移、转化及残留检测是农产品质量安全评估的主要内容之一[8]。
氯氟吡啶酯(4-氨基-3-氯-6-(4-氯-2-氟-3-甲氧基苯基)-5-氟吡啶-2-羧酸苯甲)(florpyrauxifen-benzyl)是全新芳香基吡啶甲酸酯类水稻除草剂,其主要通过与植物体内激素受体结合,干扰植物正常的生理生化功能,从而致目标植物死亡[9]。因用量少、复配性强等特点,近几年氯氟吡啶酯被广泛使用于稻田环境[10]。目前国内外对氯氟吡啶酯的研究报道大多集中在水稻杂草防治效果方面的研究[11~13],如倪青等[14]研究了氯氟吡啶酯对直播稻及移栽稻田杂草的防除效果,李建群等[15]研究了氯氟吡啶酯及其他农药混配使用对稻田杂草的防效及水稻安全性方面的影响,结果表明,氯氟吡啶酯对水稻阔叶类杂草有很好的防治效果。然而对氯氟吡啶酯在稻田环境中的降解产物、残留检测及其在环境中的消解动态等方面还没有相关研究报道,因此,研究氯氟吡啶酯在环境中的降解产物及消解动态对其在稻田环境的使用安全性评估十分必要。本实验依据农业行业标准[16]进行,利用高效液相色谱-四极杆-飞行时间质谱(HPLC-QTOF/MS)技术鉴定氯氟吡啶酯在不同pH缓冲溶液中的水解产物,同时优化QuEChERS前处理方法,结合高效液相色谱串联三重四极杆质谱技术建立了同时检测稻田环境中氯氟吡啶酯及其代谢产物的方法,并且通过土培模拟试验,动态监测氯氟吡啶酯在稻田环境中的代谢与迁移,为氯氟吡啶酯在稻田生态系统中的安全性评估提供参考依据。
一、 材料与方法
(一)试验材料
1.材料与试剂。氯氟吡啶酯(florpyrauxifen-benzyl,纯度98.6%)和氯氟吡啶酸(florpyrauxifen,纯度98.5%)标准品,德国Dr.Ehrenstorfer LGC公司;乙腈(色谱纯,德国Merck公司);甲酸(色谱纯,美国Tedia公司);甲醇(色谱纯,德国Merck公司);无水硫酸(MgSO4,分析纯)和氢氧化钠(NaOH, 分析纯,Sigma-Aldrich公司);氯化钠(NaCl,分析纯,上海试四赫维化工有限公司);硼酸(H3BO3,分析纯,太仓美达试剂有限公司);氯化钾(KCl,分析纯,宁波市化学试剂厂);柠檬酸钾(C6H5K3O7,分析纯);磷酸二氢钾(KH2PO4,分析纯,上海沃凯生物技术有限公司);乙二胺-N-丙基硅烷(PSA,美国瓦里安公司),十八烷基键合硅胶吸附剂(C18,美国瓦里安公司)和石墨化炭黑(GCB,德国Thermo Fisher Scientific公司),粒径40μm。
2.仪器与设备。HPLC-Q-TOF/MS,美国Agilent公司;Surveyor液相色谱(美国Thermo Fisher Scientific公司);Poroshell 120 EC-C18色谱柱(150 mm×2.1mm,2.7μm,美国Waters公司);TSQ Quantum Access Max三重四极杆质谱仪(德国Thermo Fisher Scientific公司);分析天平(瑞士Mettler toledo公司);Milli-Q Advangtage超纯水仪(美国Millipore公司);PHS-3C精密pH计(上海仪电科学仪器股份有限公司);恒温恒湿箱(上海博迅实业有限公司);T 25基本型高速匀浆机(德国IKA公司);Primo R台式离心机(德国Thermo Fisher Scientific公司)。
(二)溶液的配制分别称取10 mg(精确至0.1 mg)氯氟吡啶酯和氯氟吡啶酸标准品,用丙酮溶液溶解并定容至10 mL,配成浓度为1 000 mg/L的标准储备液。分别吸取标准储备液各1 mL,于10 mL容量瓶中用乙腈稀释至刻度,配制氯氟吡啶酯和氯氟吡啶酸浓度为100 mg/L混合中间液。准确吸取中间液1 mL,于10 mL容量瓶中用乙腈稀释至刻度,配成浓度为10 mg/L的标准工作液,均避光-20℃保存。将标准工作液用乙腈稀释成浓度分别为500、200、100、50和5μg/L的上机液,现用现配。
(三)实验内容
1.HPLC-Q-TOF/MS鉴定氯氟吡啶酯水解产物。
(1)缓冲溶液的配制。根据农业行业标准NY/T 1860.9-2016《农药理化性质测定试验导则》配制pH 9、pH 7和pH 4的缓冲溶液。配制的所有缓冲溶液和所用的玻璃容器均在高温高压灭菌锅中灭菌处理,用灭菌后的缓冲溶液将1 000 mg/L的氯氟吡啶酯标准品稀释配制成200 mL 1.0 mg/L的溶液,配制好的处理液分别于3个100 mL三角瓶中密封,放置于50℃恒温恒湿培养箱中进行黑暗保存。另取200 mL灭菌好的缓冲溶液分别置于3个100 mL三角瓶中作为空白对照,同上条件保存,于培养开始后的第7 d取样测定。
(2)样品提取。准确量取20.0 mL水样于150.0 mL离心管中,向离心管中加入25.0 mL乙腈,高速匀浆(10 000 r/min)1 min,加入10.0 g无水MgSO4和1.0 g NaCl再次高速匀浆(10 000 r/min)1 min,以3 500 r/min离心3 min,取上清液1.0 mL过0.22μm有机相滤膜待测。
(3)仪器方法。色谱条件:色谱柱为XSelect HSS T3色谱柱,柱温45℃。含0.1%甲酸水溶液(V/V)(A)和乙腈(B)作为流动相,梯度洗脱0~5 min,5%~35%B;5~10 min,35%~98%B;10~17 min,98%B;17~20 min,98%~5%B;20~25 min,5%B;流速为0.3 mL/min,进样量为5μL。
质谱采集条件:离子源为电喷雾ESI源,采用正离子全扫描模式,质量扫描范围m/z50~1 000,一级质谱扫描速率为5 spectra/s。质谱参数设置为干燥气温度350℃,干燥气流速8 L/min;鞘气温度280℃,鞘气流速11 L/min;碎裂电压130 V;雾化气压力40 psi;射频电压750 V;锥孔电压40 V;喷嘴电压500 V;毛细管电压4 000 V。在采集数据时,通过注入参比离子对仪器进行质量精度实时校正。校正离子为嘌呤(m/z121.050873)和HP-0921(m/z922.009798)。二级扫描碰撞能量20 eV,扫描速率为3 spectra/s,其他同一级质谱条件。
(4)数据采集与分析。数据采集和系统控制由Agilent HPLC-Q-TOF/MS MassHunter采集软件(B.06.00)和定性分析软件(B.07.00)完成。通过Agilent MassHunter Profinder软件(10.0) 对色谱峰进行峰匹配、峰提取、峰对齐、峰识别、基线矫正以及归一化进行处理,然后通过Agilent MassProfiler Professional(MPP)软件进行频数过滤、Ttest(P<0.05) 显著分析和倍数(FC>2)比较进行差异化分析。为了确定代谢物的结构,针对一级质谱筛选到的6个差异化合物进行二级质谱数据的采集,通过Agilent LC-Q-TOF/MS MassHunter(B.07.00)软件进行化合物提取并导出CEF文件格式,然后导入MassHunter Molecular Structure Correlator(MSC)软件进行定性分析。
2.氯氟吡啶酯及其代谢物检测方法的建立。
(1)样品的提取。稻田水:量取20.0 mL稻田水于200.0 mL离心管,加入25.0 mL含0.1%的甲酸乙腈(V/V),经高速匀浆1 min后,加入1.0 g NaCl和10.0 g MgSO4后再次高速匀浆,以3 500 r/min离心3 min,取上清液1 mL过0.22μm有机滤膜待HPLC-MS/MS检测。
水稻苗(根部、地上部):分别称取5.0 g(精确至0.01g)样品于250.0 mL离心管,加入20.0 mL超纯水充分浸泡30 min,加入25.0 mL含0.1%的甲酸乙腈(V/V),经高速匀浆后2 min,加入1.0 g NaCl和10.0 g MgSO4后再次高速匀浆,以3 500 r/min离心3min。取上清液5 mL待净化。
土壤(60℃烘3 h):分别称取5.0 g(精确至0.01g)样品于200.0 mL离心管,加入20.0 mL超纯水充分浸泡30 min,加入25.0 mL含0.1%的甲酸乙腈(V/V),经摇床振荡30 min后超声提取30 min,加入1.0 g NaCl和10.0 g MgSO4后再次超声提取15 min,以3 500 r/min离心3 min。取上清液5 mL待净化。
(2)样品的净化。取上述上清液5 mL于100 mg C18、50 mg GCB和1.2 g无水MgSO4的混合物,涡旋混合器震荡1 min,充分混匀后,以3 800 r/min离心5 min,取上清液1 mL过0.22μm有机滤膜待HPLC-MS/MS检测。
(3)仪器条件。色谱条件:色谱柱为Poroshell 120 EC-C18(150×2.1 mm,2.7μm) 柱, 流动相为0.1%甲酸水-乙腈溶液(V/V)(0.1%甲酸水为A相,乙腈为B相,梯度洗脱设置为0~5 min,40%~80%B;5~7 min,80%~95%B;7~10 min,95%B;10~10.1 min,95%~40%B;10.1~15 min,40%B; 流速200μL/min, 进样量为2μL。化合物保留时间见表1。
质谱条件:质谱所用电喷雾源为ESI,采用正离子扫描模式,动态多反应监测,离子源温度为300℃,毛细管温度为350℃,鞘气(N2)压力为50 Arb,辅助气(N2)压力为20 Arb,喷雾电压为3 500 V(ESI+)。其他谱参数见表1。

表1 化合物的动态多反应监测质谱采集离子信息
3.氯氟吡啶酯及代谢物氯氟吡啶酸在稻田环境中的消解动态。
(1)土壤的预处理。选取中国水稻研究所富阳基地未曾施用氯氟吡啶酯农药的土壤,风干过1 mm(16目)的筛子,每份约30 kg土壤装于塑盆(60 cm×40 cm×20 cm)中,充分淹水处理48 h待移栽水稻幼苗。
(2)水稻幼苗的培养。水稻品种选用中浙优1号,将种子用2%的NaClO充分浸泡48 h后用蒸馏水反复冲洗,在35℃、空气湿度85%的恒温箱催芽24 h,催好芽的种子转移至秧盘基质进行育秧25 d,将长势一致的秧苗移栽至上述处理好的(60 cm×40 cm×20 cm)塑料盆中,每盆移栽120株,移栽后的秧苗进行7 d的恢复培养。
秧苗在塑料盆恢复处理7 d后进行施药处理,参照农药登记信息网推荐的施药剂量和施用方法,以氯氟吡啶酯推荐施药剂量的2倍(0.240 g(a.i.)/667 m2)进行试验,施药后保水5~7 d,水层保持5 cm,处理组和对照组分别设置3个重复。土培试验于水稻研究所富阳基地的大棚中进行,分别于处理2 h和2、3、5、7、14、21、28 d进行取样。
(3)样品的采集及预处理。随机取水稻幼苗(地上部、根部)5株经剪碎,浅层田水50 mL充分混匀,浅层土壤(5 cm)3个点混匀,经60℃烘箱烘干。所有样品保存在-20℃的冰柜。
二、 结果与分析
(一)HPLC-Q-TOF/MS鉴定氯氟吡啶酯水解产物
1.分析方法稳定性验证。在每次样品采集的过程中进行质控样品的采集,以避免仪器误差引起实验结果的干扰,确保分析系统的稳定性[17]。质控样品的色谱如图1所示,可以看出,质控样品采集的色谱峰重现性良好,可以确保分析过程中仪器系统具有较好稳定性和实验数据结果的可靠性。

图1 质控样品的色谱叠加图(n=4)
2.鉴定结果分析。实验经处理7d后,利用LC-Q-TOF/MS进行数据采集,借助MPP软件对数据进行频数过滤、Ttest(P<0.05)显著分析及倍数比较(FC>2)差异化分析,结果在3组不同的pH处理组中筛选到6个差异化合物,其质荷比m/z值和保留时间如图2所示,其中质荷比m/z值439.042和367.042的2个化合物出峰时间较为接近,均在11.86±0.02 min出峰,而后4个化合物质荷 比m/z值 348.995、 330.848、 302.9896 和268.0243的出峰时间较接近,均在9.53±0.004 min出峰。

图2 处理组中6个差异化合物的质荷比m/z、出峰时间及提取离子色谱图
为了明确中间代谢物的结构,在碰撞能量20 eV的条件下对筛选到的6个差异化合物进行了二级谱图扫描。经MSC软件搜库检索,最终鉴定到2个化合物,具体信息见表2,其中保留时间为11.864 min,质荷比m/z439.042为氯氟吡啶酯,而保留时间为9.544 min,质荷比m/z348.995为氯氟吡啶酸,其质量数偏差分别为1.46和0.8 mDa。为了保证结果的可靠,将样品中鉴定到的氯氟吡啶酯及氯氟吡啶酸与其标准品的出峰时间及二级谱图(见图3~图6)进行确证比对,结果出峰时间完全一致。其他4个差异化合物中质荷比m/z367.042与氯氟吡啶酯的出峰时间相差0.02 min,与标准品碎片离子质荷比m/z值367.042的相对离子丰度和质荷比十分接近,其质量数偏差0.32 mDa,匹配度达到99.6分。而质荷比m/z330.988、302.988和268.024几个离子与氯氟吡啶酸的出峰时间相差±0.004 min,与标准品碎片离子的相对离子丰度和质荷比十分匹配,其质量数偏 差分别为5.6、2.6和2.8 mDa,匹配度分别达到99.9、95.7及98.2分。因此推测其他4个差异化合物是氯氟吡啶酯及氯氟吡啶酸由于源内裂解所产生的碎片离子。

表2 氯氟吡啶酯和代谢物氯氟吡啶酸的基本信息

图3 氯氟吡啶酯在样品(A、C)及标准品(B、D)中的二级色谱图、质谱图
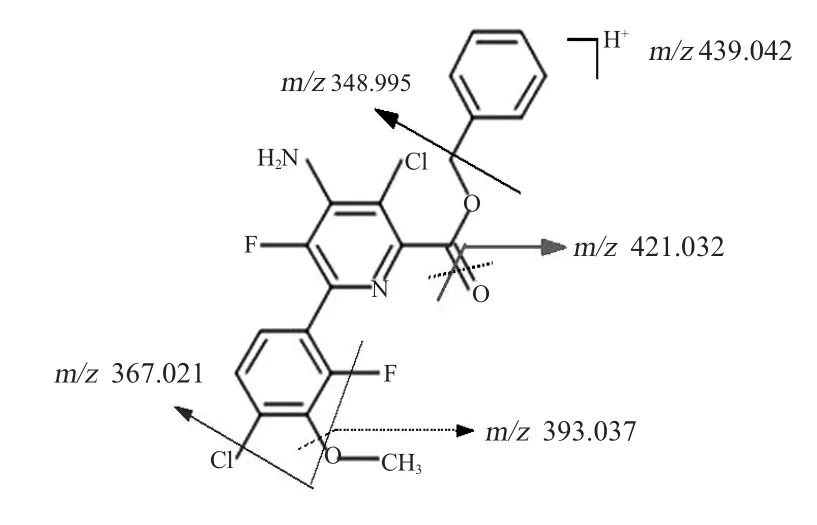
图4 氯氟吡啶酯碎片断裂的可能途径

图5 氯氟吡啶酸在样品(A、B)及标准品(C、D)中的二级色谱图、质谱图

图6 氯氟吡啶酸碎片断裂的可能途径
(二)氯氟吡啶酯及代谢物氯氟吡啶酸检测方法的建立
1.提取溶剂的优化。氯氟吡啶酯及代谢物氯氟吡啶酸均为酸性化合物,提取溶剂中加入适量的酸,能够抑制化合物的电离,使酸性化合物保持相对稳定,有利于提高化合物的回收率。因此分别向提取溶剂乙腈中加入体积为0%、0.1%、0.5%、1%和2%的甲酸以确定最佳提取溶剂。
本试验通过在水稻苗根部、地上部,土壤和稻田水空白基质中的加标水平均为50μg/kg(水50 μg/L),经不同溶剂提取后,氯氟吡啶酯及氯氟吡啶酸的提取回收率如图7所示,由图可知,乙腈中甲酸的含量对氯氟吡啶酯的提取回收率影响不大,回收率均在85%以上。随着甲酸含量的增加,氯氟吡啶酸的提取效率显著增加,当甲酸含量达到0.1%时,回收率可达到97%,因此,选择含有0.1%甲酸乙腈(V/V)溶液作为提取溶剂。

图7 提取溶剂中不同甲酸的含量对氯氟吡啶酯(A)和氯氟吡啶酸(B)提取回收率的影响
2.吸附剂种类及用量的优化。GCB、C18及PSA对基质中甾醇类、花青素、糖类以及部分极性色素具很强的净化能力。然而,吸附剂的种类和添加量都会影响目标化合物的回收率[18~19]。因此考察了GCB、C18及PSA对氯氟吡啶酯及代谢物氯氟吡啶酸的回收率。本实验中2个化合物的加标水平为50μg/kg(水50μg/L),回收率结果见图8。GCB添加剂量为0~50 mg时2个化合物的回收率达到83.6%~103.4%,但是随着添加量的增加,对2个化合物都有明显的吸附作用,吸附率达到30%以上。当C18的添加量为0~200 mg时对2个目标化合物都没有明显的吸附作用,2个化合物的回收率为91.3%~105.6%。当C18的添加量为0~100 mg时,2个目标化合物的基质效应从22%减弱到15%。当PSA添加量为0~200 mg时,氯氟吡啶酯的回收率为97.2%~100.4%,没有吸附作用,而对代谢物氯氟吡啶酸有很强的吸附作用,吸附率达到90%。所以选用50 mg GCB、100 mg C18和1.2 g无水MgSO4时净化剂效果最佳,2个目标化合物回收率达到83.6%~105.6%,基质效应<15%,满足农药检测的要求。
3.方法学评价。
(1)定量限、检出限、线性范围及基质效应。经仪器优化后的条件下测定用初始流动相配制一系列不同浓度的2种化合物的混合标准溶液,以分析物的浓度为横坐标(x,μg/L),定量离子对的响应值为纵坐标(y峰面积),利用外标法进行定量,获得线性方程和相关系数见表3。结果表明,2种化合物在0.5~500.0μg/L线性范围内,化合物的质量浓度与相应的响应值呈较好线性关系,线性相关系数在0.998以上。空白样品中添加2种化合物的标准混合溶液,以S/N=10确定方法的定量限(LOQ),在稻田环境4种基质中氯氟吡啶酯及代谢物氯氟吡啶酸的定量限分别是2.5μg/kg和5.0 μg/kg,两种目标化合在稻田环境4种基质中的基质效应为-0.4%~15.0%。

图8 3种净化剂的添加量对氯氟吡啶酯(A)及氯氟吡啶酸(B)回收率的影响

表3 化合物的检出限、定量限、线性方程及其相关系数和基质效应(n=3)
(2)方法的回收率与精密度。分别称取水稻苗地上部、根部、土壤以及稻田水空白样本进行加标回收试验,每个处理6个重复,对两个化合物在不同添标水平方法的准确度和精密度进行考察。测定结果见表4,可以看出,两种化合物在不同的基质中回收率为89.7%~110.4%,相对标准偏差(RSD)≤10%,回收率和精密度良好,满足SANTE/11945/2015[20]的要求。
(三)氯氟吡啶酯及代谢物氯氟吡啶酸在稻田环境中的消解动态通过土培试验对氯氟吡啶酯和代谢物氯氟吡啶酸在稻田环境中的含量进行动态监测,结果见表5~表6,结果表明,氯氟吡啶酯和代谢物氯氟吡啶酸在稻田环境中降解动态满足一级动力学方程。氯氟吡啶酯在稻田水、地上、根部及土壤基质中半衰期分别为0.3、1.1、1.1和1.2 d,其在稻田水中降解速率最快,施药5 d后降解达到90%,而在植株体和土壤介质中施药21 d后降解率达到90%。代谢物氯氟吡啶酸施药2 h后就出现在稻田环境中,其在稻田水、水稻苗地上、水稻苗根部及土壤基质中的半衰期分别为3.4、1.6、2.4和2.7 d,其在水稻苗地上部降解最快,施药后21 d降解率达到80%。通过参照 《化学农药环境安全评价试验准则》(2008)中农药的环境行为特性等级划分,氯氟吡啶酯和代谢物氯氟吡啶酸在稻田环境各介质中的半衰期T1/2<1(月),属于易降解农药。

表5 氯氟吡啶酯在稻田环境中的消解动态

表6 氯氟吡啶酸在稻田环境中的消解动态
三、结论
本文利用HPLC-Q-TOF/MS高分辨质谱鉴定、标准品确证等手段研究了氯氟吡啶酯的水解产物,结果发现,氯氟吡啶酯在水中主要降解为氯氟吡啶酸。通过优化QuEChERS方法提取溶剂的pH值及3种净化剂(GCB、PSA、C18)的添加剂量,结合高效液相色谱串联三重四极杆质谱技术建立了同时测定稻田中氯氟吡啶酯及其代谢物的方法。结果表明,当方法以0.1%甲酸乙腈(V/V)作为提取溶剂,50 mg GCB、100 mg C18和1.2 g无水MgSO4作为净化剂,2种化合物在4种不同基质中的回收率为89.7%~110.4%,基质效应为-0.4%~15.0%,相对标准偏差≤10%。说明该方法具有较高的精密度、灵敏度高、重现性好,可进行准确的定性定量分析。通过土培试验结果表明,氯氟吡啶酯在稻田环境中富集能力为地上部>根部>稻田水>土壤,水稻苗地上部、水稻苗根部和稻田水在施药2 h后达到最高值,随后迅速降解;代谢物氯氟吡啶酸在施药2 h后即出现在稻田环境里,主要分布在植株和稻田水中。氯氟吡啶酯与代谢物氯氟吡啶酸在稻田环境中半衰期<1(月),施药后28 d在稻田坏境中降解率达到90%以上,属于易降解农药。
