分化型甲状腺癌术后随访的标准化管理及临床相关因素分析
2021-05-10孙洪莉魏枫梁书卿王晓艳郑朦
孙洪莉 魏枫 梁书卿 王晓艳 郑朦

【摘要】 目的:分析分化型甲狀腺癌(differentiatend thyroid cancer,DTC)术后标准化管理随访情况,探讨各临床因素之间的相关性。方法:选取2012年8月-2019年6月于本院就诊的DTC患者104例的临床及随访资料进行回顾性分析。其中55例行甲状腺全切除术治疗,49例行甲状腺次全切除术治疗。术后根据复发危险度分层患者分为低危组(n=30)、中危组(n=52)、高危组(n=22),并进行不同促甲状腺激素(TSH)抑制目标的标准化管理。截止随访结束,所有患者均完成了初治期(术后1年)的术后标准化管理,75例患者进入了随访期(术后>1年)标准化管理。比较三组末次随访时促甲状腺激素(thyroid stimulating hormone,TSH)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺激素(FT4)、甲状腺球蛋白(Tg)、抗甲状腺球蛋白抗体(TgAb)。分析TSH、Tg、TgAb间的相关性。比较三组初治期TSH抑制达标所需左甲状腺素(L-T4)剂量。比较不同DTC术式者初治期L-T4的使用剂量。观察随访期TSH抑制治疗达标者的治疗反应及再次评估复发风险。比较术后有无淋巴结转移者Tg>1 ng/mL与TgAb>115 U/mL的比例。结果:末次随访时,三组TSH、Tg及TgAb水平比较,差异均有统计学意义(P<0.05)。Tg与TgAb呈正相关(P<0.05)。中、高危组TSH抑制达标L-T4所需剂量均低于低危组(P<0.05)。甲状腺全切除术治疗者L-T4使用剂量高于甲状腺次全切除术治疗者(P<0.05)。进入随访期的75例中,复发风险再次评估低、中、高危例数分别为27、33、15例,其中达到TSH抑制目标分别为15例(55.56%)、26例(78.79%)、13例(86.67%)。低、中、高危组达标者各组治疗反应情况比较,差异均无统计学意义(P>0.05)。淋巴结转移组中TgAb>115 U/mL者的比例均高于淋巴结未转移组(P<0.05)。结论:不同术式、复发危险度影响随访管理期间L-T4剂量,Tg与TgAb呈正相关,且随着Tg、TgAb的增高,复发与转移的风险增加。关注上述因素可有效指导临床DTC术后患者用药及标准化随访与管理。
【关键词】 分化型甲状腺癌 术后随访 标准化管理
[Abstract] Objective: To analyze the postoperative follow-up of standardized management in differentiated thyroid cancer (DTC), and to explore the correlation between different clinical factors. Method: The clinical and follow-up data of 104 patients with DTC in our hospital from August 2012 to June 2019 were retrospectively analyzed. Among them, 55 cases were treated with total thyroidectomy and 49 cases with subtotal thyroidectomy. The patients were divided into low risk group (n=30), medium risk group (n=52) and high risk group (n=22) according to the recurrence risk, and were given standardized management of different thyroid stimulating hormone (TSH) inhibition targets. By the end of follow-up, all patients had completed the standardized management in the initial treatment period (1 year after operation), and 75 patients entered the follow-up period (>1 year after operation). Thyroid stimulating hormone (TSH), free triiodothyronine (FT3), free thyroid hormone (FT4), thyroglobulin (Tg) and anti thyroglobulin antibody (TgAb) were compared among the three groups at the last follow-up. The correlation among TSH, Tg and TgAb was analyzed. The dosage of levothyroxine (L-T4) required for reached the TSH inhibition target in the initial treatment period were compared among the three groups. The dosage of L-T4 in different DTC operation modes was compared in the initial treatment period. The treatment response of patients reached the TSH inhibition target were observed during the follow-up period and reevaluate the risk of recurrence. The ratio of Tg>1 ng/mL and TgAb>115 U/mL in patients with or without lymph node metastasis were compared. Result: At the last follow-up, there were statistically significant differences in TSH, Tg and TgAb levels among the three groups (P<0.05). There was a positive correlation between Tg and TgAb (P<0.05). The dosages of L-T4 required for reached the TSH inhibition target in the medium and high risk groups were lower than those in the low risk group (P<0.05). The dose of L-T4 in patients with total thyroidectomy was higher than that in patients with subtotal thyroidectomy (P<0.05). Among the 75 patients entered the follow-up period, 27, 33 and 15 cases of recurrence risk reassessment were low, medium and high risk, respectively. Among them, 15 cases (55.56%), 26 cases (78.79%) and 13 cases (86.67%) reached the TSH inhibition target, respectively. There were no statistical significances in treatment response among the low, medium and high risk groups (P>0.05). The proportion of TgAb>115 U/mL in the lymph node metastasis group was higher than that in the without lymph node metastasis group (P<0.05). Conclusion: Different operation methods and recurrence risk affect the L-T4 dose during the follow-up management, Tg is positively correlated with TgAb, and with the increase of Tg and TgAb, the risk of recurrence and metastasis increases, paying attention to the above factors can effectively guide the medication and standardized follow-up and management of DTC patients.
[Key words] Differentiatend thyroid cancer Postoperative follow-up Standardized management
First-authors address: The First Affiliated Hospital of Baotou Medical College, Inner Mongolia University of Science and Technology, Baotou 014010, China
doi:10.3969/j.issn.1674-4985.2021.08.040
甲状腺癌(thyroid cancer,TC)发病率逐年上升,且以女性多见。2018版我国国家卫生健康委员会最新甲状腺癌诊疗规范指南全球肿瘤登记中心数据显示,我国城市地区女性发病率居女性所有恶性肿瘤的第4位[1]。我国TC发病率将以每年20%的速度持续增长。手术是其主要治疗方法,但仍有30%患者术后出现复发和转移[2]。促甲状腺激素(TSH)可促进甲状腺细胞增殖与甲状腺球蛋白(Tg)生成,乳头状癌(PTC)和滤泡癌(FTC)均有TSH受体,TSH通过其受体能影响TC的生长[3-4]。所以,必须对分化型甲状腺癌(differentiatend thyroid cancer,DTC)术后患者进行TSH抑制治疗。本研究根据不同复发危险度分层的TSH抑制目标进行术后随访的标准化管理,探讨DTC术后随访情况与各临床因素之间的相关性,以期为临床诊疗提供参考,现报道如下。
1 资料与方法
1.1 一般资料 选取2012年8月-2019年6月于本院就诊的104例DTC患者的临床及随访资料进行回顾性分析。纳入标准:均确诊为DTC,且经手术治疗;临床及随访资料完整。排除标准:合并意识、沟通和精神异常;合并严重心、肝、脑、肺等终末期疾病;合并下丘脑-垂体轴相关疾病;合并甲亢或甲减病史。据文献[5]甲状腺结节及分化型甲状腺癌指南复发危险度分层将患者分为低危组(n=30)、中危组(n=52)、高危组(n=22)。104例患者中,55例行甲状腺全切除术治疗,49例行甲状腺次全切除术治疗;截止随访结束,所有患者均完成了初治期(术后1年)的术后标准化管理,75例患者进入了随访期(术后>1年)标准化管理。本研究已经医院伦理委员会批准。
1.2 方法 所有患者院内均进行了甲状腺功能与甲状腺彩超等检查,进行TSH替代及其副反应治疗,待游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、TSH、Tg、TgAb达标及甲状腺彩超无明显异常、患者无明显不良反应情况下出院随访。初治期与随访期均进行甲状腺功能与甲状腺彩超监测、TSH替代治疗及其副反应治疗。采用门诊复查、电话、微信等方式对患者进行随访,时间为27.02(10.00,48.00)个月,共随访273次。据标准化随访与管理,在初治期,每3~6个月做1次甲状腺超声,4~6周测1次FT3、FT4、TSH,6个月测1次Tg、TgAb,根据检查结果调整左甲状腺素(L-T4,生产厂家:德国默克Merck KGaA,批准文号:国药准字J20160065,规格:50 μg)剂量。根据(CSCO)持续/复发及转移性分化型甲状腺癌诊疗指南,Tg>1 ng/mL、TgAb>115 U/mL时复发风险升高;TSH抑制目标:低危组TSH<2 mU/L;中危组TSH<0.5 mU/L;高危组TSH<0.1 mU/L[6]。初治期起始剂量为25~50 μg/d(小剂量开始),每天晨起空腹口服,1个月后复查甲功调整剂量至治疗目标后按此剂量长期口服至下次复查[7]。随后,每6~12个月复查1次上述指标,并依据患者TSH抑制治疗后的全身情况,给予对症处理或再次调整剂量[8]。L-T4從上次口服剂量以12.5 μg起加量后每月复查调整剂量至TSH抑制目标。
1.3 观察指标及评价标准 (1)比较三组一般资料及末次随访时甲状腺功能相关指标。(2)分析TSH、Tg、TgAb间的相关性。(3)比较三组初治期TSH抑制达标所需L-T4剂量。(4)比较不同DTC术式初治期L-T4使用剂量。(5)随访期TSH抑制治疗达标者的治疗反应及复发风险再次评估。良好反应:Tg稳定,<30 ng/mL,TgAb及影像学检查结果为阴性;生化不全反应:Tg>30 ng/mL或TSH水平相似的情况下逐渐升高,TgAb水平升高趋势,影像学检查阴性结果;结构不完全反应:Tg及TgAb水平任何情况,影像学检查提示有结构性或功能性病灶;不确定反应:Tg无明确要求,TgAb水平无结构性或功能性病灶情况下稳定或逐渐下降,影像学检查非特异性发现。(6)比较术后有无淋巴结转移者Tg>1 ng/mL与TgAb>115 U/mL的比例。
1.4 统计学处理 采用SPSS 17.0软件对所得数据进行统计分析,符合正态分布的计量资料用(x±s)表示,比较采用t检验,多组间资料比较采用单因素方差分析;不符合正态分布的计量资料用M(P25,P75)表示,比较采用Mann-Whitney U检验;计数资料以率(%)表示,比较采用字2检验。相关性分析采用Spearman相关系数。以P<0.05为差异有统计学意义。
2 结果
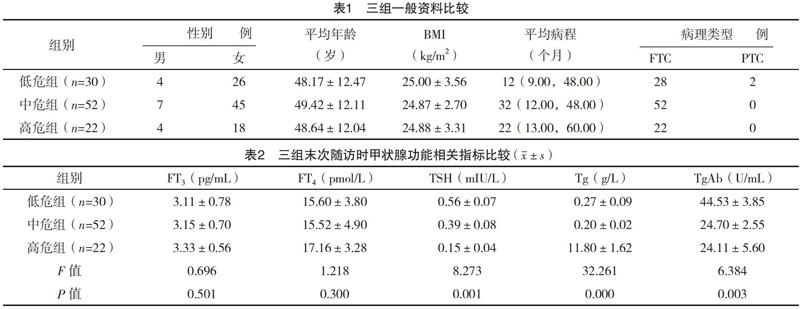
2.1 三组一般资料比较 三组性别、年龄、病程等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
2.2 三组末次随访时甲状腺功能相关指标比较 末次随访时,三组TSH、Tg及TgAb水平比较,差异均有统计学意义(P<0.05);三组FT3及FT4水平比较,差异均无统计学意义(P>0.05),见表2。
2.3 TSH、Tg、TgAb间的相关性 Tg与TgAb呈正相关,差异有统计学意义(P<0.05),见表3。
2.4 三組初治期TSH抑制达标所需L-T4剂量比较 DTC患者术后1年内,104例中有72例达标,其中低危组TSH抑制达标26例,中危组32例,高危组14例。低危组TSH抑制达标L-T4所需剂量为(87.25±21.76)μg/d,中危组(100.95±19.33)μg/d,高危组(106.25±35.01)μg/d。中、高危组TSH抑制达标L-T4所需剂量均低于低危组,差异均有统计学意义(t=1.188、1.054,P=0.014、0.043)。中危组与高危组TSH抑制达标所需L-T4剂量比较,差异无统计学意义(t=3.309,P=0.508)。
2.5 不同DTC术式者初治期L-T4使用剂量比较 甲状腺全切除术治疗者L-T4使用剂量为(105.91±23.95)μg/d高于甲状腺次全切除术治疗者(87.76±24.07)μg/d,差异有统计学意义(t=3.850,P<0.05)。
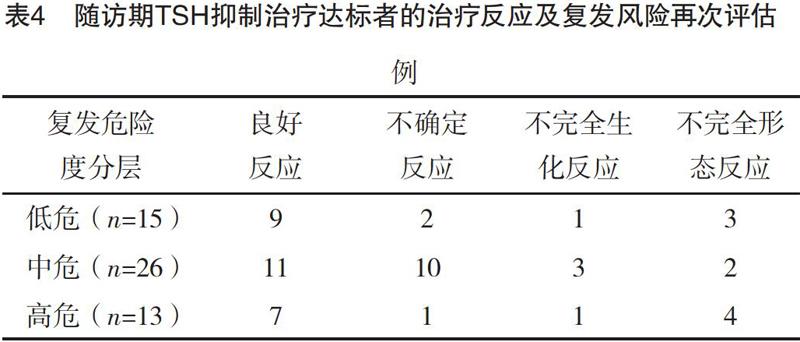
2.6 随访期TSH抑制治疗达标者的治疗反应及复发风险再次评估 进入随访期的75例中,复发风险再次评估低、中、高危例数分别为27、33、15例,其中达到TSH抑制目标分别为15例(55.56%)、26例(78.79%)、13例(86.67%)。低、中、高危组达标者治疗反应情况比较,差异均无统计学意义(P>0.05)。见表4。
2.7 术后有无淋巴结转移者Tg>1 ng/mL与TgAb>115 U/mL的比例 104例患者中,有10例发生淋巴结转移,94例未发生淋巴结转移。淋巴结转移组中TgAb>115 U/mL者的比例均高于淋巴结未转移组,差异有统计学意义(字2=6.377,P<0.05),两组Tg>1 ng/mL者的占比比较,差异无统计学意义(P>0.05)。见表5。
3 讨论
DTC术后随访及监控目的,一是早期发现残存或复发病灶,早治疗以提高生存率;二是对TSH抑制治疗进行监控;三是对DTC患者的某些伴发疾病病情进行动态观察[9-10]。据临床指南:每4~6周随访复查甲功,达标后可3~6个月复查1次[11]。对已清除全部甲状腺的DTC患者,建议定期采用同种检测试剂检测血清Tg,长期随访从131I清甲后6个月开始,131I治疗后12个月,复查TSH刺激后的Tg,随后,每6~12个月复查基础Tg。每次测定Tg时应同时检测TgAb。术后首次超声检查为高危患者术后3个月,中、低危患者术后6个月。对可疑淋巴结可行超声引导下穿刺活检和/或穿刺针冲洗液的Tg检测。复发风险(阴性)为:低危组TSH<2 mU/L、中危组TSH<0.5 mU/L、高危组TSH<0.1 mU/L。本研究结果显示末次随访时,三组TSH、Tg及TgAb水平比较,差异均有统计学意义(P<0.05);Tg与TgAb呈正相关(P<0.05)。可见术后监控TSH、Tg及TgAb水平均有重要意义,Tg与TgAb可能为复发风险的相关因素。
本研究结果显示,中、高危组TSH抑制达标L-T4所需剂量均低于低危组(P<0.05);甲状腺全切除术治疗者L-T4使用剂量高于甲状腺次全切除术治疗者(P<0.05),目前尚未发现探讨TSH抑制达标状态下L-T4剂量的相关文献报道。术式与L-T4剂量关系对指导临床DTC术后患者具有重要意义,本研究中次全切者L-T4使用剂量最少为25 μg/d(1例),最高为125 μg/d(4例);全切者L-T4使用剂量最少为62.5 μg/d(1例),最高为175 μg/d(2例)。不同复发风险与不同术式会产生用药剂量相差悬殊的情况,可见个体化治疗占据着重要地位。
本文对随访期DTC患者进行了复发风险再次评估,并观察了TSH抑制治疗达标者的治疗反应,进入随访期的75例中,复发风险再次评估低、中、高危例数分别为27、33、15例,其中达到TSH抑制目标分别为15例(55.56%)、26例(78.79%)、13例(86.67%)。低、中、高危组达标者治疗反应情况比较,差异均无统计学意义(P>0.05),不完全生化反应人数相对甚少。TSH抑制治疗下的患者出现心肌、胸闷、失眠的不良反应,在L-T4减量或分次口服等处理后可改善,提示5~10年无病生存将不只进行L-T4替代治疗,此时更应关注未达标患者的全身情况,评估是否继续当前治疗。复发危险度分层基于了TSH抑制治疗副反应风险分层,随访期中高危患者,应个体化抑制TSH至接近达标的最大可耐受程度,予以动态评估。动态监测评估患者治疗反应,疗效满意,代表患者复发风险从髙危降为低危,则TSH抑制目标可放宽至正常范围的低值;若生化疗效甚至结构性疗效不佳,则意味患者仍有高危复发风险,需结合副作用风险将TSH抑制到较低水平[11]。定期检测相关指标,危险分层在随访期重新评估后,将TSH抑制目标适当放宽,控制在接近达标的最大可耐受程度。
正常情况Tg不释放入血,仅在甲状腺滤泡细胞和甲状腺滤泡腔内进行循环。当发生癌变时溶酶体对其表面的甲状腺素进行水解随之释放入血[12-13]。它是功能性甲状腺组织或转移灶存在的重要标志物,对DTC预后判断和监测治疗效果有重要意义[14]。Tg释放入血后可作为抗原产生抗体TgAb,具有高度特异性[15]。TgAb的存在会降低通过化学发光免疫法检测血清Tg的值,从而影响Tg监测病情的准确性[16]。因此强调在术后随访的过程中同时监测Tg与TgAb。流行病学调查显示,术后10年内有15%~25%的患者会出现颈部淋巴结转移或远处转移,是导致患者死亡的主要原因[17-18]。本研究中,淋巴结转移组中TgAb>115 U/mL者的比例均高于淋巴结未转移组(P<0.05),两组Tg>1 ng/mL者的占比比较,差异无统计学意义(P>0.05)。DTC患者随着TgAb>115 U/mL发生率的升高,淋巴结转移风险增加,但仍需除外由随访偏倚或TgAb值偏高使Tg值出现假阴性造成的影响。
综上所述,不同术式、复发危险度影响随访管理期间L-T4剂量,Tg与TgAb呈正相关,且随着Tg、TgAb的增高,复发与转移的风险增加。关注上述因素可有效指导临床DTC术后患者用药及标准化随访与管理,从而改善病情,延缓进展,为患者带来更多的福音。
参考文献
[1]中华人民共和国国家卫生健康委员会.甲状腺癌诊疗规范(2018年版)[J/OL].中华普通外科学文献(电子版),2019,13(1):1-15.
[2]田文,郗洪庆,王冰.重视甲状腺癌术后规范化长期随访[J].中国实用外科杂志,2017,37(9):937-940.
[3] Marcelino M,Lopes A F,Madureira D,et al.Ability of the rh TSH stimulation test to predict relapse in patients with differentiated thyroid carcinoma,after long-term follow-up[J].Onco Lett,2015,9(3):1281-1286.
[4]王玉金,申艳红,王洪雷,等.血清TgAb水平在分化型甲状腺癌术后转移复发中的预测价值[J].现代生物医学进展,2017,17(27):5279-5282.
[5]滕卫平,刘永锋,高明,等.甲状腺结节和分化型甲状腺癌诊治指南[J].中华内分泌代谢杂志,2012,28(10):779-797.
[6]方学庆,周立,唐民.分化型甲状腺癌术后激素水平变化及对促甲状腺激素抑制治疗的指导[J].局解手术学杂志,2018,27(8):577-580.
[7]中国临床肿瘤学会指南工作委员会.中国临床肿瘤学会(CSCO)持续/复发及转移性分化型甲状腺癌诊疗指南2019[M].北京:人民卫生出版社,2019.
[8]朱有志,陈祥锦,崔文霞.分化型甲状腺癌术后左甲状腺素钠个体化治疗102例临床分析[J].福建医药杂志,2012,34(1):88-91.
[9] Haugen,B R,Alexander,E K,Bible K C,et al.2015 American Thyroid Association Association Management Guideliness for Adult Patients With Thyroid Nodules and Differentiated Thyroid Cancer:The American Thyroid Association Guidelines Task Force on Nodules and Differentiated Thyroid Cancer[J].Thyroid,2016,26(1):1-133.
[10]李平栋.甲状腺癌的术后随访及监控[J].中国医学文摘(耳鼻咽喉科学),2012,27(4):211-214.
[11] Momesso D P,Tuttle R M.Update on differentiated thyroid cancer slaging[J].Endocrinol Metab Clin North Am,2014,43(2):401.
[12]李林通,计成,严思敏,等.分化型甲状腺癌患者术后左甲状腺素最佳初始剂量预测模型探讨[J].中国药房,2019,30(3):387-391.
[13] Liu L,Huang F,Liu B,et al.Detection of distant metastasis at the time of ablation in children with differentiated thyroid cancer:the value of pre-ablation stimulated thyroglobulin[J].J Pediatr Endocrinol Metab,2018,31(7):751-756.
[14] Middendorp M,Grunwald F.Up date on recent developments in the therapy of dierentiated thyroid cancr[J].Semin Nucl Med,2010,40(2):145-152.
[15]宋锦丽,庞华.甲状腺球蛋白在分化型甲状腺癌预后中的意义[J].中国医学创新,2015,12(13):150-153.
[16] Bachelot A,Leboulleux S,Baudin E,et al.Neck recurrence from thyroid carcinoma:serum thyroglobulin and high-dose total body scan are not reliable criteria for cure after radioiodine trearment[J].Clinical Endocrinology,2005,62(3):376-379.
[17] Lote H,Bhosle J,Thway K,et al.Epidermal growth factor mutation as a diagnostic and therapeutic target in metastatic poorly differentiated thyroid carcinoma:a case report and review of the literature[J].Case Rep Oncol,2014,7(2):393-400.
[18]韓淼,周长明,赵康.甲状腺癌术后促甲状腺激素抑制治疗与甲状腺激素替代治疗的疗效对比[J].实用癌症杂志,2018,33(9):1550-1552.
(收稿日期:2020-09-29) (本文编辑:田婧)
