鼠神经生长因子肌肉注射治疗脑性瘫痪高危儿运动障碍的临床观察
2021-03-31段光敏邱红燕
段光敏,邱红燕,邓 超
(内江市第一人民医院儿科,四川 内江 641000)
脑性瘫痪(cerebral palsy,CP)又称脑瘫,是婴幼儿的常见疾病[1]。而脑瘫高危儿是指有早产、低出生体重、窒息及缺氧缺血性脑病、颅内损伤和高胆红素血症等高危病史的患儿[2]。脑瘫高危儿患脑瘫的几率远远高于普通儿童,如果无干预措施或治疗不善,后期易患上脑瘫,脑瘫常合并癫痫和智力异常[3],所以应在有预兆时尽早进行干预。鼠神经生长因子(mouse nerve growth factor,MNGF)是一种重要的神经营养因子和神经保护剂[4],可以促进轴突定向再生、神经元胞体存活及髓鞘生成功能,常用于中风、颅脑损伤等疾病的治疗,也可用于治疗脑瘫。而MNGF治疗脑瘫高危儿运动功能障碍的报道不多。为探讨MNGF肌肉注射对脑瘫高危儿运动障碍的疗效,本研究选取100例脑瘫高危儿进行治疗观察,现将结果报告如下。
1资料与方法
1.1一般资料
根据纳入、排除标准[3]选取2016年12月至2018年12月内江市第一人民医院收治的脑瘫高危患儿100例展开临床治疗观察。纳入标准:①患儿均有患脑瘫的高危因素(包括早产儿、高胆红素血症、窒息、缺氧缺血性脑病、脑膜炎及低血糖脑损伤、颅内出血);②具有明显的临床表现,例如Vojta姿势反射异常、运动发育落后及肌张力异常等运动功能障碍;③医学影像学检查(包括B超、CT和MRI)检查异常率超过20%。排除标准:①有MNGF治疗禁忌证者;②严重脏器功能不全者;③严重感染者;④确诊为先天遗传性代谢性疾病及染色体疾病;⑤无法坚持完整的疗程;⑥随访脱落患者。按照随机数字表法将100例患儿分为肌肉注射组与常规组。肌肉注射组:男28例,女22例;平均年龄为(8.1±2.8)周龄;早产儿21例,高胆红素血症11例,窒息及缺氧缺血性脑病5例,脑膜炎8例,颅内出血5例。常规组:男25例,女25例;平均年龄为(8.2±2.4)周龄;早产儿20例,高胆红素血症15例,窒息及缺氧缺血性脑病5例,脑膜炎3例,颅内出血7例。两组基线资料比较差异均无统计学意义(均P>0.05),具有可比性。患儿监护人知晓本研究目的且已签署同意书,研究已经过院内伦理委员会批准(编号:NJRMY2016031)。
1.2治疗方法
常规组采用常规康复训练外,患儿进行常规的脑瘫辅助康复治疗,采用运动疗法为主,配合推拿、按摩、针灸等,每天1次,1次40min,每周5次,84天(12周)为1个疗程,持续2个疗程。
肌肉注射组除进行常规组相同的常规康复训练外,还给予注射用MNGF(国药准字:S20060051;商品名:金路捷)治疗,给药方案:患儿达4周龄时开始20μg,肌肉注射,隔天注射;患儿达8周龄开始给予注射用MNGF(国药准字S20060023)30μg,肌肉注射,隔天注射,12周为1个疗程,持续1个疗程。
1.3效果指标
治疗前后对所有患儿进行贝利婴幼儿发育量表测试,比较治疗前后运动发展指数(PDI)所得分数;计算分差,提高分数>20分为显著有效,提高10~20分为有效,提高<10分为无效。随访2年后,观察并记录两组患脑瘫的例数。有效率=(显著有效例数+有效例数)/总例数×100%。
治疗前后比较患儿的运动功能:采用Peabody运动发育量表比较患儿的精细运动发育商(fine motor development quotient,FMQ)、粗大运动发育商(gross motor development quotient,GMQ)及总运动商(total motor development quotient,TMQ)评分,分值越高代表运动功能越好。观察比较两组不良反应发生率,不良反应发生率=(不良反应发生例数/总例数)×100%。
1.4统计学方法
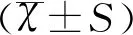
2结果
2.1两组疗效比较
肌肉注射组的有效率高于常规组,差异有统计学意义(χ2=6.353,P<0.05);随访2年后,肌肉注射组无脑瘫病例发生,常规组有3例发生脑瘫,脑瘫发生率为6.00%,见表1。
2.2两组患儿的运动功能比较
与治疗前比较,两组患儿FMQ、GMQ、TMQ评分均显著升高,差异均有统计学意义(肌肉注射组:t值分别为4.062、4.027、4.909;常规组:t值分别为2.264、2.619、3.098;均P<0.05)。治疗后,肌肉注射组患儿FMQ、GMQ、TMQ评分均显著高于常规组,差异均有统计学意义(t值分别为2.347、2.433、2.286,均P<0.05),见表2。

表1 两组脑瘫高危儿临床疗效比较[n(%)]
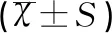
表2 治疗前后两组患儿运动功能比较
2.3两组不良反应发生率比较
肌肉注射组发热3例,恶心0例,呕吐0例,腹泻2例,不良反应总发生率为10.00%;常规组发热1例,恶心1例,呕吐0例,腹泻1例,不良反应总发生率为6.00%。两组的不良反应发生率差异无统计学意义(χ2=0.543,P>0.05)。
3讨论
3.1国内外研究基础
小儿脑瘫的主要临床症状是明显的运动功能障碍,并且大多伴有智力或精神障碍、语言及听觉障碍、行为异常和癫痫等[5]。目前脑瘫的发生机制尚不明确,但现已证实有多种诱发原因[6],包括在妊娠前或妊娠期间、围产期和分娩后这3个时期:在妊娠前或妊娠期间,主要诱因有父亲和(或)母亲吸烟酗酒、患精神疾病、妊娠期糖尿病或高血压、先兆流产和有流产史等;围产期的主要因素有早产、极低出生体重、产钳分娩、子宫内感染、脐带绕颈等;分娩后的主要因素包括颅内出血、新生儿肺炎、缺血缺氧性脑病、新生儿核黄疸和感染等。由此可见,脑瘫的诱发原因较多,而且该病对患儿的生长发育会造成严重的不良影响,增加了家庭及社会的心理及经济负担。临床医生需将脑瘫的预防和诊治作为研究的重点,对脑瘫高危儿进行干预和管理的意义重大,以期能够降低该病的发生率,并且有效改善临床效果。
3.2肌肉注射MNGF治疗脑瘫的疗效及机制
有研究表明,婴儿脑形态和功能处于早期发育期,发育非常旺盛,大脑的可塑性极强,姿势及运动未固定化,所以早期干预对治疗患有脑瘫的高危儿童尤为重要[7]。MNGF是目前发现最早的、认识较为深入的从小鼠的颌下腺中提取出来而且具有生物活性的神经生长因子[8]。本研究结果显示MNGF对防治脑瘫具有较为理想的效果,对脑瘫高危儿在常规治疗的基础上给予MNGF注射治疗能够显著预防脑瘫,可能与以下4个方面机制有关:①婴幼儿发育早期给予外源性MNGF,一定程度上满足了神经再生的需要,可帮助周围的神经修复和再生,这与Han等[9]的研究结果一致。②神经生长因子是在外周神经系统和中枢神经的分化中必不可少的物质之一[10-11],MNGF不仅可以促进神经系统损伤修复,也增强了神经元的供氧能力、增强其神经递质活性和自我修复能力。本研究结果与牛国辉等[11]的结论相似,他们认为MNGF能够促进神经胶质纤维酸性蛋白的表达,从而在神经损伤的修复中发挥作用,其机制可能是促进海马区神经元的修复及前体细胞分化,从而加快损伤神经功能的重建,建立持久的神经通路。③虽然MNGF分子量较大(约为26.5kD),婴儿的血脑屏障发育并不成熟,颅脑损伤后血脑屏障通透性明显增加,因此MNGF可以自由进出脑组织发挥药效[12]。④本研究在高危儿的早期进行反复的感官和运动机能刺激训练,大脑可进行功能的重组,因此,早期进行干预和治疗能够保证患儿潜力的激发。两组的不良反应发生率比较无显著差别,说明MNGF进行肌肉注射具有较高的安全性,这与元芳芳等[12]的研究结果一致。
3.3局限性及结论
综上所述,脑瘫高危儿在常规治疗基础上连续应用MNGF能够有效预防脑瘫发生,显著改善患儿的运动功能,是值得推广的临床预防和治疗方法。但本研究还存在局限性,MNGF肌肉注射预防脑瘫高危儿的临床疗效、安全性等有待长时间、多中心、大样本的临床观察。
