HIV母婴阻断新生儿早期肠道菌群特征分析
2021-03-01马丙南朱炜春林菁周洁雯高智群
马丙南,朱炜春,林菁,周洁雯,高智群
广州市第八人民医院,广州510440
随着预防人类免疫缺陷病毒(HIV)母婴传播工作在全球范围内的推进,抗逆转录病毒药物疗法(ART)预防HIV母婴传播的方法逐渐得到普及,规范执行包含ART在内的母婴阻断措施的HIV感染母亲所生新生儿(HIV母婴阻断新生儿)感染HIV的概率几乎为零[1]。由于母婴垂直传播感染率逐年下降,宫内暴露于HIV和ART但未感染(HEU)儿童的人数逐渐增多,关于HIV暴露和母婴阻断措施对HEU儿童生长发育的影响也引起了越来越多的关注。国内外研究发现,与正常儿童相比,HEU儿童会有体格生长发育落后和神经发育障碍的高风险;体格发育不良经过营养干预后多可以恢复到正常,但神经发育障碍如注意力下降、记忆力减退及社交互动行为减少等纠正存在困难。出现这些问题的原因主要认为是围产期暴露于HIV和ART,即生命早期的暴露可能持续影响了其后续的生长发育,但是关于产生相关影响的具体作用机制目前尚不清楚[2-4]。肠道菌群作为菌群—肠—脑轴(MGBA)的重要环节,在神经发育、情绪、行为和认知过程中起到重要作用[5]。围产期和新生儿期是神经发育的关键时期,HIV母婴阻断新生儿在此期间出现肠道菌群的异常可能会对其神经发育产生长期的影响[6]。本研究通过高通量测序分析HIV母婴阻断新生儿早期肠道菌群的构成特征,旨在寻找影响HIV母婴阻断新生儿神经功能发育的潜在因素,以期发现HIV母婴阻断新生儿早期肠道菌群的干预靶点和治疗方向,为HEU儿童神经发育障碍寻找可行的早期预防方法。
1 资料与方法
1.1 临床资料 本研究为前瞻性、观察性研究,选取2019年1月—12月在广州市第八人民医院出生的HIV母婴阻断新生儿20例(母婴阻断组)及同期与之胎龄及出生体质量方面相匹配的健康母亲所生新生儿20例(对照组),胎龄及出生体质量相匹配的标准为胎龄相差5 d以内、体质量相差200 g以内。母婴阻断组纳入标准:①新生儿母亲HIV呈阳性,且已规范接受HIV母婴阻断治疗,无糖尿病、高血压、肥胖及慢性感染性疾病等其他基础性疾病;②新生儿在本院出生并在生后4 h内开始进行预防性ART;③胎龄≥37周;④出生体质量≥2.5 kg。对照组纳入标准:①母亲HIV呈阴性,无糖尿病、高血压、肥胖及急慢性感染性疾病等基础性疾病;②顺产出生,母乳喂养;③胎龄≥37周;④出生体质量≥2.5 kg。排除标准:①出生时中、重度窒息;②有发育畸形或先天性基础病;③母亲分娩前1个月内使用过抗生素或肠道微生态制剂;④新生儿需使用抗生素或肠道微生态制剂治疗。母婴阻断组男12例,女8例,胎龄(38.63±0.91)周,出生体质量(3 398.00±387.29)g,开奶时间(2.10±0.91)h,母亲年龄(29.50±3.59)岁;对照组男9例,女11例,胎龄(38.84±1.10)周,出生体质量(3 367.50± 365.12)g,开奶时间(2.23±0.90)h,母亲年龄(29.30±3.88)岁。两组研究对象性别、胎龄、出生体质量、开奶时间及母亲年龄等基线资料比较均无统计学意义。本研究通过广州市第八人民医院医学伦理委员会备案审批,新生儿监护人均签署知情同意书。
1.2 粪便标本采集 两组研究对象均在出生后的第7天采集新鲜粪便标本,采集过程中严格遵循无菌操作。用无菌棉签剥去新鲜粪便表层,避免混入尿液或其他杂物,更换棉签,挑取内层粪便至少1 g,装入无菌冻存管中。收集后立即置于-20℃冰箱保存,并于24 h内转入实验室,用-80℃冰箱冻存备用。
1.3 肠道菌群DNA提取和纯化 使用QlAamp DNA Stool Mini Kit提取试剂盒(德国Qiagen公司)提取DNA,使用QubitFluorometer试剂盒(美国Life Technologies公司)检测DNA浓度,使用1%琼脂糖凝胶电泳检测样品完整性。利用Taq酶(上海生工)对选择区域(V3~V4区)进行扩增,PCR引物为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和 806R(5′-GGACTACHVGGGTWTCTAAT-3′)。使用 1%琼脂糖凝胶电泳检测合格后,将样品送实验室进行肠道细菌16 S高通量测序分析。
1.4 细菌16 S高通量测序 使用Illumina Hiseq 2500(美国Illumina公司)测序平台进行PE250建库测序,利用双末端测序(Pair-end)的方法,每条序列从5′端和3′端各产生250读长(reads)。将测序获得的原始数据在进行分析前对其进行剪切及过滤,滤除低质量reads,获得有效数据;通过有效数据之间的重叠关系将reads拼接成标签(Tags),进一步过滤获取目标片段;按照97%的相似度将Tags聚类成操作分类单元(OTU),与已知物种的16 S数据库比对进行OTU物种注释,从而得到每个样品的群落组成信息。
1.5 肠道菌群多样性及相对丰度分析 对样品群落组成行Alpha多样性分析,包括Observed Species指数、Chao1指数及Shannon指数。上述指数中可以通过Observed Species指数及Chao1指数评估各样品的物种丰富度,通过Shannon指数评估各样品的物种多样性和均匀度,指数的值越大代表样品的多样性越丰富。对两组在门、科、属水平的肠道优势菌群相对丰度进行比较,分析其细菌丰度差异。
1.6 统计学方法 采用SPSS22.0统计软件。计量资料以表示,组间比较行独立样本t检验。P<0.05为差异有统计学意义。
2 结果
本研究40份样品共检测到2 163 156条高质量细菌序列,其中母婴阻断组与对照组各检测到1 006 231、1 156 925条。所有样本序列共聚类出522个OTUs,其中母婴阻断组及对照组各聚类出388、410个OTUs,两组共有OTUs为276个。
2.1 两组肠道菌群Alpha多样性指数比较 母婴阻断组Observed Species指数及Chao1指数均低于对照组(P均<0.05),两组Shannon指数比较差异无统计学意义。见表1。
表1 两组肠道菌群Alpha多样性指数比较()

表1 两组肠道菌群Alpha多样性指数比较()
images/BZ_37_1284_471_2243_589.png母婴阻断组对照组20 20 t P 95.67±12.29 111.80±18.13 3.293 0.002 129.43±9.54 140.12±11.98 3.122 0.003 1.22±0.50 1.58±0.67 1.926 0.062
2.2 两组在门水平肠道优势菌群相对丰度比较 两组肠道菌群的优势菌门均为厚壁菌门、变形菌门、拟杆菌门和放线菌门,这4个菌门的相对丰度之和占所有肠道细菌丰度的99.13%。母婴阻断组拟杆菌门相对丰度低于对照组(P<0.05),两组厚壁菌门、变形菌门和放线菌门相对丰度比较差异无统计学意义。见表2。
表2 两组肠道优势菌群在门水平相对丰度比较(%,)
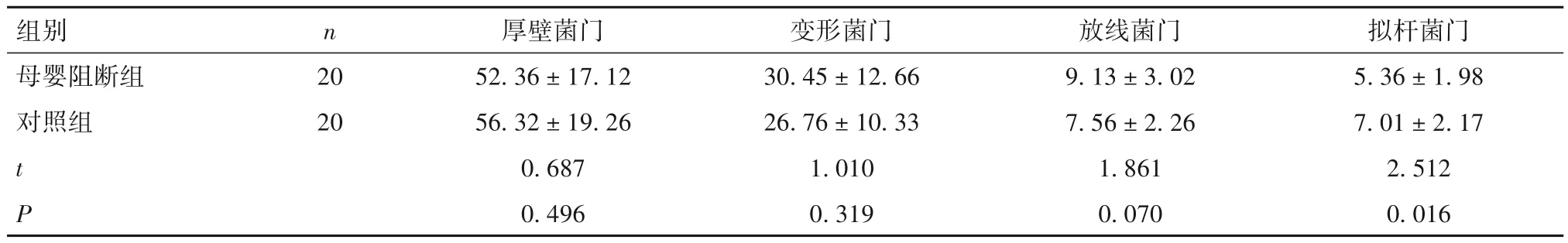
表2 两组肠道优势菌群在门水平相对丰度比较(%,)
images/BZ_37_235_1412_2243_1471.png母婴阻断组对照组20 20 t P 52.36±17.12 56.32±19.26 0.687 0.496 30.45±12.66 26.76±10.33 1.010 0.319 9.13±3.02 7.56±2.26 1.861 0.070 5.36±1.98 7.01±2.17 2.512 0.016
2.3 两组在科水平肠道优势菌群相对丰度比较 母婴阻断组双歧杆菌科相对丰度低于对照组(P<0.05),两组其他菌科比较差异无统计学意义。见表3。
2.4 两组在属水平肠道优势菌群相对丰度比较 母婴阻断组双歧杆菌属、梭菌属相对丰度低于对照组(P均<0.05),其他菌属比较差异无统计学意义。见表4。
表3 两组肠道优势菌群在科水平相对丰度比较(%,)
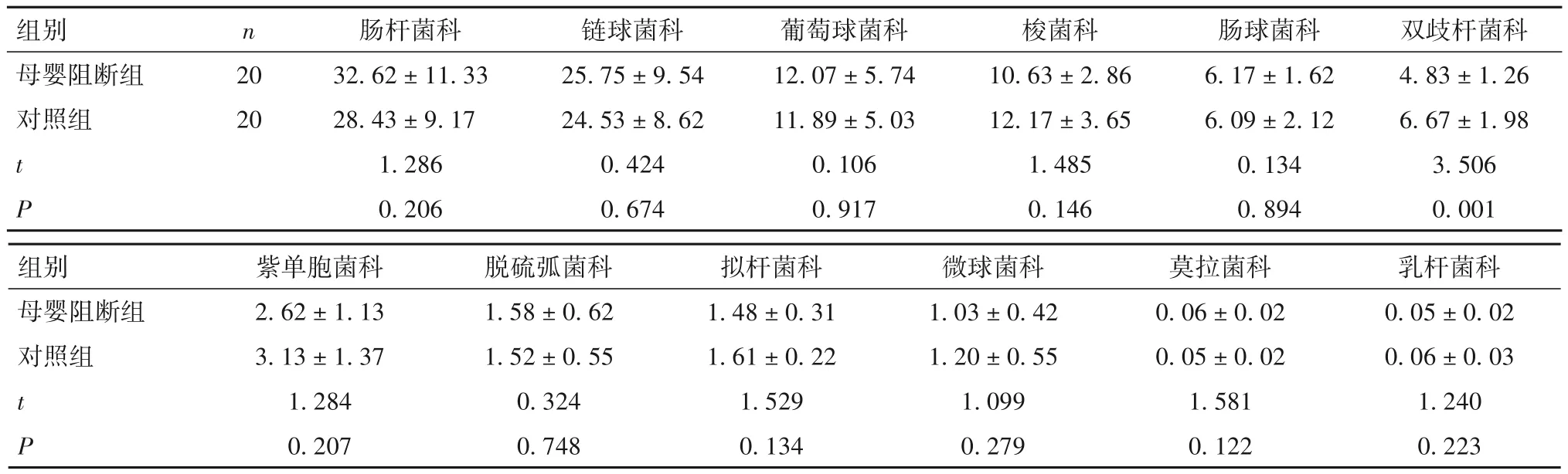
表3 两组肠道优势菌群在科水平相对丰度比较(%,)
images/BZ_37_234_2000_2246_2058.png母婴阻断组对照组20 20 t P 32.62±11.33 28.43±9.17 1.286 0.206 25.75±9.54 24.53±8.62 0.424 0.674 12.07±5.74 11.89±5.03 0.106 0.917 10.63±2.86 12.17±3.65 1.485 0.146 6.17±1.62 6.09±2.12 0.134 0.894 4.83±1.26 6.67±1.98 3.506 0.001images/BZ_37_234_2290_2246_2365.png母婴阻断组对照组t P 2.62±1.13 3.13±1.37 1.284 0.207 0.05±0.02 0.06±0.03 1.240 0.223 1.58±0.62 1.52±0.55 0.324 0.748 1.48±0.31 1.61±0.22 1.529 0.134 1.03±0.42 1.20±0.55 1.099 0.279 0.06±0.02 0.05±0.02 1.581 0.122
表4 两组肠道优势菌群在属水平相对丰度比较(%)

表4 两组肠道优势菌群在属水平相对丰度比较(%)
images/BZ_37_234_2676_2246_2734.png母婴阻断组对照组20 20 t P 28.91±12.26 30.36±13.52 0.355 0.724 25.49±10.47 23.65±11.23 0.536 0.595 14.77±5.76 12.62±4.67 1.297 0.203 8.64±3.16 7.24±2.75 1.495 0.143 8.15±2.13 10.17±3.19 2.355 0.024 4.73±1.57 6.06±2.16 2.227 0.032images/BZ_37_234_2966_2246_3041.png母婴阻断组对照组t P 3.42±1.02 3.97±1.44 1.394 0.172 1.36±0.66 1.28±0.51 0.429 0.670 1.27±0.41 1.33±0.55 0.391 0.698 1.05±0.50 1.11±0.43 0.407 0.686 0.42±0.21 0.37±0.16 0.847 0.402 0.08±0.02 0.07±0.02 1.581 0.122 0.07±0.02 0.08±0.03 1.240 0.223
3 讨论
人体的肠道菌群在围产期和婴幼儿期逐渐建立和发育,新生儿早期肠道菌群构成受到内外多种因素的影响[7]。HIV母婴阻断新生儿肠道菌群建立的过程中,主要受到以下三方面影响:①由于HIV感染母亲的肠道黏膜免疫屏障受损及通透性增加,会伴随出现母体肠道菌群失调[8]。研究发现,母体肠道菌群的DNA可以传递给胎儿,会直接影响其子代肠道菌群的建立[9]。另外,HIV感染母亲孕期多有焦虑、紧张或抑郁等心理波动,这些也会影响其子代肠道菌群的定植。②HIV母婴阻断新生儿在宫内及新生儿期均伴有ART暴露,目前常用的ART均有线粒体毒性;肠道菌群与线粒体之间存在交互效应,线粒体可通过其代谢产物对肠道菌群的定植产生影响[1]。③目前HIV母婴阻断新生儿多为选择性剖宫产出生,生后推荐人工喂养,分娩方式及喂养方式对其道菌群的正常建立也会产生影响[10]。因为以上多重因素的影响,HIV母婴阻断新生儿的肠道菌群可能有别于正常新生儿。由于肠道菌群与宿主之间存在物质及能量等方面的相互作用,可直接或者间接地影响宿主的生理及代谢功能,其中也包括对人体神经发育及功能产生影响[5]。因此,研究HIV母婴阻断新生儿早期肠道菌群的特征或可为防治HEU儿童神经发育障碍提供一些新的思路。
本研究通过比较两组新生儿肠道菌群的Alpha多样性,发现母婴阻断组Observed Species指数与Chao1指数低于对照组,提示母婴阻断组新生儿存在一定程度的肠道菌群多样性降低。胎儿期及出生后早期阶段是神经发育的关键时期,一些重要的神经连接会在此时建立;在此期间肠道菌群与人体之间相互作用,通过MGBA影响人体神经系统发育。若在这些时期发生肠道菌群紊乱,会影响MGBA的信息交流,改变大脑正常发育轨迹,导致出现行为模式、认知水平、社交行为、探索行为或学习能力等方面的不良结局。研究显示,肠道菌群减少及多样性降低幼鼠在成年后会出现认知障碍和行为异常,无菌小鼠杏仁体内多种基因转录水平显著改变,其中许多基因与大脑生理活动如神经信号传递、神经元可塑性及神经元代谢等有关;正常肠道菌群的缺失与中枢神经递质和受体的改变直接相关,菌群的改变会导致机体行为改变[11]。这提示HIV母婴阻断新生儿的肠道菌群多样性降低可引起其代谢产物或神经递质的异常,可能是其日后神经发育障碍及行为异常发生的原因之一。
本研究结果显示,两组在门水平肠道优势菌群比较,母婴阻断组拟杆菌门的相对丰度低于对照组。拟杆菌门是健康人群的优势菌门,其主要作用包括帮助宿主分解多糖、提高营养利用率、保持肠黏膜完整性、促进免疫系统发育及维持肠道微生态平衡等。拟杆菌具备较强的发酵能力,是肠道分解膳食纤维产生短链脂肪酸(SCFAs)的关键菌群[12]。SCFAs主要为丁酸、丙酸和乙酸等碳原子数为1~6个的游离脂肪酸,其既可以提供机体所需的能量及维持肠道的稳定性,也是人体的新型信号分子,肠道菌群可通过产生SCFAs参与人体诸多的生理及病理反应。研究发现,SCFAs具有神经活性,特别是丁酸、乙酸和丙酸,可以经过相应的受体来调节基因的表达,并通过MGBA影响人体神经功能[13]。研究显示,SCFAs能促进大脑小胶质细胞的发育和生长,维持细胞稳态,增强大脑免疫防御功能;无菌小鼠由于缺少SCFAs受体会引起小胶质细胞的缺陷,可导致先天性神经免疫应答受损,诱发中枢神经系统相关疾病[14]。此外,SCFAs还可通过G蛋白偶联通路起到调节中枢神经的作用,甚至可通过组蛋白去乙酰化等方式起到表观遗传修饰的作用[15]。母婴阻断组新生儿拟杆菌门丰度降低,可直接影响其短链脂肪酸的生成水平,从而影响其神经发育和功能。
两组在科及属水平肠道优势菌群比较显示,母婴阻断组双歧杆菌科、双歧杆菌属及梭菌属的相对丰度均低于对照组。双歧杆菌是母乳喂养新生儿肠道中最丰富的定植菌群,其可以消耗人乳中的复杂寡糖,为人体提供能量[16]。而HIV母婴阻断新生儿大都缺乏母乳喂养,这可能是导致其双歧杆菌丰度下降的原因之一。双歧杆菌作为人体肠道中最重要的益生菌之一,除了具有维持肠道菌群平衡、抵抗肠道病原菌定植与入侵及增强肠道上皮屏障功能外,还可以通过其代谢产物直接或间接的对神经功能产生影响。研究发现,对母婴分离小鼠补充双歧杆菌可以有效提高脑干和基底核中去甲肾上腺素水平,逆转其行为异常[17]。双歧杆菌还可利用谷氨酸钠合成γ-氨基丁酸(GABA),GABA是中枢神经系统中关键的抑制性神经递质,参与调节机体诸多神经生理活动,对维持神经系统正常功能有重要的作用[18]。梭菌属是肠道中发现的最丰富的菌属之一,是人体肠道最主要的产丁酸细菌;其产生的丁酸不仅可为肠细胞提供能量、抑制炎症因子释放及保护肠黏膜屏障,还具有调节神经免疫、影响神经细胞可塑性和影响神经发育的功能[19]。所以,母婴阻断组新生儿双歧杆菌科/属及梭菌属的相对丰度降低可能会对其近期及远期的神经发育和功能产生影响。
综上所述,与普通新生儿相比,HIV母婴阻断新生儿早期的肠道菌群多样性降低,拟杆菌门、双歧杆菌科、双歧杆菌属及梭菌属相对丰度降低,这些差异可能会导致肠道菌群产生的代谢产物或神经递质异常,并通过MGBA途径对HIV母婴阻断新生儿的大脑发育、认知水平及行为模式等神经发育过程产生不利影响。应用微生态制剂早期干预、调节肠道菌群,进而通过MGBA途径对中枢神经产生影响,有望成为改善HEU儿童神经发育预后的有效手段之一。因本研究为初步探索性研究,仍存在一定的局限性,比如对肠道菌群的检测仅选取了一个时间点,未进行多时点动态检测;对肠道菌群的检测深度仅至属分类水平等,后期计划加大纳入的样本量、增加检测的时间点及样本检测的深度,以进行更加深入的研究。
