多柔比星对心肌细胞焦亡及Caspase-3/GSDME信号通路的影响
2021-03-01张蕊蒋磊王志贤
张蕊,蒋磊,王志贤
安徽省第二人民医院,合肥230041
细胞焦亡是细胞程序性死亡的一种,是指细胞 受到某些信号因子刺激,导致细胞主动消亡的病理生理过程。既往研究认为,细胞焦亡的形成机制可分为Caspase-1介导的经典型细胞焦亡和Caspase-4/5/11介导的非经典型细胞焦亡[1-2]。近年研究显示,Caspase-3/焦孔素E(GSDME)细胞焦亡途径在恶性肿瘤中发挥重要作用。焦孔素(GSDMs)是一个具有成孔效应的蛋白家族,能影响细胞膜通透性和细胞焦亡。GSDMs可与脂质结合,在细胞膜形成小孔,诱导细胞焦亡[1]。GSDME是GSDMs家族成员之一,其分子结构由两个保守的结构域组成,即C-末端抑制结构域和N-末端效应结构域,其中N端具有细胞毒性。GSDME能够被活化的Caspase-3(Cleaved Caspase-3)剪切,形成具有细胞成孔作用的片段GSDME-N,导致细胞内容物如乳酸脱氢酶(LDH)、白细胞介素1β(IL-1β)、IL-18等释放,诱导细胞强烈的炎症反应[3]。研究表明,细胞焦亡参与了心血管疾病的发生发展。多柔比星(Dox)是一种蒽环类抗生素,广泛用于肺癌、乳腺癌等恶性肿瘤的化疗,心脏毒性是其主要不良反应[4]。目前,有关Dox导致心脏毒性的具体分子作用机制尚不完全清楚。2018年12月—2019年12月,我们观察了Dox对大鼠心肌细胞H9c2焦亡的影响,探讨其心脏毒性作用是否与Caspase-3/GSDME信号通路有关。
1 材料与方法
1.1 主要材料 H9c2细胞(美国ATCC公司),高糖DMEM培养基、胎牛血清(Gibco公司);多柔比星(Sigma公司);DAPI细胞核染料(江苏碧云天公司),Cleaved Caspase-3一抗(Cell Signaling Technology公司),GSDME-N一抗(Abcam公司),IL-1β、IL-18一抗(Proteintech公司);细胞转染试剂盒、GSDME siRNA干扰片段(广州锐博公司),CCK-8检测试剂盒、碘化丙啶检测试剂盒(江苏碧云天公司),LDH试剂盒(江苏碧云天公司),IL-1β、IL-18 ELISA试剂盒(北京中杉金桥公司)。多功能酶标仪(Thermo Fisher),高速台式冷冻离心机(湖南湘仪实验室仪器有限公司),荧光倒置显微镜(Olympus),PCR仪、Western blotting检测装置(Bio-Rad公司)。
1.2 细胞培养与分组处理 向H9c2细胞中加入高糖DMEM培养基,置于37℃、5%CO2培养箱中培养,隔天换液。加入胰蛋白酶消化、吹打混匀,种植于6孔板内;贴壁生长24 h后,倾去细胞培养基。将细胞分为空白对照组、Dox组、GSDME转染对照组和GSDME干扰组。空白对照组:加入高糖DMEM培养基培养;Dox组:加入4 μmol/L Dox培养8 h;而GSDME转染对照组:转染GSDME siRNA对照无干扰序列24 h后,加入Dox培养8 h;GSDME干扰组:转染GSDME siRNA 24 h后,加入Dox培养8 h。
1.3 细胞焦亡情况观察 采用碘化丙丁(PI)细胞染色法。收集各组细胞,加入4%多聚甲醛固定,PBS洗涤。避光条件下,加入PI染色液,室温染色15 min。倾去PI染色液,避光条件下加入DAPI染色3~5 min,PBS洗涤。荧光倒置显微镜下观察细胞染色情况并拍照,以PI阳性细胞率表示细胞焦亡情况。PI阳性细胞率越高,细胞焦亡发生率越高。
1.4 细胞中LDH、IL-1β、IL-18释放情况观察 收集各组细胞,离心收集上清液;采用比色法检测LDH释放量,ELISA法检测IL-1β、IL-18水平。上酶标仪测定吸光度值,计算LDH释放量。释放量=(处理样品吸光度值-空白对照吸光度值)/(全部释放量孔吸光度值-空白对照吸光度值)×100%。
1.5 细胞Cleaved Caspase-3、GSDME-N、IL-1β、IL-18蛋白表达检测 采用Western blotting法。将H9c2细胞离心后置于1.5 mL的EP管内,按照1∶3~1∶5加入细胞裂解液并充分震荡裂解;用高速离心机4℃下以12 000 g离心15 min,收集细胞上清液,采用BCA法检测蛋白质浓度。取40 μg蛋白上样,行蛋白质凝胶电泳;湿转转膜法将蛋白转移至PVDF膜上,脱脂牛奶封闭2 h。加入相应的一抗(1∶1 000),4 ℃孵育过夜;加入二抗(1∶5 000),孵育1 h。TPBS洗涤,加入发光聚合物(ECL);使用胶片曝光,将图片扫描后用Image J软件测定各条带灰度值,以目的蛋白条带与内参β-actin灰度值比值表示目的蛋白相对表达量。
1.6 统计学方法 采用SPSS20.0统计软件。结果以-x±s表示,多组间比较采用ANOVA分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组PI阳性细胞率比较 空白对照组、Dox组、GSDME转染对照组、GSDME干扰组PI阳性细胞率分别为10.85%±1.25%、65.50%±8.50%、62.89%±8.89%、30.21%±7.50%,Dox组、GSDME转染对照组>GSDME干扰组>空白对照组(P均<0.05),Dox组与GSDME转染对照组差异无统计学意义。
2.2 各组细胞中LDH、IL-1β、IL-18释放情况比较 细胞中LDH、IL-1β、IL-18释放量Dox组、GSDME转染对照组>GSDME干扰组>空白对照组(P均<0.05),Dox组与GSDME转染对照组差异无统计学意义。见表1。
表1 各组细胞LDH、IL-1β、IL-18释放情况比较()
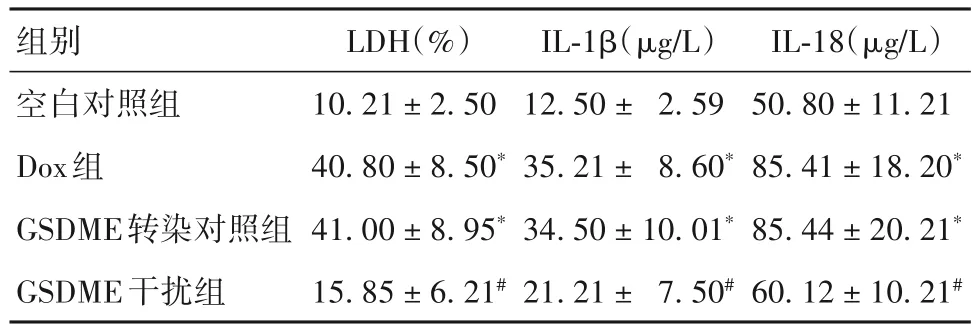
表1 各组细胞LDH、IL-1β、IL-18释放情况比较()
注:与空白对照组比较,*P<0.05;与Dox组比较,#P<0.05。
images/BZ_28_234_402_1193_465.png空白对照组Dox组GSDME转染对照组GSDME干扰组50.80±11.21 85.41±18.20*85.44±20.21*60.12±10.21#10.21±2.50 40.80±8.50*41.00±8.95*15.85±6.21#12.50± 2.59 35.21± 8.60*34.50±10.01*21.21± 7.50#
2.3 各组细胞Cleaved Caspase-3、GSDME-N、IL-1β、IL-18蛋白表达比较 与空白对照组比较,Dox组、GSDME转染对照组细胞Cleaved Caspase-3、GSDME-N、IL-1β、IL-18蛋白表达均升高(P均<0.05);与Dox组比较,GSDME干扰组GSDME-N蛋白表达降低(P<0.05),GSDME转染对照组各指标差异无统计学意义。见表2。
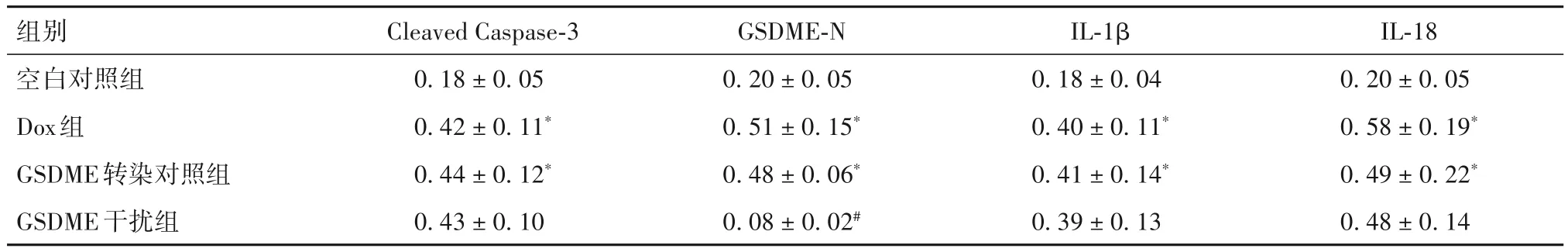
表2 各组细胞Cleaved Caspase-3、GSDME-N、IL-1β、IL-18蛋白表达比较(-x± s)
3 讨论
Dox在有效抗肿瘤过程中,常伴随严重的心脏毒性。研究发现,Dox静脉注射后可迅速分布在心、肾、肝和肺等组织,而心脏组织中药物的消除半衰期明显高于其他组织[5]。有效解决Dox长时间滞留于心脏引发的心脏毒性,可为临床合理使用Dox提供参考依据。研究发现,活性氧(ROS)过度产生是Dox造成心脏毒性的重要分子机制之一。ROS可以通过升高脂质过氧化产物,继而导致心脏毒性[6]。线粒体损伤在Dox诱导的心脏毒性中同样发挥重要作用,线粒体损伤可以导致ROS过量产生以及细胞色素C释放增多[7]。此外,Dox还可诱导一氧化氮合酶高表达,释放一氧化氮,促使心肌功能酶失活,导致心肌损伤[8]。
新近研究表明,细胞焦亡广泛参与了心血管疾病的发生发展。细胞焦亡在形成机制和死亡形态上不同于以往其他类型细胞死亡,包括凋亡和细胞坏死[9-10]。以往文献证实,细胞焦亡以细胞膜破裂为特征,PI染色剂可以通过破损细胞膜进入细胞核进而染色,而凋亡的细胞膜完整则无法通过,因此本文以细胞PI染色阳性表示细胞焦亡情况。本研究结果显示,与空白对照组比较,Dox组PI阳性细胞率升高,表明Dox造成了心肌细胞焦亡;与Dox组比较,GSDME干扰组PI阳性细胞率降低,这表明干扰GSDME能有效抑制Dox诱导的细胞焦亡。LDH是活细胞胞质内含酶之一,在正常生理状态下不能透过细胞膜;当靶细胞受损时,细胞膜通透性改变,LDH可以释放至介质中。因此,细胞上清液中LDH含量可以反映细胞膜破损情况。IL-1β和IL-18是细胞焦亡发生时诱导炎症的关键因子,其可通过细胞小孔释放至细胞外诱导炎症风暴。因此,细胞膜外IL-1β和IL-18水平可以反映细胞损伤以及炎症状况。本研究结果显示,与空白对照组比较,Dox组细胞中LDH、IL-1β、IL-18释放量均增加,表明Dox造成了细胞膜损伤,导致IL-1β、IL-18释放,从而诱发细胞焦亡;与Dox组比较,GSDME干扰组细胞中LDH、IL-1β、IL-18释放量降低,表明干扰GSDME能够有效抑制Dox造成的细胞损伤以及炎症反应。
在肿瘤细胞焦亡中,Caspase-3/GSDME依赖性细胞焦亡途径发挥重要作用。Caspase-3是与细胞凋亡相关的关键蛋白,Cleaved Capase-3能够诱导细胞凋亡,导致细胞功能紊乱[11]。GSDME是非经典细胞焦亡的关键蛋白,细胞高表达GSDME时,Cleaved Caspase-3亦可诱导 GSDME 依赖的细胞焦亡[12]。ZHANG等[13]报道,在肺癌A549细胞中,紫杉醇和顺铂能激活Caspase-3形成Cleaved Caspase-3,进而激活GSDME-N并诱导细胞焦亡。在胃癌细胞中,Dox能通过激活Caspase-3/GSDME途径诱导肿瘤细胞焦亡[14]。在乳鼠心肌细胞中,Dox能通过活化Caspase-3和PARP-1,诱导心肌细胞凋亡[15]。高智明[16]研究发现,Dox能上调Cleaved Caspase-3表达,诱导大鼠心肌细胞肥大以及细胞凋亡,导致心肌损伤。本研究结果显示,与空白对照组比较,Dox组细胞Cleaved Caspase-3、GSDME-N 及 IL-1β、IL-18蛋白表达升高;与Dox组比较,GSDME干扰组GSDME、GSDME-N蛋白表达显著降低,但是Caspase-3、Cleaved Caspase-3、IL-18、IL-1β蛋白无显著变化,这表明Dox是通过GSDME依赖性途径诱导的细胞焦亡。Caspase-3介导的下游信号GSDME依赖性细胞焦亡是独立于细胞凋亡的一种新的死亡方式,通过基因干扰GSDME能够降低LDH、IL-18和IL-1β释放,证明Dox能够通过Caspase-3/GSDME途径诱导H9c2细胞焦亡。
综上所述,Dox可通过Caspase-3/GSDME途径诱导H9c2细胞焦亡,为Dox用于临床治疗肿瘤患者所引起的心脏毒性提供新的分子作用机制。后续研究中我们将通过在体动物实验进一步明确Dox诱导心肌细胞焦亡的作用机制。
