大鼠心肌延迟缺血再灌注损伤模型的建立及其心功能和心肌细胞凋亡情况观察
2021-03-01唐咏文崔同涛刘勇王敏郭涛刘津谭宁
唐咏文,崔同涛,刘勇,王敏,郭涛,刘津,谭宁
1广东省人民医院(广东省医学科学院),广州510080;2广州医科大学附属第一医院
急性心肌梗死(AMI)不仅导致心肌损伤,还可诱发慢性心力衰竭。心脏对缺血缺氧敏感,再灌注后出现心肌损伤加重,甚至诱发心功能恶化[1],即缺血再灌注损伤(IRI)。细胞发生IRI时心肌细胞凋亡增加,从而导致心功能降低[2]。当延迟再灌注或再灌注后出现慢血流、持续泵衰竭或休克时,特别是再灌注后心肌酶学持续升高时,如何有效降低再灌注损伤是治疗的关键。研究显示,AMI后24~48 h接受延迟经皮冠状动脉介入再灌注治疗的院内病死率和重度左心室功能不全发生率较常规药物组降低[3]。因此,认识延迟再灌时心肌损伤机制可为探索更优的治疗方案提供基础支持,而建立相应的动物模型是研究的前提。为了更加接近临床早期IRI过程,2016年1月—2018年6月我们在动物模型上实现较长缺血后的有效再灌注,并观察心肌细胞凋亡及心功能的变化加以验证。现报告如下。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级雄性SD大鼠105只,8~10周龄,体质量200~270 g,购自广东中医药大学实验动物中心。实验在屏障系统中完成,饲养环境温度23~29℃,相对湿度40%~50%。实验已通过广东省人民医院动物实验伦理[伦理号:GDREC2014016H(R1)],操作遵守国家卫生研究院实验动物福利实验指南。
1.1.2 主要试剂与仪器 三苯基四唑氯化物(TTC,上海Invitrogen),依文思蓝(Evens Blue,美国Sigma),TUNEL试剂盒(瑞士Roche),Bax抗体、Bcl-2抗体、激活态Caspase-3(Cleaved Caspase-3)抗体(美国CST),GAPDA抗体(美国Protein Tech.)。小动物呼吸机R407(深圳瑞沃德),动物心电图机(成都泰盟BL-420F生物机能实验系统),倒置显微镜(德国莱卡),M型动物心脏超声仪(日本Visual Sonics Vevo 2100)。
1.2 大鼠心肌缺血模型的制备 大鼠禁食过夜,10%水合氯醛腹腔注射麻醉。18 G留置针行经口腔气管插管,外套管连接呼吸机(正压通气,潮气量2.5~3.0 mL/100 g,频率70~80次/分),四肢连接心电图机导联。大鼠仰卧固定,开胸暴露心脏及左前降支(LAD)。以6-0缝线在直视下于肺动脉圆锥根部进针,左心耳下2.0~3.0 mm处出针过线,针宽2.0~3.0 mm,针深0.5~1.0 mm。轻提缝线见前壁心肌颜色变淡,为结扎有效。在结扎处心脏表面放置5.0 mm的橡皮筋,在其上打结。以前壁心肌呈苍白色、心电图Ⅱ导联ST段弓背抬高大于0.1 mV为缺血成功。
1.3 大鼠心肌延迟再灌注时间的筛选 选取心肌缺血模型大鼠42只,分别于缺血1 h(n=6)、4 h(n=10)、6 h(n=10)、12 h(n=10)、24 h(n=6)后重新开胸并打开线结,使心肌再灌注15~20 s,以前壁心肌颜色恢复、5 min内ST段回落超过50%判断为再灌注成功。
1.4 动物分组与处理 取大鼠63只,分为假手术组17只、及时再灌组23只、延迟再灌组23只。及时再灌组和延迟再灌组按照1.2方法制备心肌缺血模型,假手术组仅穿线不结扎。及时再灌组于缺血1 h、延迟再灌组于缺血4 h后,拆开缝线,打开线结,再灌注15~20 s。按1.3方法判断为再灌注成功后,逐层缝合胸腔。
1.5 大鼠心肌缺血面积测算 采用TTC/Evens Blue双染色法。及时再灌组、延迟再灌组各取6只大鼠,再灌注24 h后于升主动脉根部注射10%伊文思蓝1.5~2.0 mL。快速切除心脏,以预冷的PBS冲洗,在30 mmol/L KCl溶液中停跳后,-20℃冷冻15 min。自结扎水平将心脏横切成1 mm厚切片,加入1%TTC溶液,37℃温育10~15 min。缺血区包括红染的危险区及白色的坏死区,蓝染的正常区。相机(Canon EOS 800D,600 dpi)拍照并采用Image J软件分析危险区面积(AAR)、梗死区面积(IA)、左心室总面积(LV),分别以(IA+AAR)/LV表示缺血区、IA/AAR表示坏死区、AAR/LV表示危险区大小。
1.6 大鼠缺血危险区心肌细胞凋亡情况观察 采用改进TUNEL法[4]。三组各取3只大鼠,再灌注24 h后处死。取结扎点下2 mm处心肌横断面,石蜡包埋,切100 μm厚切片。加入40 g/L多聚甲醛固定,2 mg/mL蛋白酶K溶液通透样本;加入450 μL荧光素片段末端标记反应混合物以及50 μL TdT酶行标记反应,封片并激发,在绿色荧光滤片下观察标记的红色荧光凋亡细胞。先在低倍镜下选择缺血危险区,然后在高倍镜下选择3个视野进行荧光拍照,采用Image J软件计算细胞凋亡率[5]。
1.7 大鼠缺血危险区心肌组织中凋亡相关蛋白Bax、Bcl-2、Cleaved Caspase-3检测 三组各取6只大鼠,再灌注24 h后处死。取缺血危险区心肌组织1 mg剪碎,加入蛋白裂解酶裂解,离心取上清,BCA法测定总蛋白浓度。煮沸变性后,SDS-PAGE电泳;采用10%分离胶,PVDF膜转膜,5%脱脂奶粉封闭。加入一抗(稀释浓度:GAPDH为1∶5 000,Bax、Bcl-2均为1∶500,Cleaved Caspase-3为1∶1 000),孵育过夜。加入二抗(稀释浓度1∶5 000)孵育,洗膜后ECL化学发光法自动曝光并保存。用Image J软件计算蛋白灰度值,以目标蛋白与内参GAPDH的比值计算蛋白的相对表达量。
1.8 大鼠左心室形态及功能检查 三组各取8只大鼠,再灌注72 h后行M型心脏超声检查。在左心室长轴切面测量左心室收缩末直径(LVDs)、左心室舒张末直径(LVDd)、左心室短轴缩短率(FS),在四腔心切面计算左心室收缩末容积(LVDsV)、左心室舒张末容积(LVDdV);Simpson′s法计算左心室射血分数(LVEF)、每搏射血量(SS)和心输出量(CO)。
1.9 统计学方法 采用SPSS18.0统计软件。计量资料以表示,两组间比较行独立样本t检验;多组间比较行单因素方差分析,组间两两比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠心肌延迟再灌注时间的筛选结果 缺血12 h及24 h后再灌注,心肌颜色固定无恢复、心电图示心肌梗死Q波形成,提示无法成功再灌注;缺血6 h后再灌注,仅2只大鼠成功再灌注;缺血4 h后再灌注,LAD可自行开通,心肌颜色恢复,心电图ST段回落;缺血1 h后再灌注,心肌颜色恢复,ST段回落并伴有心率恢复或室性早搏等心律失常表现。故将缺血1 h后再灌注作为及时再灌注时间,缺血4 h后再灌注作为延迟再灌注时间。
2.2 及时再灌组与延迟再灌组大鼠心肌缺血情况比较 见表1。
表1 及时再灌组与延迟再灌组大鼠心肌缺血情况比较()

表1 及时再灌组与延迟再灌组大鼠心肌缺血情况比较()
注:与及时再灌组比较,*P<0.05。
images/BZ_24_1284_1519_2243_1578.png延迟再灌组及时再灌组0.29±0.05 0.35±0.14 6 6 0.58±0.26*0.35±0.11 0.54±0.03*0.42±0.12
2.3 三组大鼠缺血危险区心肌细胞凋亡率比较假手术组、及时再灌组、延迟再灌组心肌细胞凋亡率分别为2.1%±0.3%、6.4%±1.2%、10.7%±1.7%,及时再灌组、延迟再灌组心肌细胞凋亡率高于假手术组,延迟再灌组高于及时再灌组(P均<0.01)。
2.4 三组大鼠缺血危险区心肌组织Bax、Bcl-2、Cleaved Caspase-3蛋白表达比较 见表2。
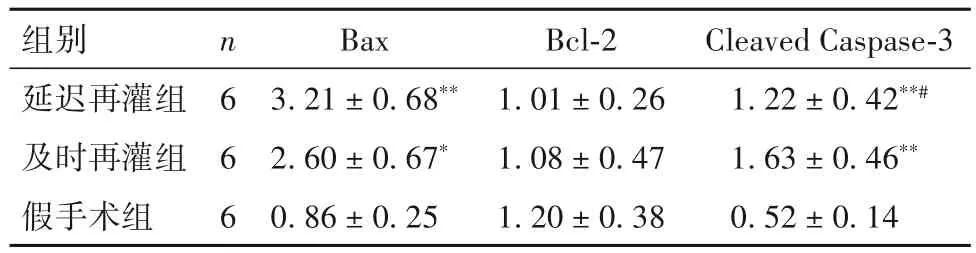
表2 三组大鼠缺血危险区心肌组织Bax、Bcl-2、Cleaved Caspase-3蛋白表达比较(-x± s)
2.5 三组大鼠左心室形态及功能比较 见表3。
表3 三组大鼠左心室形态及功能指标比较()
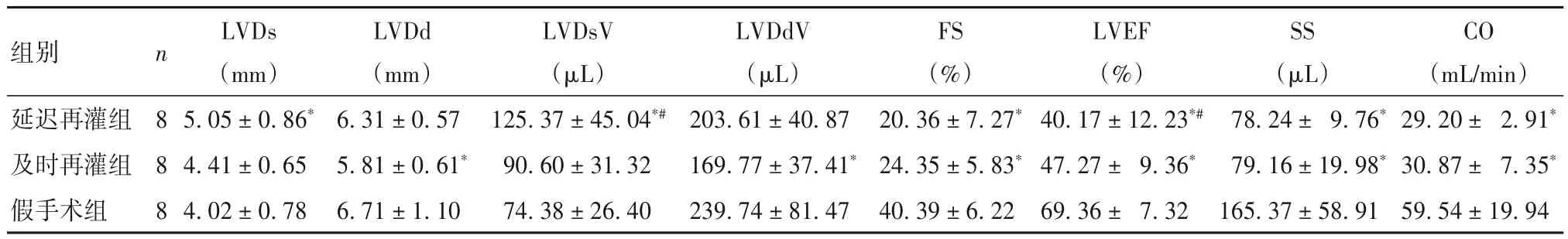
表3 三组大鼠左心室形态及功能指标比较()
注:与假手术组比较,*P<0.01;与及时再灌组比较,#P<0.01。
组别延迟再灌组及时再灌组假手术组CO(mL/min)29.20± 2.91*30.87± 7.35*59.54±19.94 n 8 8 8 LVDs(mm)5.05±0.86*4.41±0.65 4.02±0.78 LVDd(mm)6.31±0.57 5.81±0.61*6.71±1.10 LVDsV(μL)125.37±45.04*#90.60±31.32 74.38±26.40 LVDdV(μL)203.61±40.87 169.77±37.41*239.74±81.47 FS(%)20.36±7.27*24.35±5.83*40.39±6.22 LVEF(%)40.17±12.23*#47.27± 9.36*69.36± 7.32 SS(μL)78.24± 9.76*79.16±19.98*165.37±58.91
3 讨论
良好的动物模型是开展基础研究的前提和关键,本实验选取具有基因背景清楚、冠状动脉侧支少、心肌坏死出现早及重复率高等优势的SD大鼠作为心肌IRI建模动物。我们发现,心肌持续缺血4 h后自行开通率较高、重复性好,可以从组织细胞分子及心脏形态功能等层面较好地模拟心肌延迟IRI。实验采用呼吸机辅助通气下原位心脏血管结扎致心肌缺血,既避免因心脏挤压至胸腔外影响心脏泵功能及心电,又避免因多次牵拉导致造模失败。在模型制作过程中,结扎过程是关键。采用较粗的6-0无创缝线[6]作为结扎线可以减少心肌损伤;依据可视血管走行及相对解剖结构判断进出针位置,进针的深度及宽度尽量保持一致,尽量一次成功以保证实验的可重复性。结扎松紧度也影响实验的效果,过紧易导致血管断裂、心肌损伤,过松易造成不完全缺血。所以,我们选择有一定柔软度的橡皮筋作为压迫LAD 的介质,避免用缝线[7]或聚乙烯管[8]等硬压迫物对血管造成损伤的可能,且容易取出。这样不仅可以通过压痕及心肌颜色变化控制张力,还可以有效避免缝线对LAD血管的直接切割损伤,对有效再灌注起积极作用。
在延迟缺血时间的摸索中,我们曾尝试术前腹腔注射肝素50 IU/100 g抗凝以延长缺血时间;结果发现,术野渗血明显可影响观察心肌颜色变化,大鼠胸腔内积血或气管内出血明显可导致大鼠窒息死亡。与心肌酶谱、心脏超声、心肌磁共振相比,TTC/Evens Blue双染色具有经济、重复性强、对比性好的优势,是评估再灌注损伤应用最多的检测方法。本研究发现,TTC/Evens Blue双染色可较好标示缺血梗死区、危险区及正常区,延迟再灌组坏死区、缺血区均较及时再灌组增大,且两组均有明显的危险区。这提示两组具备典型的IRI组织学表现,而延迟再灌组可更好地模拟临床心肌延迟IRI。
细胞凋亡是细胞一种可调控的死亡过程,调控或干预凋亡过程是一种有效挽救心肌的方法[9]。对于处于非致死性刺激(如缺血边缘区)的心肌细胞,凋亡是一种主要的病理改变过程[10]。心肌细胞凋亡率越高则梗死后心力衰竭的概率越大,且缺血再灌注时较单纯缺血发生的细胞凋亡比例更高[11-12]。在心肌IRI中细胞凋亡起着举足轻重的作用,抑制细胞凋亡是降低IRI的治疗策略。线粒体参与调控细胞凋亡[13-14],而内源性线粒体途径在心肌IRI细胞凋亡中起主要的调控作用[15]。Caspase-3作为核心执行蛋白参与线粒体途径介导的凋亡过程,而Cleaved Caspase-3可反映其活性高低。凋亡执行蛋白中,Bax有明确的促凋亡作用,而Bcl-2有明确的抑制凋亡作用[16],两者比值可有效反映细胞凋亡的程度。本研究结果显示,及时再灌组、延迟再灌组缺血危险区心肌细胞凋亡率高于假手术组,延迟再灌组高于及时再灌组;及时再灌组和延迟再灌组Bax、Cleaved Caspase-3蛋白表达均高于假手术组,及时再灌注组Cleaved Caspase-3蛋白表达高于延迟再灌组,三组Bcl-2蛋白表达差异无统计学意义。这提示两组具备典型的IRI细胞分子学表现,而延迟再灌组可更好地模拟临床心肌延迟IRI。
心肌IRI发生后,心肌组织缺血坏死和心肌细胞凋亡最终导致心脏形态与功能的改变。本研究采用结扎心脏LAD造模,对左心室形态和功能的影响最明显。再灌注72 h,采用动物超声仪检查左心室形态及功能指标;结果显示,与假手术组比较,延迟再灌组和及时再灌组FS、SS、LVEF、CO均下降,且延迟再灌组LVDsV、LVEF均低于及时再灌组。这进一步提示延迟再灌组心肌形态及收缩功能受损更明显,可更好地模拟临床心肌延迟IRI。
综上所述,SD大鼠心肌缺血4 h后再灌注自行开通率较高、重复性好,并可引起凋亡蛋白表达异常,从而导致明显的心肌细胞凋亡及左心室收缩功能下降,表明该模型可以从组织细胞分子及心脏形态功能等层面较好地模拟临床心肌延迟IRI。
