腺苷三磷酸对人外周血单个核细胞hBD-2表达的影响及其分子机制探讨
2021-03-01张梦洁
张梦洁
上海中医药大学附属普陀医院,上海200062
人β防御素2(hBD-2)是第一个被发现的具有 可诱导表达特性的防御素[1],广泛分布于皮肤、支气管肺部、子宫等部位,尤其以支气管肺部表达最多。其具有良好的杀菌能力和抗病毒、抗真菌、抗肿瘤等多种生物学活性,能趋化多数免疫细胞,在固有免疫和特异性免疫中均有重要功能,因此在肺部炎症性疾病中发挥重要作用。在自然条件下,hBD-2表达水平极低或不表达;在受到外界因素刺激诱导后,则在各种组织黏膜细胞中表达并上调,发挥其抗微生物和调节免疫的功能[2]。腺苷三磷酸(ATP)是一种辅酶,通过多种蛋白功能为机体多种合成反应提供所需能量,增强机体组织及细胞的代谢活性,因而其对治疗各种疾病均有较强的针对性。目前,ATP已被广泛应用于细菌、病毒、球虫等引起的呼吸、消化及生殖系统疾病的临床辅助治疗。实验研究发现,ATP可以上调大鼠防御素2(mBD-2)的表达,但ATP是否可以上调hBD-2的表达水平目前鲜有文献报告。2016年9月—2017年7月,我们应用ATP体外刺激人外周血单个核细胞(PBMCs),观察其是否可诱导hBD-2表达,并探讨其可能的分子机制。
1 材料与方法
1.1 主要实验试剂 PBMCs分离液(Ficoll)及ATP干粉均购自美国Sigma公司,胎牛血清购自美国BI公司,青霉素链霉素溶液(双抗)、RPMI-1640培养液、HBSS和PBS缓冲液均购自美国HyClone公司,台盼兰购自美国Gibco公司,人白细胞介素1β(IL-1β)和hBD-2酶联免疫吸附(ELISA)测定试剂盒均购自武汉Elabscience公司。
1.2 实验方法
1.2.1 标本来源与收集 经医院伦理委员会批准,收集健康志愿者20名,男10例、女10例,年龄(35.2±10.5)岁,汉族,均已签署知情同意书。无菌抽取健康志愿者外周血9 mL于EDTA管抗凝,2 h内进行PBMCs的分离。
1.2.2 人PBMCs的分离 采用Ficoll-Hypaque密度梯度离心法。用无菌吸管各取3 mL血液于3只15 mL离心管中,并各加入3 mL等量HBSS液进行1∶1稀释,轻轻上下吹打,充分混匀;用10 mL注射器吸取摇匀的Ficoll 3 mL于15 mL离心管内,避免管壁残留分离液(Ficoll∶稀释前全血∶HBSS=1∶1∶1);将离心管倾斜45°,枪头紧贴管壁将稀释全血沿管壁缓慢加于Ficoll液面上,注意保持两者界面分层清晰。在室温(20℃)下,用水平离心机以离心半径10 cm、400 g离心30 min。离心后管内分为三层,在第一、二层交界处有一狭窄带,呈白色云雾状,以单个核细胞为主。用移液枪去除最上层,小心吸出PBMC层(1~2 mL),移至另一15 mL离心管中。加入6~8倍体积PBS洗涤2次,室温下以离心半径10 cm、400 g离心5 min,留取沉淀。用含10%胎牛血清的RPMI-1640培养液1 mL重悬细胞,并配成单个细胞悬液。将重悬了PBMCs的RPMI-1640培养液吹均匀,然后吸取少量悬液沿盖片边缘缓缓滴入,显微镜下观察并计数。用移液器吸取10 μL细胞悬液到离心管中,再加入0.4%台盼蓝10 μL染液,于显微镜下计数PBMCs,活细胞百分比达95%以上,达到实验要求。
1.2.3 PBMCs分组与ATP干预 在超净台内,用含10%胎牛血清的RPMI-1640培养基调整细胞密度为1×106/mL;将细胞悬液接种于96孔培养板,每孔100 μL;将PBMCs分为六组,每组设3个复孔。空白组不处理,0、25、50、100、200 μmol/L ATP组分别加入 HBSS液和 25、50、100、200 μmol/L ATP 100 μL,于37℃、5%CO2及相对湿度为95%的培养箱中培养。分别于培养12、24 h后终止培养,将各组培养后的细胞悬液转移至1.5 mL无菌离心管中,标记编号后以离心半径10 cm、1 500 r/min低温离心10 min,留取适量培养上清液置-80℃冰箱内保存。
1.2.4 PBMCs培养上清液hBD-2、IL-1β检测 收集培养上清液,以离心半径10 cm、3 000 r/min离心5 min,取上清液,采用双抗体夹心ELISA法检测hBD-2和IL-1β,具体步骤按试剂盒要求。即加50 μL待测样品及系列浓度的标准溶液在细胞因子单抗包被的酶标板上,室温孵育使细胞因子结合到酶标板上,再加入二抗孵育结合;最后加底物液显色30 min,用酶标仪在450 nm波长处测OD值并计算hBD-2和IL-1β含量。
1.3 统计学方法 采用SPSS22.0统计软件。所有计量数据以-x±s表示,多组间比较行单因素方差分析,组间两两比较行LSD-t检验,组内不同时间点的比较行重复测量方差分析,相关关系采用Person相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组PBMCs培养上清液中hBD-2水平比较 见表1。
2.2 各组PBMCs培养上清液中IL-1β水平比较 见表2。
2.3 ATP作用后PBMCs培养上清液中hBD-2与IL-1β水平的关系 经ATP作用12、24 h时,PBMCs培养上清液中hBD-2与IL-1β水平均呈正相关(r分别为0.494、0.725,P均<0.01)。
3 讨论
hBD-2是防御素家族中非常重要的成员,主要表达于皮肤、支气管等各种黏膜上皮细胞,外周血中的中性粒细胞和单核细胞在致炎因子刺激下也可以表达 hBD-2[3-4]。在高浓度时,hBD-2 对病原微生物具有直接杀伤作用;而低浓度时,hBD-2就只有趋化性,它可趋化募集树突状细胞、T淋巴细胞、白细胞、肥大细胞和巨噬细胞等,使这些细胞聚集在感染部位、诱导分化成熟、促进细胞因子产生;而这些细胞及细胞因子反过来又影响hBD-2的诱导表达,从而对机体的免疫状态产生影响。hBD-2也可通过激活G蛋白偶联受体和磷脂酶C途径还能与肥大细胞表面两种特异性受体结合,从而诱导肥大细胞聚集到炎症部位并活化、脱颗粒、释放组胺,参与速发型超敏反应[5]。研究显示,hBD-2是Toll样受体(TLR)的内源性配体,通过TLR2、TLR4、CC趋化因子受体6(CCR6)等受体介导,在IL-1相关蛋白激酶(IRAK)和肿瘤坏死因子受体相关因子6(TRAF6)等信号转导分子的协同作用下,触发细胞内信号级联反应,激活NF-κB,活化T淋巴细胞,触发强有力的特异性免疫应答[6]。YANG等[7]发现,hBD通过CCR6途径诱导的未成熟树突状细胞(iDC)的迁移,在hBD-2的刺激下通过CCR6促进iDC迁移,促进抗原提呈作用,激活T细胞,引发免疫应答。
表1 各组PBMCs培养上清液中hBD-2水平比较()
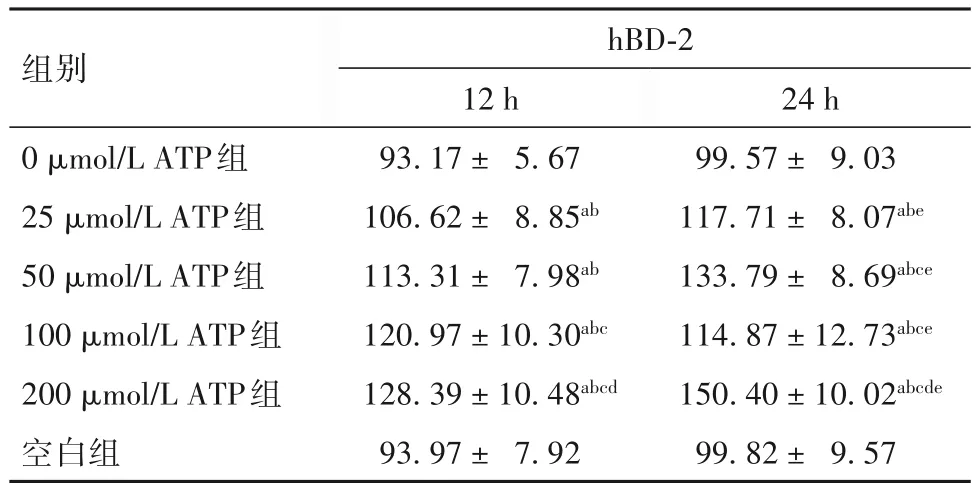
表1 各组PBMCs培养上清液中hBD-2水平比较()
注:与空白组比较,aP<0.01;与0 μmol/L ATP组比较,bP<0.01;与 25 μmol/L ATP组比较,cP<0.01;与 50 μmol/L ATP组比较,dP<0.01;与同组培养12 h比较,eP<0.01。
images/BZ_15_234_402_1193_520.png99.57± 9.03 117.71± 8.07abe 133.79± 8.69abce 114.87±12.73abce 150.40±10.02abcde 99.82± 9.57 0 μmol/L ATP组25 μmol/L ATP组50 μmol/L ATP组100 μmol/L ATP组200 μmol/L ATP组空白组93.17± 5.67 106.62± 8.85ab 113.31± 7.98ab 120.97±10.30abc 128.39±10.48abcd 93.97± 7.92
表2 各组PBMCs培养上清液中IL-1β水平比较()
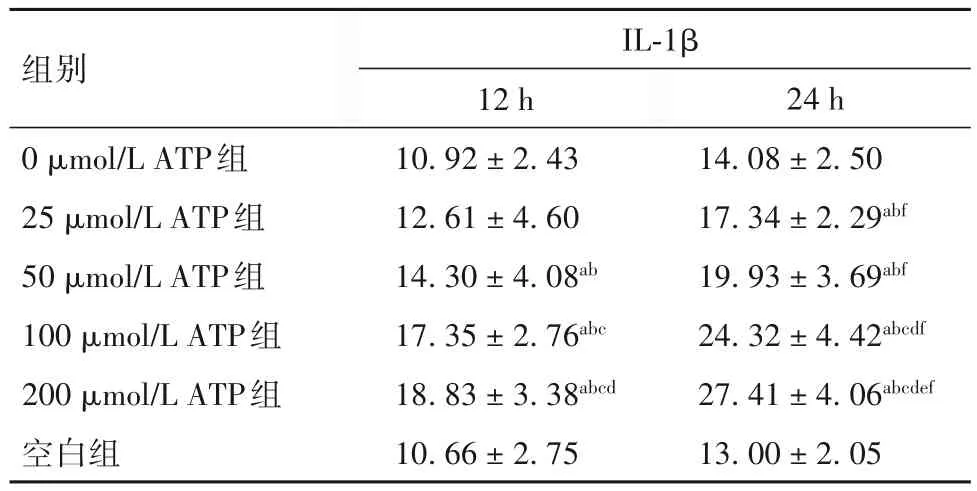
表2 各组PBMCs培养上清液中IL-1β水平比较()
注:与空白组比较,aP<0.01;与0 μmol/L ATP组比较,bP<0.01;与 25 μmol/L ATP组比较,cP<0.01;与 50 μmol/L ATP组比较,dP<0.01;与100 μmol/L ATP组比较,eP<0.01;与同组培养12 h比较,fP<0.01。
24 h 14.08±2.50 17.34±2.29abf 19.93±3.69abf 24.32±4.42abcdf 27.41±4.06abcdef 13.00±2.05组别0 μmol/L ATP组25 μmol/L ATP组50 μmol/L ATP组100 μmol/L ATP组200 μmol/L ATP组空白组IL-1β 12 h 10.92±2.43 12.61±4.60 14.30±4.08ab 17.35±2.76abc 18.83±3.38abcd 10.66±2.75
有研究发现,ATP还具有细胞间信息传递功能[8],可提高细胞内钙离子水平,促进钙离子参与调节细胞的多种生物学功能。钙非特异性调节剂ATP能通过与特殊受体(P2-嘌呤受体)结合,促进磷酸肌醇激酶的水解,从而引起钙动员、胞内钙升高,导致细胞的特殊反应;这些反应依据细胞类型不同而异,并且与细胞的功能有关[9]。hBD-2在自然条件下表达水平极低或不表达,当受到刺激诱导后则在各种组织黏膜细胞中表达并上调,发挥其抗微生物和调节免疫的功能[2]。hBD-2的可诱导表达特性,为利用某种人工方式调控其表达提供了理论依据。PBMCs为免疫活性细胞的集合体,包括T淋巴细胞、B淋巴细胞、NK细胞、单核细胞等免疫活性细胞,尤其T淋巴细胞,在机体免疫反应中扮演重要作用。hBD-2能趋化多数免疫细胞,因而在固有免疫和特异性免疫中均起着重要作用。
为探索人工促进hBD-2表达上调的方法,以进行体内研究且能应用于临床,并进一步探讨hBD-2与机体免疫状态的关系。本研究先提取人PBMCs,用培养基调节至一定浓度后接种于培养板中,分别加入不同浓度的ATP液于培养箱中培养,分别于12、24 h收集细胞培养上清液,用ELISA法检测其上清中的hBD-2及IL-1β。结果发现,与空白组和0 μmol/L ATP组比较,经不同浓度ATP组处理后,PBMCs细胞培养上清中hBD-2及IL-1β表达水平出现不同程度的上调,差异有统计学意义;且随着ATP浓度适当的增加及作用时间的延长,细胞培养上清液中hBD-2及IL-1β的表达水平可进一步升高。本研究结果进一步证明了ATP可以诱导人体内hBD-2和IL-1β表达,并可通过人体免疫细胞发挥作用,在增强机体免疫方面起极为重要的作用。本研究结果提示,经ATP处理后,PBMCs培养上清液中hBD-2与IL-1β的表达水平呈正相关,这与SUN等[10]发现大鼠肺组织中mBD-2与IL-1β表达呈正相关这一观点相符。目前的研究表明,hBD-2的诱导表达可能是通过多种信号途径实现的,核转录因子κB(NF-κB)信号通路被外来刺激信号激活可能是hBD-2基因激活的机制之一,hBD-2的表达是通过激活NF-κB、在IL-1β及TNF-α参与下实现的[11]。也有研究表明,ATP是促进巨噬细胞中IL-1β成熟与分泌的重要内源性刺激物[12-13]。结合本研究可以推测,ATP作用于PBMCs后使细胞内钙离子浓度增高,导致NF-κB信号通路激活,从而诱导细胞因子如IL-1β和hBD-2表达,使细胞内IL-1β和hBD-2的分泌增加;而hBD-2反过来趋化免疫细胞,促进产生细胞因子如IL-1β,这些细胞因子反过来又影响hBD-2的诱导表达,两者相互影响;但ATP也有可能通过直接刺激PBMCs分泌IL-1β,进而介导hBD-2的表达上调。当然,激活hBD-2基因表达还存在其他机制,如IL-6、JAK/STAT途径等。有研究认为,其他部位的上皮细胞诱导hBD-2表达的信号转导机制与气道上皮细胞可能不同[14-15]。例如 KRISANAPRAKORNKIT 等[16]发现,通过丝裂原素活化蛋白激酶通路可以实现齿龈上皮细胞hBD-2的表达,而不是NF-κB激活通路。MOON等[17]用前炎症细胞因子IL-1α刺激中耳上皮细胞表达hBD-2,发现这是通过Raf-MEK1/2-ERK依赖性信号通路发生的;但MCDERMOTT等[18]在角膜上皮细胞用IL-1β刺激hBD-2的表达时,发现此过程既有NF-κB信号通路,也有丝裂原蛋白激酶信号通路。由此可见,各种刺激因素对hBD-2的诱导表达可能是通过多种信号途径实现的。ATP刺激PBMCs诱导hBD-2表达的具体机制和途径,尚需进一步研究。ATP作为临床常用药物,每日使用剂量可达100~200 mg。本研究提示,25 μmol/L ATP即可诱导hBD-2表达上调,这与临床上ATP使用剂量相比是极其微量的,这为肺部感染患者临床上使用小剂量ATP来诱导机体hBD-2的表达并辅助抗感染提供了依据。
