有氧运动调控肝脏肾素-血管紧张素系统对大鼠非酒精性脂肪性肝病的作用与机制
2021-02-21付常喜,陆阿明,孙一
付常喜,陆阿明,孙一



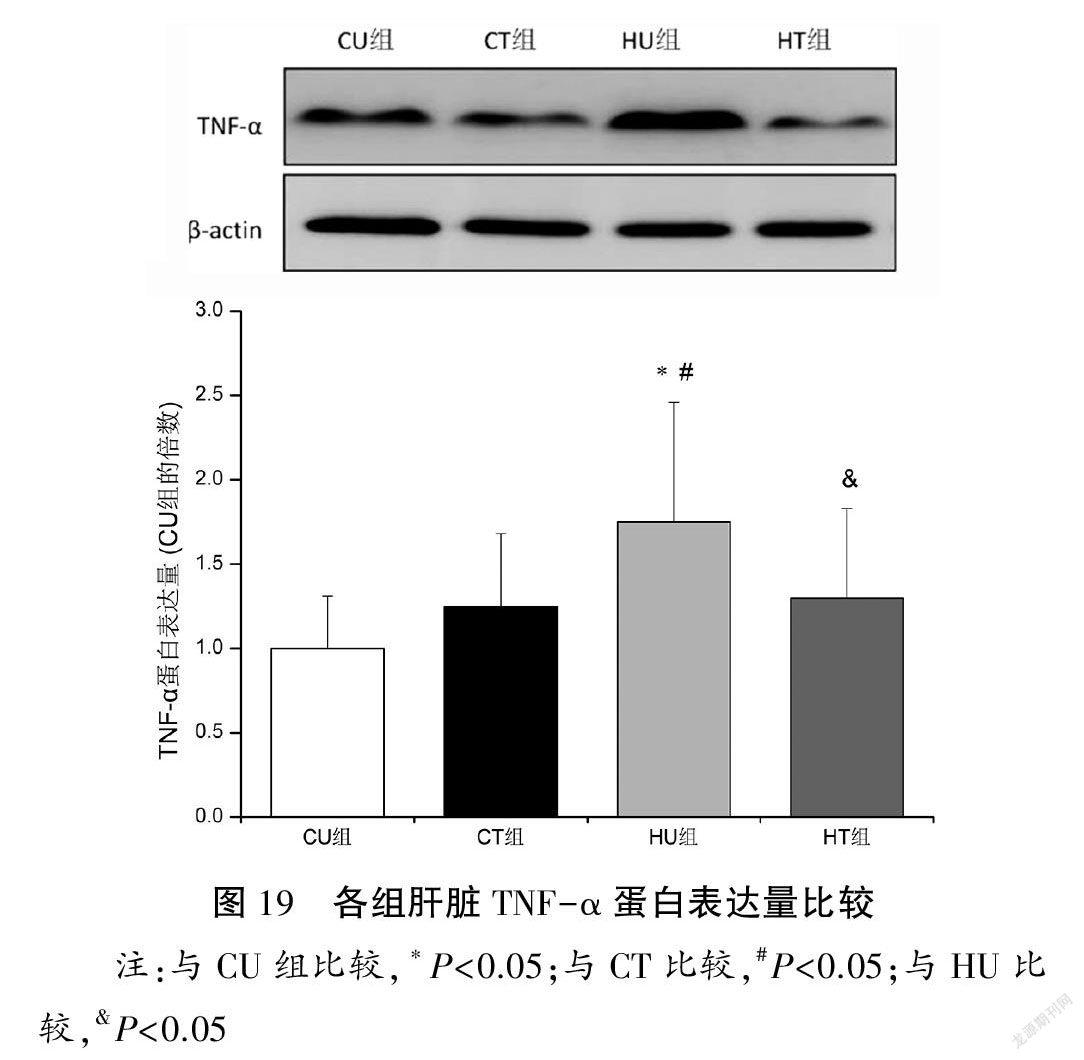
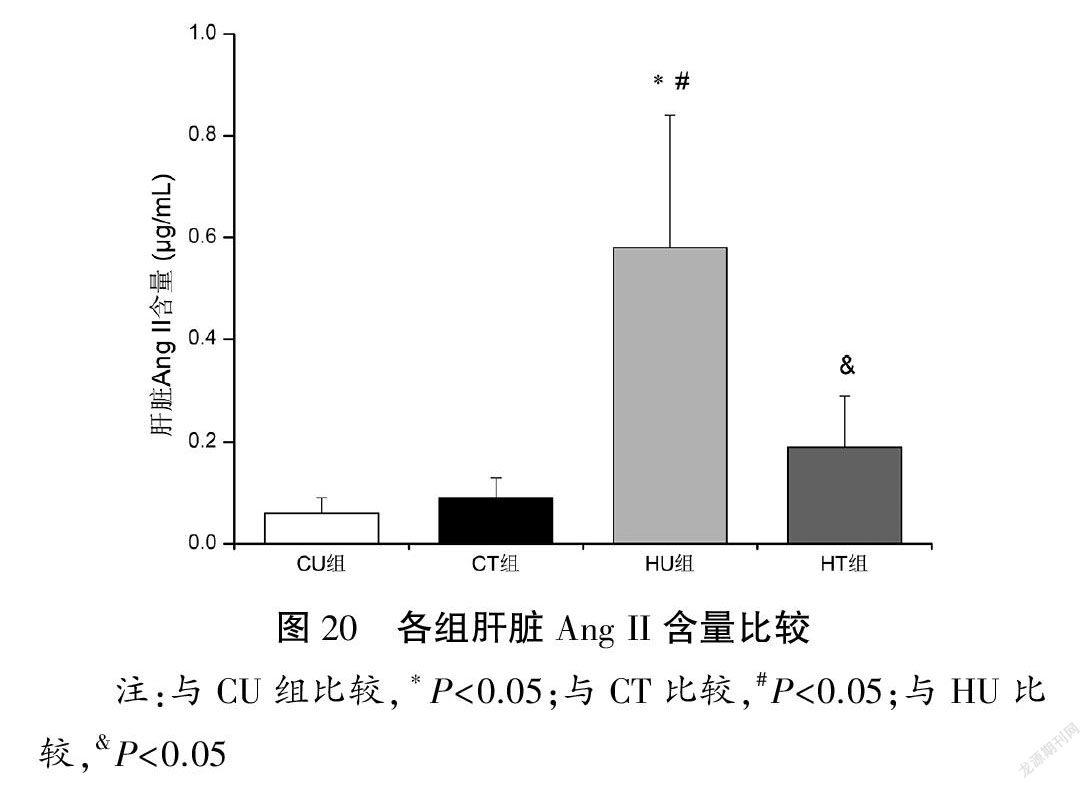
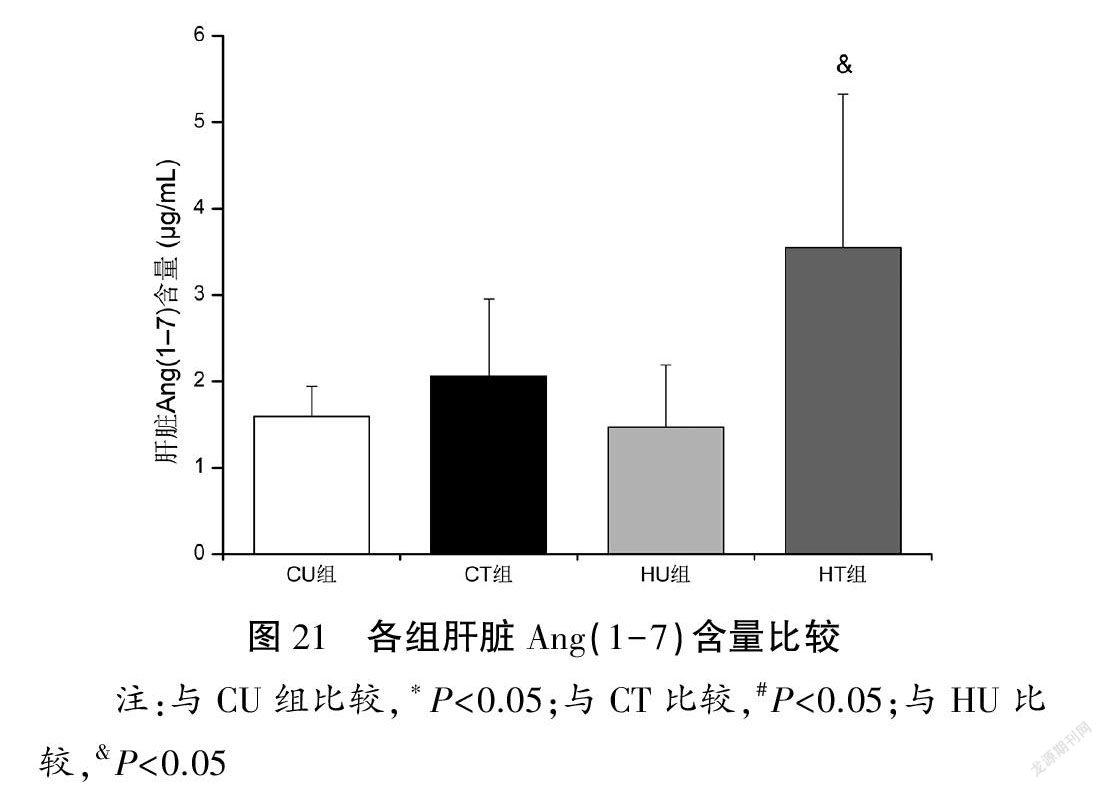

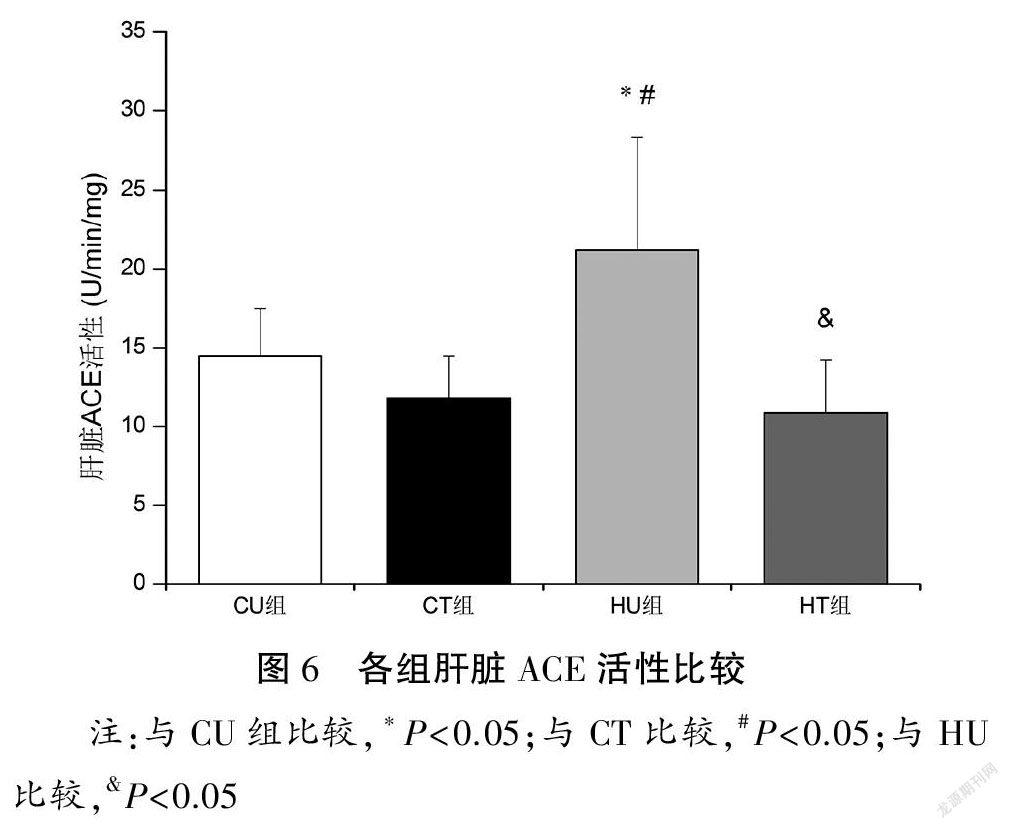













摘要:目的:通過果糖喂养建立大鼠非酒精性脂肪性肝病(NAFLD)模型,观察有氧运动对糖脂代谢、肝脏损伤和炎症反应的影响并探讨肾素-血管紧张素系统(RAS)在运动发挥肝脏保护作用中的可能机制。方法:60只雄性Wistar大鼠随机分为对照安静组(CU)、对照运动组(CT)、高负荷果糖喂养安静组(HU)和高负荷果糖喂养运动组(HT)。HU和HT组大鼠给予100 g/L果糖溶液喂养,2周后,CT和HT组动物进行8周中等强度跑台运动训练(60 min/d,4 d/w)。末次训练后72 h取材(血清和肝脏),利用胰岛素耐量试验测定胰岛素敏感性指数(ISI),酶联免疫吸附法测定血清胰岛素含量,比色酶法测定血清和肝脏甘油三酯(TAG)以及肝糖原含量,HE染色进行肝脏组织病理学观察,采用荧光底物法测定血清、肝脏血管紧张素转换酶(ACE)和ACE2活性,高效液相色谱法检测血管紧张素II(Ang II)和Ang(1-7)含量,蛋白印迹法检测肝脏ACE、Ang II 1型受体(AT1R)、ACE2、Mas受体、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)蛋白表达量。结果:(1)肝脏形态、代谢与损伤:与CU组比较,HU组大鼠表现出肝脏肿大和中度脂肪变性,肝脏脂肪变性指数明显升高(P<0.05),肝糖原和肝脏TAG含量增加(P<0.05),血清胰岛素和TAG浓度升高(P<0.05),炎症因子IL-6和TNF-α蛋白表达量上调(P<0.05);与HU组比较,HT组肝细胞脂肪滴减少,肝脏脂肪变性指数显著下降(P<0.05),肝糖原和肝脏TAG含量降低(P<0.05),血清胰岛素和TAG浓度降低(P<0.05),TNF-α蛋白表达量下调(P<0.05)。各组血糖浓度以及ISI比较均无显著性差异(P>0.05)。(2)肝脏RAS:与CU组比较,HU组肝脏ACE活性和蛋白表达量以及Ang II含量升高(P<0.05),ACE2和Mas受体蛋白表达量下调(P<0.05),ACE/ACE2活性和蛋白表达比值、AT1R/Mas受体蛋白表达比值以及Ang II/Ang(1-7)含量比值升高(P<0.05);与HU组比较,HT组肝脏ACE活性和蛋白表达量以及Ang II含量降低(P<0.05),Ang(1-7)含量升高(P<0.05),ACE2和Mas受体蛋白表达量上调(P<0.05),ACE/ACE2活性和蛋白表达比值、AT1R/Mas蛋白表达比值以及Ang II/Ang(1-7)含量比值下降(P<0.05)。各组血清ACE、ACE2活性以及ACE/ACE2活性比值比较均无显著性差异(P>0.05)。结论:长期有氧运动通过调控肝脏RAS(即促使ACE/Ang II/AT1R轴向ACE2/Ang(1-7)/Mas受体轴转变)发挥肝脏保护作用,进而改善代谢紊乱并抑制NAFLD进展。
关键词:有氧运动;非酒精性脂肪性肝病;代谢综合征;肾素-血管紧张素系统;脂肪变性
中图分类号:G804.2文献标识码:A文章编号:1006-2076(2021)04-0075-11
Effects and mechanism of aerobic exercise on non-alcoholic fatty liver disease through regulation of hepatic renin-angiotensin system in rats
FU Changxi1, LU Aming2, SUN Yi3
1. Dept. of P.E., Xuzhou University of Technology, Xuzhou 221008, Jiangsu, China; 2. School of Physical Education, Soochow University, Suzhou 215021, Jiangsu, China; 3. College of P.E., Jilin University, Changchun 130012, Jilin, China
Abstract:Objective: To establish a rat model of non-alcoholic fatty liver disease (NAFLD) by fructose overload feeding, observe the effects of aerobic exercise on glucose and lipid metabolism, liver injury and inflammation, and explore the possible mechanism of renin-angiotensin system (RAS) in exercise induced protective effect on liver. Methods: 60 male Wistar rats were randomly divided into control untrained (CU), control trained (CT), high-fructose untrained (HU) and high-fructose trained (HT) groups. Rats in HU and HT groups were fed with 100g/L fructose solution. 2 weeks later, animals in CT and HT groups received 8 weeks of moderate intensity treadmill training (60 min/d, 4 d/w). 72 hours after the last training, the samples (serum and liver) were extracted and the parameters were measured as follows: insulin sensitivity index (ISI) by insulin tolerance test, serum insulin content was measured by enzyme linked immunosorbent assay, the contents of triglyceride (TAG) in serum and liver and hepatic glycogen by colorimetric enzyme assay, liver histopathology was observed by HE staining, angiotensin converting enzyme (ACE) and ACE2 activities in serum and liver by fluorescent substrates, the contents of angiotensin II (AngII) and Ang (1-7) by high performance liquid chromatography, the protein expression of ACE, Ang II type 1 receptor (AT1R), ACE2, Mas receptor, tumour necrosis factor-α (TNF-α) and interleukin-6 (IL-6) protein in liver by Western blotting. Results: 1) Liver morphology, metabolism and damage: compared with CU group, HU group showed hepatomegaly and moderate steatosis, hepatic steatosis index significantly increased (P<0.05), liver glycogen and liver TAG content increased (P<0.05), serum insulin and TAG concentration increased (P<0.05), inflammatory cytokines IL-6 and TNF-α protein expression upregulated (P<0.05). Compared with HU group, hepatocyte fat droplets decrease (P<0.05), hepatic steatosis index reduced (P<0.05), hepatic glycogen and liver TAG content decrease (P<0.05), serum insulin and TAG concentration reduced (P<0.05) in HT group. There was no significant difference in blood glucose concentration and ISI (P>0.05) among all groups. 2) Liver RAS: compared with CU group, ACE activity and protein expression, and Ang II content in increased (P<0.05), ACE2 and Mas receptor protein expression downregulated (P<0.05), ACE/ACE2 activity and protein expression ratio, AT1R/Mas receptor protein expression ratio, and Ang II/Ang(1-7) content ratio increased (P<0.05) in HU group. Compared with HU group, ACE activity and protein expression, and Ang II content decreased (P<0.05), Ang (1-7) content raised (P<0.05), ACE2 and Mas receptor protein expression increased (P<0.05), ACE/ACE2 activity and protein expression ratio, AT1R/Mas receptor protein expression ratio, and Ang II/Ang (1-7) content ratio decreased (P<0.05) in HT group. There was no significant difference in serum ACE, ACE2 activity and ACE/ACE2 activity ratio (P>0.05) among all groups. Conclusion: Long-term aerobic exercise plays a protective role in liver by regulating liver RAS (promoting the transformation of ACE/Ang II/AT1R axis to ACE2/Ang(1-7)/Mas receptor axis), which can improve metabolic disorder and inhibit the progression of NAFLD.
Key words:aerobic exercise; non-alcoholic fatty liver disease; metabolic syndrome; renin-angiotensin system; steatosis
代谢综合征是腹型肥胖、血压升高、血脂异常、胰岛素抵抗及其肝脏病变如非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)等一系列代謝组分异常聚集的病理状态。已证实,大量摄入膳食碳水化合物尤其是果糖,可导致代谢异常甚至引发心血管疾病。近期的实验研究发现,过量摄入含果糖的饮料或食物可用于制作啮齿类动物心脏代谢损害模型以及NAFLD模型。多项针对果糖超负荷NAFLD大鼠模型的研究表明,胰岛素抵抗作为关键调节因子通过多种代谢途径促进NAFLD的发生发展。首先,胰岛素抵抗增加甘油三酯(triacylglycerol,TAG)合成,导致肝脏脂肪过度沉积;其次,胰岛素抵抗可刺激促炎性脂肪细胞因子(adipocytokines)的产生,如肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6);第三,胰岛素抵抗发生时,胰岛素抑制糖异生关键酶——葡萄糖6-磷酸酶(glucose 6-phosphatase,G6Pase)和磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)的能力下降,进而造成肝脏葡萄糖代谢紊乱。
最近的研究发现,肾素-血管紧张素系统(renin-angiotensin system,RAS)激活与代谢综合征并发症密切相关,并且认为RAS是局部组织代谢调控的关键介质。在经典的RAS级联反应途径中,血管紧张素转换酶(angiotensin-converting enzyme,ACE)催化血管紧张素I(angiotensin I,Ang I)转变为血管紧张素II(angiotensin II,Ang II),后者与Ang II 1型受体(Ang II type 1 receptor,AT1R)结合进而发挥生物学效应。ACE/Ang II/AT1R轴(经典轴)介导多种病理生理过程,包括炎症反应、氧化应激以及胰岛素抵抗,可引发心血管、肝脏、肺脏、肾脏等多种脏器病变。近期的研究发现,RAS存在一种ACE2(ACE的同源酶)介导的反向调节机制,即ACE2将Ang I或Ang II转变为Ang(1-7),后者与Mas受体结合。ACE2/Ang(1-7)/Mas受体轴具有与经典RAS信号轴(ACE/Ang II/AT1R轴)相反的生物学作用,可对抗Ang II诱导的诸多不利影响,对各种器官组织(血管、心脏、脑、肺、肝、肾、脂肪组织和骨骼肌)具有保护作用。研究表明,RAS稳态失衡可引发肝脏疾病,而激活ACE2/Ang(1-7)/Mas受体轴则具有肝脏保护效应。
规律体力活动是治疗代谢综合征的重要非药物康复手段,其对代谢综合征各个组分均具有改善作用。长期规律运动可明显改善胰岛素抵抗、异位脂肪沉积以及炎症反应状态。此外,运动还对RAS产生积极影响,包括降低血浆Ang II浓度,下调心肌中ACE和Ang II表达量,促进骨骼肌中ACE/Ang II/AT1R轴向ACE2/Ang(1-7)/Mas受体轴转化。然而,运动对肝脏组织RAS的影响尚不清楚。因此,本研究通过果糖喂养建立大鼠NAFLD模型,观察有氧运动对糖脂代谢、肝脏损伤和炎症反应的影响并探讨RAS在运动发挥肝脏保护作用中的可能机制。
1材料和方法
1.1实验动物与分组
60只10周龄雄性Wistar大鼠由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2018-0027。大鼠在温度可控(22±2℃)、反相明暗周期12 h/12 h的房间里以标准饲料饲养(5只/笼),自由进食水。大鼠适应环境1周后先随机分为2组:对照组和果糖喂养组,每组n=30。果糖喂养组饮用果糖溶液,即将D-果糖(Sigma公司,美国)溶于水中配成浓度为100 g/L的果糖溶液,对照组整个实验期间仅饮用水。2周后,将大鼠随机分为4组:对照安静组(control untrained, CU)、对照运动组(control trained,CT)、高负荷果糖喂养安静组(high-fructose untrained,HU)和高负荷果糖喂养运动组(high-fructose trained,HT),每组n=15,其中CU和CT组正常喂养,HU和HT组继续饮用果糖溶液,CU和HU组保持安静状态,CT和HT组进行8周跑台运动训练。每周评估食物和水的摄入量,能量摄入通过进食中饲料和果糖的摄入量换算成热量,整个实验期间(2周+8周)每周测量动物的体重。本研究经徐州工程学院伦理委员会审查和批准(批准号:XZUTLL 2019-003-02)。
1.2最大跑台运动测试
所有动物进行跑台适应性训练运动(10 min/d;强度为5~15 m/min逐渐递增)1周后以及8周实验结束后接受最大跑台运动测试,方案为:初始速度为以15 m/min,每2 min递增2 m/min,直至力竭,记录最大跑速。动物力竭标准为:用毛刷驱赶(未使用电刺激)仍处于跑台后1/3处超过10次。该测试用于评定大鼠有氧运动能力(最大跑速)并据此制定训练强度。
1.3运动训练方案
大鼠饮用水或D-果糖溶液2周后开始进行跑台运动训练,运动负荷逐渐递增(强度为最大跑速的50~75,坡度为0~7),每周4天(周一、周三、周五和周日),每天60 min,共8周。末次训练72 h(避免急性运动的影响)后,先进行胰岛素耐量试验,随后麻醉动物并取材。
1.4胰岛素敏感性测定
大鼠禁食8 h后,参照Osundiji等建立的方法进行胰岛素耐量试验。腹腔注射胰岛素(0.75 U/kg,美国Sigma公司),分别于注射前、注射后15 min尾静脉取血,用血糖仪(Accu-Chek,德国罗氏公司)测定血糖浓度。用血糖在15 min内的变化率表示胰岛素敏感性指数(insulin sensitivity index,ISI),即ISI=(\t=0 min-\t=15 min)÷15。由于ISI反映葡萄糖的清除率,因此数值越大表示胰岛素敏感性越高。
1.5组织取材
用氯胺酮(80 mg/kg)和赛拉嗪(12 mg/kg)腹腔注射麻醉大鼠,心脏穿刺采血后放血处死大鼠。全血离心(3 000 rpm,15 min)分离血清,-20℃低温冰箱冻存待测血糖、血清胰岛素和TAG含量以及ACE和ACE2活性。剥离肝脏并称重,将其分为两部分,一部分固定在甲醛溶液中进行光镜观察,另一部分投入液氮快速冷冻,取出用锡纸包裹并于-80℃低温冰箱中储存用于蛋白表达分析以及肝脏TAG、糖原水平、ACE和ACE2活性、Ang II和Ang(1-7)含量测定。
1.6物质代谢参数测定
血清胰岛素含量用全自动酶标仪(BIO-RAD iMark,美国)以酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定,ELISA试剂盒购自武汉博士德生物工程有限公司;血清和肝脏TAG、肝糖原含量用自动分光光度计(HACH DR2700,美国)以比色酶法测定,试剂盒购自中国生物技术股份有限公司。
1.7肝脏组织病理学观察
取固定的肝脏样品,石蜡包埋,用苏木精和伊红(Hematoxylin and Eosin,HE)染色并制作3 μm厚切片。每张切片于光学显微镜(奥林巴斯IX71,日本)下选取15个视野,对肝脏组织标本进行病理学观察,评估肝脏脂质蓄积(脂肪变性)情况。参照Catta-Preta等的方法计算肝脏脂肪变性指数()。
1.8血清、肝脏ACE和ACE2活性测定
参照Carmona等建立的方法,采用荧光底物法测定血清、肝脏中ACE和ACE2活性。血清和肝脏ACE活性测定:将肝组织样品(60 mg)在0.1 mmol/L Tris-HCl缓冲液(pH=7.0,含50 mmol/L NaCl)匀浆,4℃、1000 g离心10 min。于37℃、0.1 mmol/L Tris-HCl缓冲液(pH=7.0,含50 mmol/L NaCl和10 mmol/L ZnCl2)中测定血清和肝脏ACE酶活性,以0.5 μmmol/L甲巯丙脯酸作为阴性样品中的抑制剂。以分子内淬灭荧光底物Abz-FRK-(Dnp)P-OH(10 μmmol/L)与样品(肝脏匀浆或血清)在37℃孵育30 min的水解速率代表ACE酶活性。蛋白含量用考马斯亮蓝法以牛血清白蛋白为标准进行测定。血清和肝脏ACE2活性:以Abz-APK-(Dnp)-OH作为荧光底物测定血清和肝组织中ACE2活性,其他方法与步骤ACE。单位分别为:U/min/mL蛋白(血清)或U/min/mg蛋白(肝脏)。
1.9蛋白印迹分析
取100 mg肝脏组织在含有蛋白酶和磷酸酶抑制剂的缓冲液中匀浆,离心(4℃、5 000 g)20 min取上清。使用考马斯亮蓝法测定蛋白浓度(蛋白质检测试剂盒购自美国Thermo公司)。取10 μg蛋白样品在垂直电泳仪上经12 SDS-PAGE分离后,转移至聚二氟乙烯膜上。用5牛血清白蛋白封闭,并在4℃依次与下列兔抗鼠一抗孵育过夜:ACE(稀释比1∶500,美国Abcam公司,货号:ab11734)、AT1R(稀释比1∶500,美国Santa Cruz公司,货号:SC579)、ACE2(稀释比1∶200,美国Abcam公司,货号:ab108252)、Mas受体(稀释比1∶500,美国Santa Cruz公司,货号:SC135063)、PEPCK(稀释比1:1000,美国Santa Cruz公司,货号:SC32879)、G6Pase(稀释比1∶1 000,美国Santa Cruz公司,货号:SC25840)、葡萄糖转运蛋白2(glucose transporter 2,GLUT-2)(稀釋比1∶1 000,美国Santa Cruz公司,货号:SC9117)、肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)(稀释比1∶500,美国Santa Cruz公司,货号:SC1350)、白细胞介素-6(interleukin-6,IL-6)(稀释比1∶500,美国Abcam公司,货号:ab1423)。TBST洗涤3次后加入二抗(辣根过氧化物酶标记的羊抗兔IgG,稀释比1∶5 000,武汉博士德生物工程有限公司,货号:AR1201)室温孵育1 h。充分洗涤后,使用ECL发光成像,X线胶片压片曝光,利用凝胶成像系统(ChemiDoc XRS,美国Bio-Rad公司)拍摄并扫描各条带灰度值。β-actin(稀释比1∶5 000,美国Santa Cruz公司,货号:SC81760)为内参蛋白,以各组与CU 组的比值作为蛋白相对表达量。
1.10血管紧张素含量测定
取25 mg肝脏样品匀浆,4℃、3 000 g离心10 min。参照Li等 建立的方法,采用高效液相色谱法(高效液相色谱仪,岛津LC-6A型,日本)检测Ang II和Ang(1-7)含量。色谱柱采用粒径5 μm的C8反相柱(150 mm×4.6 mm),流动相采用1.0 mmol/L乙腈,60 g/L甲醇,20 mmol/L氢氧化钠,30 mmol/L醋酸钠,10 mmol/L醋酸,流速1.0 mL/min。检测波长为215 nm,柱温为40℃。分别称取Ang II和Ang(1-7)标准品制备标准应用液,上述同样条件绘制标准曲线。计算各样品中Ang II和Ang(1-7)含量,单位:mg/mL。
1.11统计学分析
使用SPSS 20.0软件包对数据进行统计学处理与分析。所有数据以“均数±标准差”表示。各指标四组间比较采用双因素方差分析,多重比较使用LSD检验,同组干预前后比较采用配对t检验。P<0.05为差异具有统计学意义。
2结果
2.1样本量分析以及各组体重和能量摄入比较
实验过程中,由于意外死亡、拒跑等原因,共剔除5只动物,因此最终样本量n=55,各组分别为CU组(n=15)、CT组(n=14)、HU组(n=14)和HT组(n=12)。实验结束后,四组间体重比较无显著性差异(P>0.05),实验期间能量摄入比较无统计学意义(P>0.05)。见表1。
2.2各组有氧运动能力比较
实验前各组最大跑速基线值比较无显著性差异(P>0.05)。与实验前比较,实验后CT和HT组最大跑速升高(P<0.05),HU组最大跑速降低(P<0.05)。实验后组间比较,CT组最大跑速高于CU组(P<0.05),HU组最大跑速均低于其他三组(P<0.05),HT组最大跑速高于CU组和HU组(P<0.05)且与CT组无显著性差异(P>0.05)。见表2。
2.3各组胰岛素敏感性和物质代谢参数比较
与CU和CT组比较,HU组血清胰岛素和TAG含量升高(P<0.05);与HU组比较,HT组血清胰岛素和TAG含量降低(P<0.05)。各组血糖浓度以及胰岛素敏感性ISI比较均无显著性差异(P>0.05)。见表3。
2.4各组肝脏代谢参数与组织病理学比较
与CU和CT组比较,HU和HT组表现出肝脏肿大(肝脏重量增加)(P<0.05),此外,HU组还出现肝糖原和肝脏TAG含量增加(P<0.05)。与HU组比较,HT组肝脏重量无显著性变化(P>0.05),肝糖原和肝脏TAG含量降低(P<0.05)。见表4。
肝脏HE染色高倍镜(×400倍)观察病理组织学变化显示,正常肝脏细胞(CU和CT组)形态正常,无脂肪变性,HU组发生脂质积聚,肝细胞肿胀呈圆形,充满脂肪滴,表现为中度脂肪变性,肝脏脂肪变性指数明显升高(P<0.05)。HT组大鼠肝脏细胞形态与CT组相似,脂肪变性以轻度为主,病变细胞间存在大量正常细胞,与HU组比较,肝细胞形态明显改善,肝细胞中脂肪滴减少,肝脏脂肪变性指数显著下降(P<0.05)。HE染色肝脏组织病理学变化见图1,肝脏脂肪变性指数见图2。
2.5各组血清、肝脏ACE和ACE2活性比较
各组血清ACE、ACE2活性以及ACE/ACE2活性比值比较均无显著性差异(P>0.05)。见图3~5。
与CU和CT组比较,HU组肝脏ACE活性以及ACE/ACE2活性比值升高(P<0.05);与HU组比较,肝脏ACE活性以及ACE/ACE2活性比值下降(P<0.05)。各组肝脏ACE2活性比较均无显著性差异(P>0.05)。见图6~8。
2.6各组蛋白表达量比较
2.6.1RAS轴
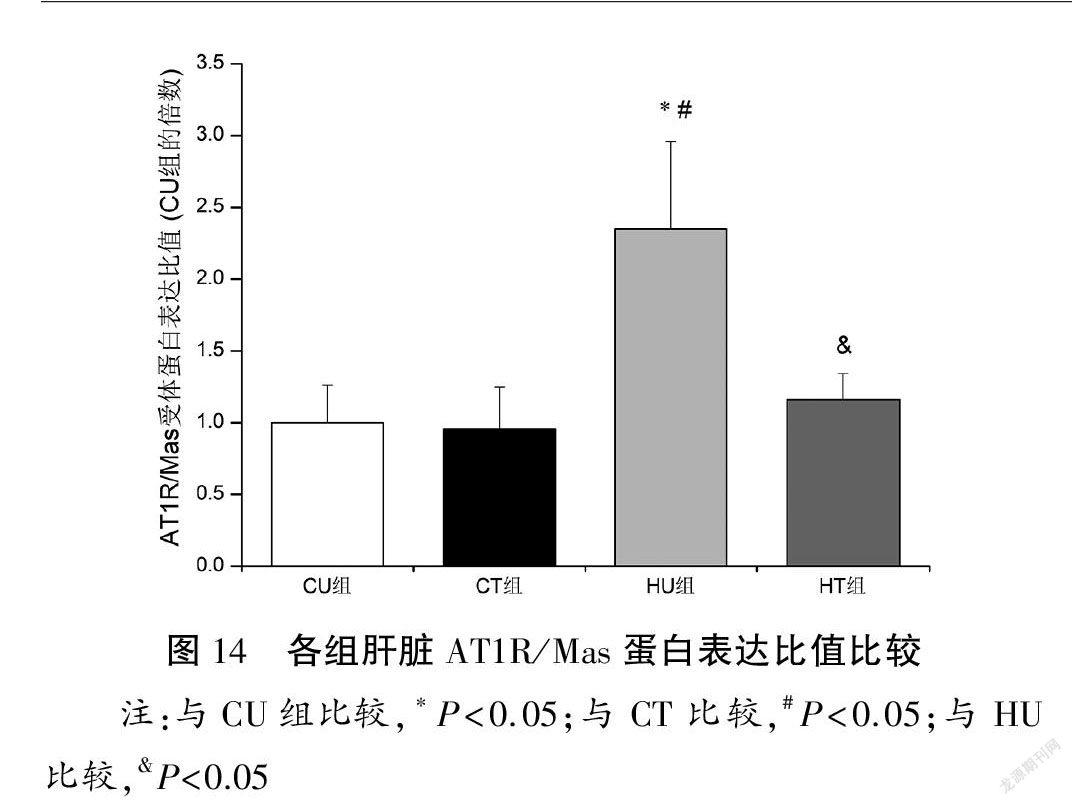
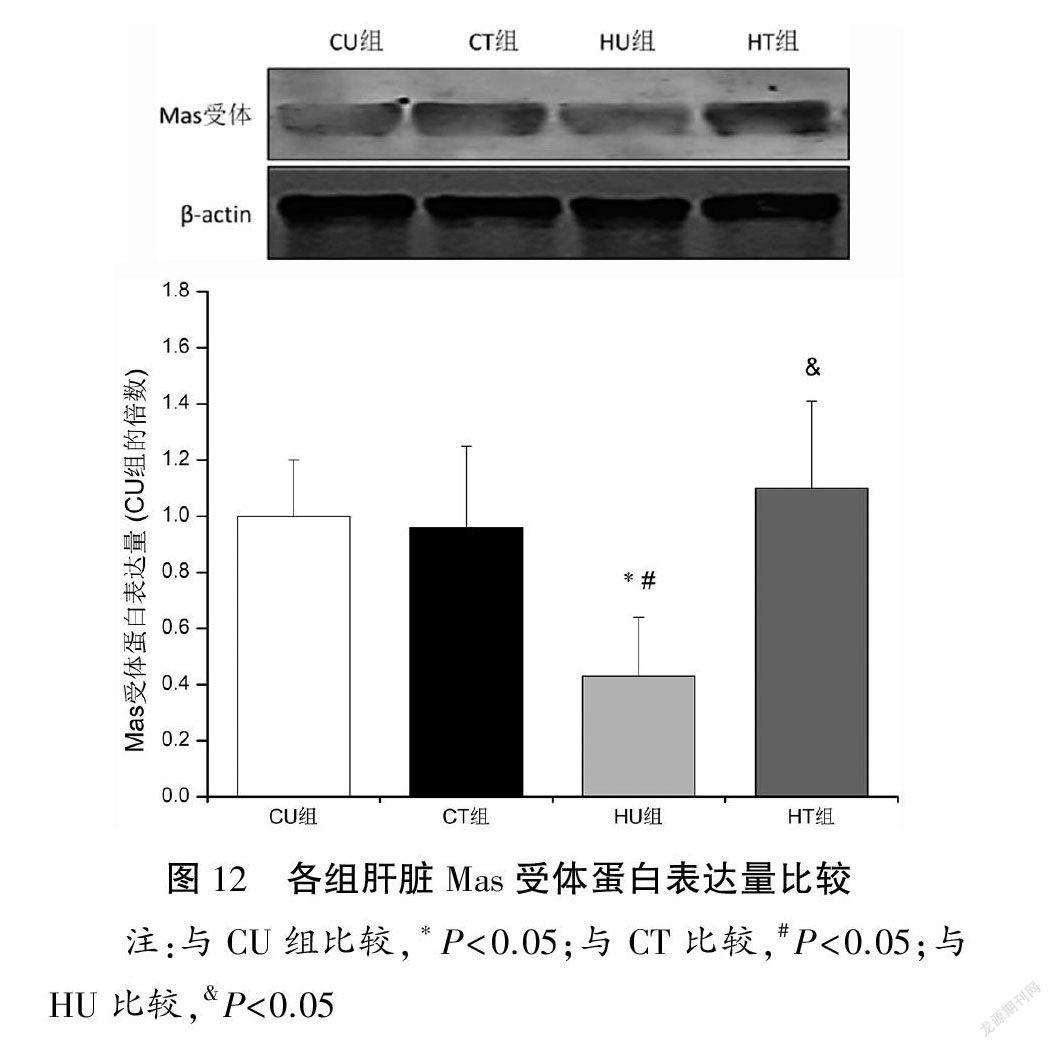
与CU和CT组比较,HU组肝脏ACE蛋白表达量上调(P<0.05),ACE2和Mas蛋白表达量下调(P<0.05),ACE/ACE2蛋白表达比值以及AT1R/Mas蛋白表达比值升高(P<0.05);与HU组比较,HT组肝脏ACE蛋白表达量下调(P<0.05),ACE2和Mas蛋白表达量上调(P<0.05),ACE/ACE2蛋白表达比值以及AT1R/Mas蛋白表达比值下降(P<0.05)。各组肝脏AT1R蛋白表达量比较均无显著性差异(P>0.05)。见图9~14。
2.6.2肝脏葡萄糖输出
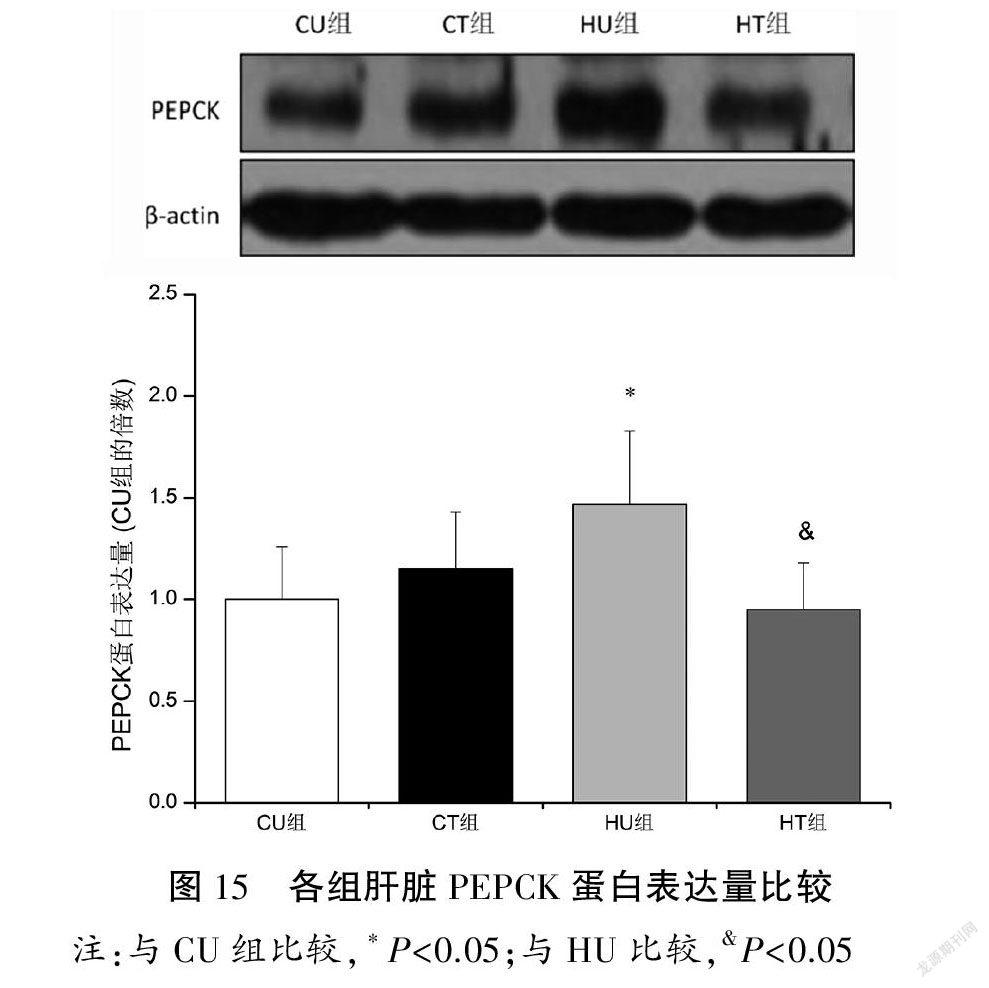
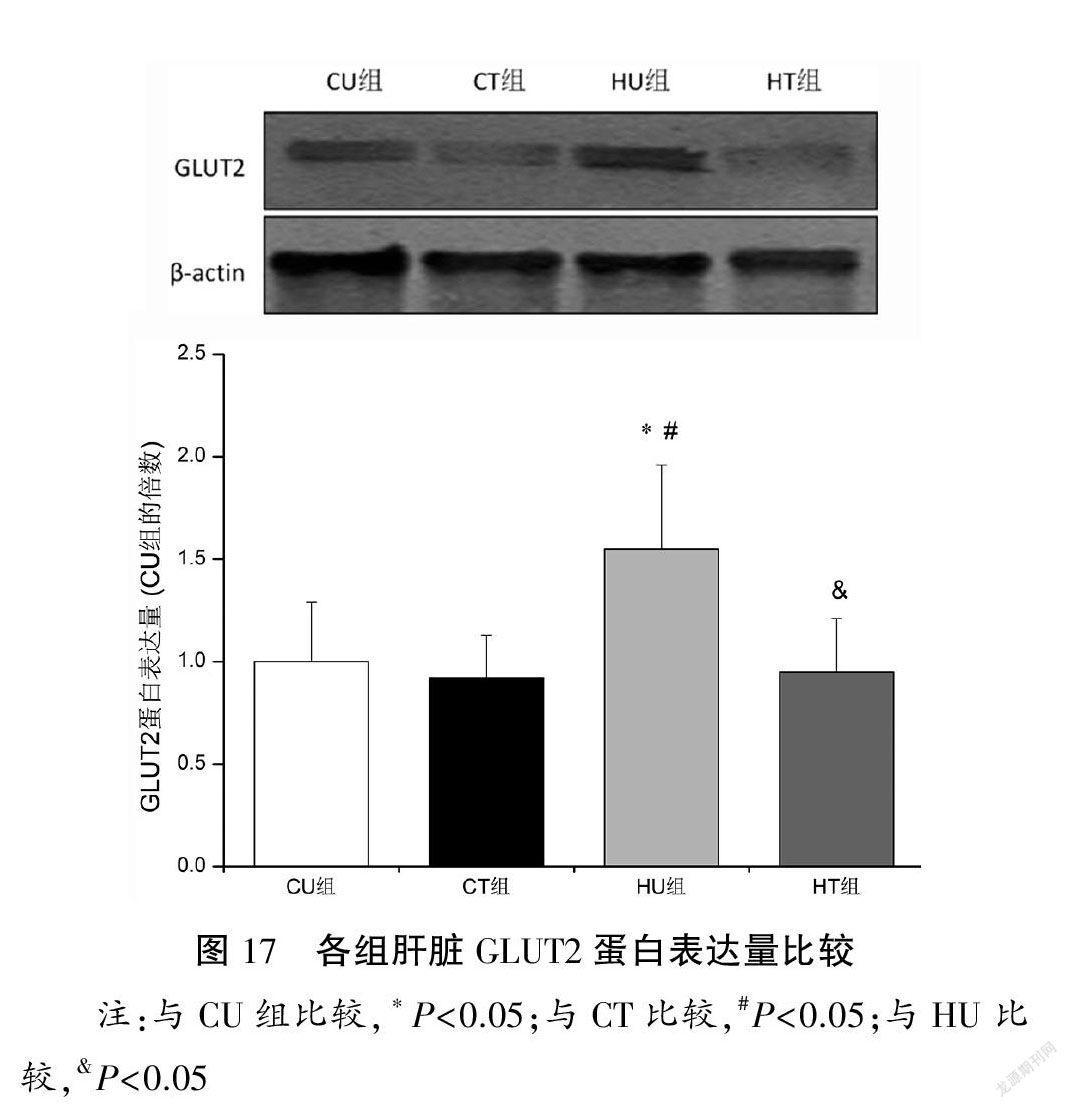
与CU组比较,HU组肝脏PEPCK和GLUT2蛋白表达量上调(P<0.05);与HU组比较,HT组肝脏PEPCK和GLUT2蛋白表达量下调(P<0.05)。各组肝脏G6pase蛋白表达量比较均无显著性差異(P>0.05)。见图15~17。
2.6.3促炎症因子
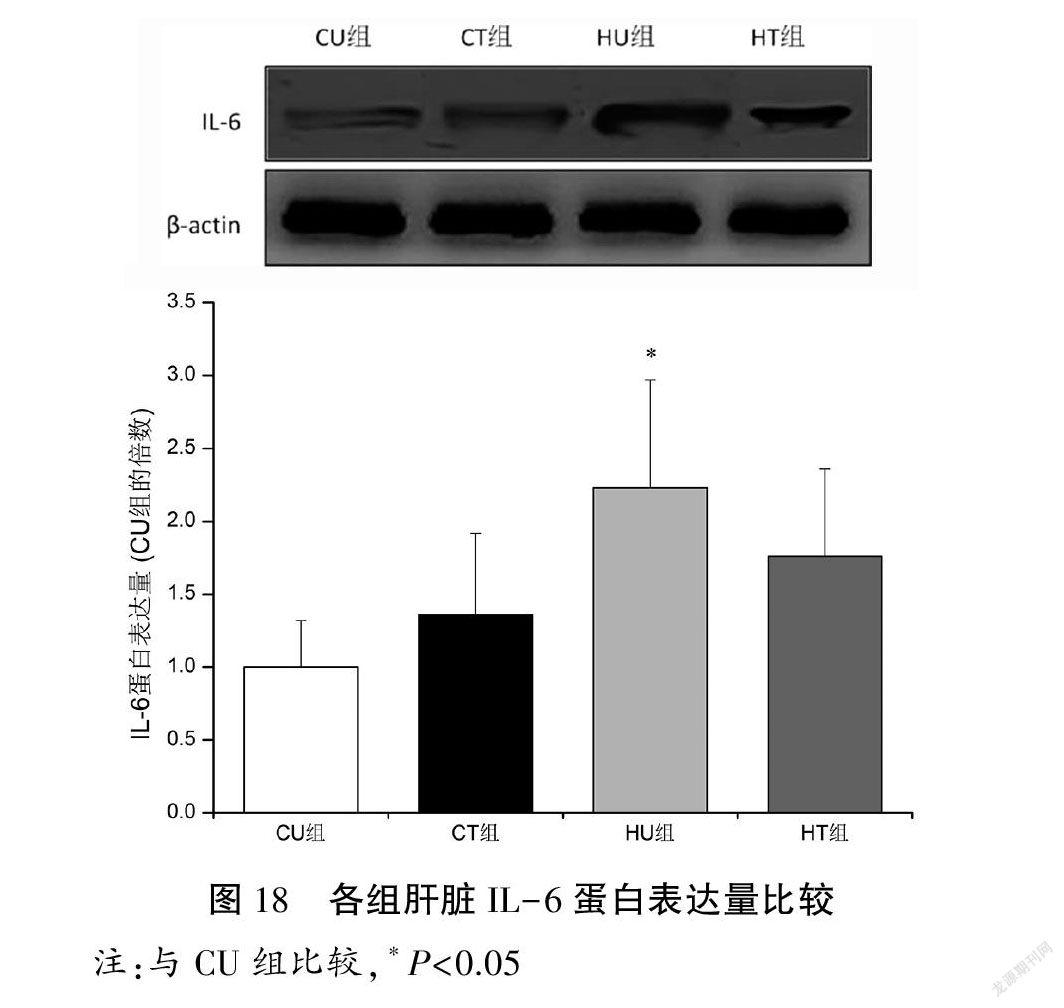
与CU组比较,HU组肝脏IL-6和TNF-α蛋白表达量上调(P<0.05);与HU组比较,HT组肝脏TNF-α蛋白表达量下调(P<0.05),IL-6表达量无显著性变化(P>0.05)。见图18~19。
2.7各组肝脏Ang II和Ang(1-7)含量比较
与CU和CT组比较,HU组肝脏Ang II含量升高(P<0.05),Ang(1-7)含量无显著性变化(P>0.05),Ang II/Ang(1-7)含量比值升高(P<0.05);与HU组比较,HT组肝脏Ang(1-7)含量升高(P<0.05),Ang II含量以及Ang II/Ang(1-7)含量比值下降(P<0.05)。见图20~22。
3讨论
本研究的主要发现是,有氧运动对果糖超负荷NAFLD大鼠模型具有以下作用:(1)使肝组织中ACE活性、蛋白表达量以及AngⅡ含量恢复正常;(2)上调肝脏ACE2蛋白表达量,继之增加肝脏Ang(1-7)和Mas受体水平;(3)降低肝脏ACE/ACE2、AngⅡ/Ang(1-7)和AT1R/Mas受体比值;(4)对全身RAS水平并无影响。虽然已有研究表明,RAS参与了代谢综合征相关肝病的形成过程,但并未检测肝脏组织中RAS各组分。因此,本研究首次证实,长期有氧运动通过调控肝脏RAS发挥肝脏保护作用,进而改善代谢紊乱并抑制NAFLD进展。
3.1有氧运动对果糖超负荷NAFLD大鼠运动能力以及肝脏形态与代谢的影响
本研究发现,与CU组比较,果糖喂养大鼠(HU组)体重并未增加,然而大鼠却表现出肝脏损伤和亚临床代谢改变,提示果糖对肝脏代谢的不良影响在一定程度上独立于体重的变化。值得注意的是,与CU组比较,HU组大鼠最大跑速下降,经过8周跑台运动后,HT组最大跑速较HU组增加,提示有氧运动改善果糖喂养大鼠的有氧运动能力,这与Medeiros等的研究结果类似。
本研究观察到HU组葡萄糖浓度正常,但血胰岛素浓度升高,即模型组大鼠发生高胰岛素血症。由于HU组仅出现肝脏葡萄糖代谢改变,因此推测该组大鼠高胰岛素血症可能不足以引起胰岛素敏感性的显著改变以及发生胰岛素抵抗。经过跑台训练后,HT组高胰岛素血症和胰岛素敏感性均得到改善,且达到与CU和CT组动物相似的水平,提示规律有氧运动有助于预防糖尿病前期进一步发展甚至得到逆转。有氧运动可明显减轻果糖诱导的大鼠代谢综合征病情,其机制与内脏脂肪含量降低,高密度脂蛋白胆固醇增加,血浆TAG和胰岛素浓度下降,胰岛素抵抗以及胰岛素介导的信号途径改善等有关。
未经训练的果糖喂养动物(HU组)表现出肝脏肿大、中度脂肪变性以及血清和肝脏TAG含量升高,组织病理学观察显示肝脏组织结构紊乱,这与胰岛素抵抗和低度炎症反应状态有关。TAG合成途径改变,外周脂解转运脂质以及脂肪外组织脂质蓄积(脂毒性),在上述因素共同作用下导致肝脏脂肪酸过度沉积。此外,肝脏的病理变化还与脂肪酶过度活化以及和线粒体β氧化受到抑制有关,从而促进NAFLD的进展。经过运动训练后,HT组上述病理改变减轻,肝脏脂肪变性和TAG积聚得到逆转,肝实质形态基本恢复。
3.2有氧运动对果糖超负荷NAFLD大鼠肝脏RAS的影响
本研究发现,果糖超负荷上调肝脏ACE活性和蛋白表达量并增加AngⅡ含量,然而AT1R蛋白表达水平并未随之升高。先前的研究表明,肝纤维化大鼠模型ACE/Ang II/AT1R轴表达上调,并参与肝脏炎症反应和TAG积聚,进而减少脂肪酸氧化并干扰细胞内胰岛素信号转导途径。然而,跑台训练后HT组大鼠肝脏ACE和Ang II下降至正常水平,提示运动对肝脏代谢的有益效应与ACE/Ang II/AT1R轴功能恢复有关。此外,HU组大鼠ACE2/Ang(1-7)/Mas受体轴表达显著下调。Cao等的研究发现,ACE2在发生胰岛素抵抗的器官中高表达,推测ACE2一方面通过降低Ang II,另一方面通过产生Ang(1-7)发挥组织保护效应。与上述假设类似,ACE2/Ang(1-7)/Mas受体轴缺陷的FVB/N小鼠发生葡萄糖耐量减低、血脂异常、胰岛素浓度升高和胰岛素敏感性下降。ACE2/Ang(1-7)/Mas受体轴通过蛋白激酶B(protein kinase B,Akt)/磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/胰岛素受体底物(insulin receptor substrate,IRS-1)介导的胰岛素信号途径改善肝脏胰岛素抵抗,进而增加葡萄糖摄取,增强葡萄糖耐量和胰岛素敏感性,减少糖原合成并降低肝细胞应激水平。经过8周跑台运动后,HT组大鼠ACE2/Ang(1-7)/Mas受体轴水平升高并基本恢复正常,提示有氧运动通过调控肝脏ACE2/Ang(1-7)/Mas受体轴对抗果糖超负荷的不利影响并对肝脏组织起保护效应。
值得注意的是,本研究还发现,喂食果糖的大鼠肝脏ACE/ACE2比值(活性和蛋白表达量)、AngⅡ/Ang(1-7)含量比值和AT1R/Mas受体蛋白表达比值升高,提示肝脏RAS发生稳态失衡并向经典轴(ACE/Ang II/AT1R轴)方向漂移。经过8周跑台运动后,HT组上述指标得到逆转,表明有氧运动促使ACE/Ang II/AT1R轴向ACE2/Ang(1-7)/Mas受体轴转变。上述结果提示,运动能够对抗ACE/Ang II/AT1R轴的不良作用,而ACE2/Ang(1-7)/Mas受体轴上调可能是运动发挥肝脏损伤保护效应以及维持胰岛素敏感性的重要分子机制。此外,本研究并未观察到血清ACE和ACE2活性的变化,推测蛋白酶主要在表达相应受体(AT1R和Mas)的组织局部发挥其生物学效应。因此,局部组织RAS的改变独立于全身RAS,即肝脏与全身RAS的变化并无关联。
研究报道,Ang II可增加肝脏葡萄糖合成,从而可能引发胰岛素抵抗。本研究对参与糖异生和葡萄糖摄取的关键蛋白如PEPCK、G6Pase和GLUT2表达量进行了检测,结果发现,HU组PEPCK和GLUT2表达明显上调,说明糖异生代谢增强,这可能是葡萄糖稳态失衡的重要原因之一。此外,果糖的利用率明显高于葡萄糖,过多的果糖转化为肝糖原,因此本研究中HU组显示肝糖原含量显著增加,这与Buziau等的研究结果一致。上述蛋白表达量在HT组大鼠显著性下调,提示维持葡萄糖稳态是运动防治代谢性疾病的重要生物化学机制。
Bidwell等发现,运动训练通过调控RAS抑制果糖过负荷诱导的炎症反应。细胞因子TNF-α和IL-6在全身和局部炎症反应中发挥关键作用,研究证实,肥胖和NAFLD等病理生理状态下TNF-α和IL-6表达明显增加。TNF-α還具有拮抗脂联素的作用,干扰脂质代谢,并在IRS-1水平上破坏胰岛素信号转导通路。饶有兴趣的是,注射Ang II的大鼠肝脏IL-6的表达量显著增加,同时伴随单核细胞募集并发生系统炎症。据此推测,运动训练可能在病理条件时发挥下调RAS的作用,这在一定程度上有助于改善胰岛素敏感性,减轻肝脏脂肪变性以及炎症反应状态。
4结论
长期有氧运动通过调控肝脏RAS,即促使ACE/Ang II/AT1R轴向ACE2/Ang(1-7)/Mas受体轴转变而发挥肝脏保护作用,继之改善代谢紊乱并抑制NAFLD进展;然而运动的有益效应与全身RAS的变化并无关联。
参考文献:
[1]Kang SH, Cho Y, Jeong SW, et al. From nonalcoholic fatty liver disease to metabolic-associated fatty liver disease: Big wave or ripple?. Clin Mol Hepatol, 2021, 27(2):257-269.
[2]Taskinen MR, Packard CJ, Borén J. Dietary fructose and the metabolic syndrome. Nutrients, 2019, 11(9):875-886.
[3]Carbone S, Billingsley HE, Lavie CJ. The effects of dietary sugars on cardiovascular disease and cardiovascular disease-related mortality:Finding the sweet spot. Mayo Clin Proc, 2019, 94(12):2375-2377.
[4]Buziau AM, Schalkwijk CG, Stehouwer C, et al. Recent advances in the pathogenesis of hereditary fructose intolerance:implications for its treatment and the understanding of fructose-induced non-alcoholic fatty liver disease. Cell Mol Life Sci, 2020, 77(9):1709-1719.
[5]Cheng PW, Lin YT, Ho WY, et al. Fructose induced neurogenic hypertension mediated by overactivation of p38 MAPK to impair insulin signaling transduction caused central insulin resistance. Free Radic Biol Med, 2017, 112(32):298-307.
[6]Said MA, Nafeh NY, Abdallah HA. Spexin alleviates hypertension, hyperuricaemia, dyslipidemia and insulin resistance in high fructose diet induced metabolic syndrome in rats via enhancing PPAR- and AMPK and inhibiting IL-6 and TNF-α. Arch Physiol Biochem, 2021, 15(3):1-6.
[7]Sharma R, Kumari M, Prakash P, et al. Phosphoenolpyruvate carboxykinase in urine exosomes reflect impairment in renal gluconeogenesis in early insulin resistance and diabetes. Am J Physiol Renal Physiol, 2020, 318(3):F720-731.
[8]Kim M, Do GY, Kim I. Activation of the renin-angiotensin system in high fructose-induced metabolic syndrome. Korean J Physiol Pharmacol, 2020, 24(4):319-328.
[9]Santos R, Oudit GY, Verano-Braga T, et al. The renin-angiotensin system:going beyond the classical paradigms. Am J Physiol Heart Circ Physiol, 2019, 316(5):958-970.
[10]Takimoto-Ohnishi E, Murakami K. Renin-angiotensin system research:from molecules to the whole body. J Physiol Sci, 2019, 69(4):581-587.
[11]Santos R, Sampaio WO, Alzamora AC, et al. The ACE2/angiotensin-(1-7)/Mas axis of the renin-angiotensin system:Focus on angiotensin-(1-7). Physiol Rev, 2018, 98(1):505-553.
[12]Wewege MA, Thom JM, Rye KA, et al. Aerobic, resistance or combined training:A systematic review and meta-analysis of exercise to reduce cardiovascular risk in adults with metabolic syndrome. Atherosclerosis, 2018, 274(18):162-171.
[13]Machado MV, Vieira AB, da Conceio FG, et al. Exercise training dose differentially alters muscle and heart capillary density and metabolic functions in an obese rat with metabolic syndrome. Exp Physiol, 2017, 102(12):1716-1728.
[14]Azadpour N, Tartibian B, Kosar SN. Effects of aerobic exercise training on ACE and ADRB2 gene expression, plasma angiotensin II level, and flow-mediated dilation:a study on obese postmenopausal women with prehypertension. Menopause, 2017, 24(3):269-277.
[15]Peng WW, Hong L, Liu GY, et al. Prehypertension exercise training attenuates hypertension and cardiac hypertrophy accompanied by temporal changes in the levels of angiotensin II and angiotensin (1-7). Hypertens Res, 2019, 42(11):1745-1756.
[16]Frantz E, Prodel E, Braz ID, et al. Modulation of the renin-angiotensin system in white adipose tissue and skeletal muscle:focus on exercise training. Clin Sci (Lond), 2018, 132(14):1487-1507.
[17]Medeiros RF, Gaique TG, Bento-Bernardes T, et al. Aerobic training prevents oxidative profile and improves nitric oxide and vascular reactivity in rats with cardiometabolic alteration. J Appl Physiol (1985), 2016, 121(1):289-298.
[18]Osundiji MA, Lam DD, Shaw J, et al. Brain glucose sensors play a significant role in the regulation of pancreatic glucose-stimulated insulin secretion. Diabetes, 2012, 61(2):321-328.
[19]Catta-Preta M, Mendonca LS, Fraulob-Aquino J, et al. A critical analysis of three quantitative methods of assessment of hepatic steatosis in liver biopsies. Virchows Arch, 2011, 459(5):477-485.
[20]Carmona AK, Schwager SL, Juliano MA, et al. A continuous fluorescence resonance energy transfer angiotensin I-converting enzyme assay. Nat Protoc, 2006, 1(4):1971-1976.
[21]Li S, Zhao W, Tao Y, et al. Fugan Wan alleviates hepatic fibrosis by inhibiting ACE/Ang II/AT-1R signaling pathway and enhancing ACE2/Ang 1-7/Mas signaling pathway in hepatic fibrosis rat models. Am J Transl Res, 2020, 12(2):592-601.
[22]Luvuno M, Khathi A, Mabandla MV. Diet-induced prediabetes:effects of exercise treatment on risk factors for cardiovascular complications. Nutr Metab (Lond), 2021, 18(1):45-55.
[23]Staniic' J, Koric'anac G, C'ulafic' T, et al. Low intensity exercise prevents disturbances in rat cardiac insulin signaling and endothelial nitric oxide synthase induced by high fructose diet. Mol Cell Endocrinol, 2016, 420(16):97-104.
[24]Fouret G, Gaillet S, Lecomte J, et al. 20-Week follow-up of hepatic steatosis installation and liver mitochondrial structure and activity and their interrelation in rats fed a high-fat-high-fructose diet. Br J Nutr, 2018, 119(4):368-380.
[25]Frantz ED, Penna-de-Carvalho A, Batista Tde M, et al. Comparative effects of the renin-angiotensin system blockers on nonalcoholic fatty liver disease and insulin resistance in C57BL/6 mice. Metab Syndr Relat Disord, 2014, 12(4):191-201.
[26]Shim KY, Eom YW, Kim MY, et al. Role of the renin-angiotensin system in hepatic fibrosis and portal hypertension. Korean J Intern Med, 2018, 33(3):453-461.
[27]Cao X, Yang FY, Xin Z, et al. The ACE2/Ang-(1-7)/Mas axis can inhibit hepatic insulin resistance. Mol Cell Endocrinol, 2014, 393(1-2):30-38.
[28]Santos SH, Fernandes LR, Mario EG, et al. Mas deficiency in FVB/N mice produces marked changes in lipid and glycemic metabolism. Diabetes, 2008, 57(2):340-347.
[29]Souza-Mello V. Hepatic structural enhancement and insulin resistance amelioration due to AT1 receptor blockade. World J Hepatol, 2017, 9(2):74-79.
[30]Schultz A, Neil D, Aguila MB, et al. Hepatic adverse effects of fructose consumption independent of overweight/obesity. Int J Mol Sci, 2013, 14(11):21873-21886.
[31]Von Ah Morano AE, Dorneles GP, Peres A, et al. The role of glucose homeostasis on immune function in response to exercise:The impact of low or higher energetic conditions. J Cell Physiol, 2020, 235(4):3169-3188.
[32]Bidwell AJ, Fairchild TJ, Redmond J, et al. Physical activity offsets the negative effects of a high-fructose diet. Med Sci Sports Exerc, 2014, 46(11):2091-2098.
[33]Beier JI, Banales JM. Pyroptosis:An inflammatory link between NAFLD and NASH with potential therapeutic implications. J Hepatol, 2018, 68(4):643-645.
[34]Alipourfard I, Datukishvili N, Mikeladze D. TNF-α downregulation modifies insulin receptor substrate 1 (IRS-1) in metabolic signaling of diabetic insulin-resistant hepatocytes. Mediators Inflamm, 2019, 35(14):356-368.
[35]Moreno M, Ramalho LN, Sancho-Bru P, et al. Atorvastatin attenuates angiotensin II-induced inflammatory actions in the liver. Am J Physiol Gastrointest Liver Physiol, 2009, 296(2):G147-156.
