趋化因子CX3CL1对小鼠小胶质细胞铁吸收的影响*
2021-01-27吴小梅贾汝汝
吴小梅,贾汝汝,张 蕊,陈 蕾,朱 俐
(南通大学特种医学研究院,江苏226019)
帕金森病(Parkinson’s disease,PD)病因非常复杂,发生机制至今尚不完全清楚。研究发现,PD患者脑黑质内铁积聚异常明显,铁含量与PD病情的严重程度正相关[1];铁摄入增多与PD发病危险性增加正相关,食用富铁食物人群罹患PD的危险性增加1.7倍[2]。PD患者黑质铁异常积聚除了与摄入过多有关,也可能与铁清除障碍相关。研究表明,PD发生与中枢神经系统炎症有关,小胶质细胞活化参与其中[3]。CX3CL1/CX3CR1在调控细胞趋化和粘附过程中发挥重要作用。CX3CL1主要由神经元产生,与受体CX3CR1结合后通过稳定小胶质细胞的状态,从而抑制中枢神经系统炎症反应,对神经元产生一定的保护作用[4-5]。本研究观察在PD发生过程中CX3CL1对小胶质细胞铁吸收是否有影响,旨在进一步阐明PD发生机制。
1 材料与方法
1.1 细胞培养 将MES23.5和BV2细胞接种于10 cm培养皿、6孔或96孔培养板中,应用含10%胎牛血清的高糖DMEM(Life Technologies)培养,在细胞融合度达到80%时开始实验。MES23.5细胞分别用终浓度为75 μmol/L 6-羟基多巴胺(6-hydroxy dopamine,6-OHDA)、5 μg/mL 柠檬酸铁铵(ferric ammonium citrate,FAC)处理 12 h,然后继续培养 24 h,收集培养基备用。BV2细胞预先用CX3CL1或MES23.5细胞培养基处理24 h,或者预先用慢病毒感染72 h后再行处理,然后观察铁吸收的变化。
1.2 酶联免疫吸附试验 收集MES23.5细胞培养基,采用特异性ELISA试剂盒(Abcam公司)检测CX3CL1含量,操作步骤参照说明书。实验独立重复3次,检测结果表示为正常对照组含量的倍数。
1.3 铁吸收实验 对CX3CL1或MES23.5细胞培养基处理24 h的BV2细胞以及慢病毒感染72 h后再行处理的BV2细胞,用0.125 μmol/L钙黄绿素(Calcein-AM)于37°C孵育10 min,HEPES洗3遍去除多余Calcein-AM指示剂。收集等量细胞并混悬于2 mL HEPES溶液中,用荧光分光光度计(Shimadzu RF-5301PC,Kyoto,Japan) 以 488 nm 波长激发,518 nm发射波长检测,记录最初的荧光读数作为基数。然后加入终浓度为40 μmol/L硫酸亚铁胺(ferrous ammonium sulfate,FAS)(Sigma)混匀,立即开始读数,每5 min检测1次,持续30 min[6]。与对照组(0 ng/mL)相比,25~100 ng/mL 各组均有显著差异(P<0.001)。实验结果以基数荧光强度的百分率表示。
1.4 统计学处理 采用Graph pad Prism 7.0统计学软件进行数据分析。计量数据以x¯±s表示。多组间比较采用单因素方差分析,两两比较采用Student-Newman-Keuls检验。P<0.05为差异有统计学意义。
2 结 果
2.1 6-OHDA和FAC促进MES23.5细胞释放CX3CL1 分别用 6-OHDA(75 μM)和 FAC(5 μg/mL)处理MES23.5细胞12 h,然后继续培养24 h,观察其对细胞活性和趋化因子CX3CL1释放的影响。MTT法检测结果显示,与正常组相比6-OHDA及FAC处理后细胞活性显著下降;ELISA法检测结果显示,6-OHDA及FAC处理后培养基中CX3CL1水平均明显升高(图1),提示6-OHDA和FAC可促进多巴胺能MES23.5细胞释放CX3CL1。
2.2 CX3CL1对小胶质细胞铁吸收的影响 有研究证明多巴胺能神经元释放的CX3CL1可作用于小胶质细胞,引起小胶质细胞的应激反应。我们使用Calcein-AM法观察小胶质细胞对硫酸亚铁胺(FAS)吸收的变化[6],结果显示:25、50 和 100 ng/mL CX3CL1都可使BV2细胞Calcein荧光强度下降,CX3CL1浓度越高,荧光下降越明显,与对照组比较差异均有统计学意义,提示CX3CL1可促进BV2小胶质细胞对二价铁的吸收,且呈现剂量依赖性。见图2。
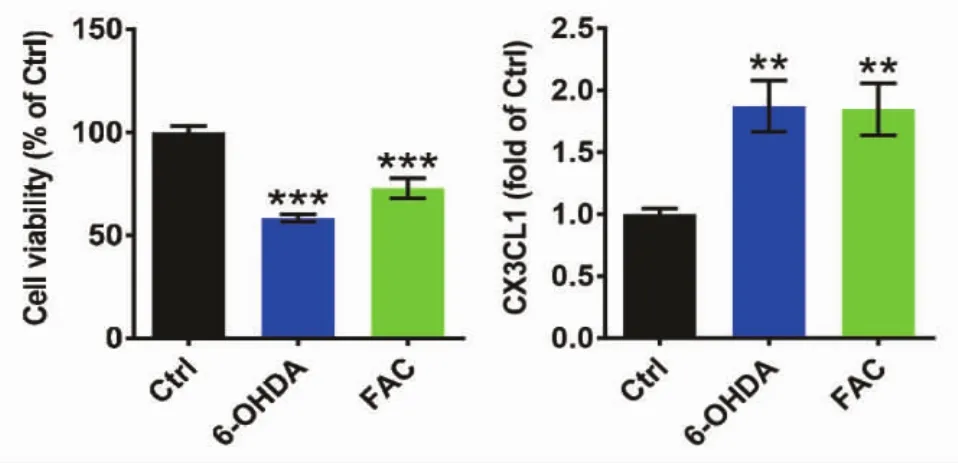
图1 6-OHDA和FAC对MES23.5细胞活性及CX3CL1释放的影响

图2 CX3CL1对BV2细胞铁吸收的影响
2.3 CX3CL1通过CX3CR1介导小胶质细胞对铁的吸收 MES23.5细胞用6-OHDA处理12 h,更换培养基继续培养24 h,收集该条件培养基。BV2细胞预先感染可表达靶向CX3CR1的shRNA干扰片段的慢病毒或阴性对照病毒72 h,再用MES23.5条件培养基处理24 h,观察处理后细胞对FAS吸收的变化。从图3可以看出,6-OHDA处理的MES23.5细胞条件培养基对FAS的吸收明显多于6-OHDA未处理MES23.5细胞非条件培养基;如BV2细胞预先感染CX3CR1-shRNA慢病毒,对FAS的吸收被明显抑制。提示6-OHDA诱导MES23.5细胞释放的CX3CL1,通过位于小胶质细胞膜上受体CX3CR1发挥作用,促使小胶质细胞对二价铁的吸收。

图3 CX3CR1对CX3CL1诱导BV2细胞铁吸收的影响
3 讨 论
本研究采用多巴胺能细胞系观察6-OHDA诱导的CX3CL1对小胶质细胞铁吸收的影响。结果发现,6-OHDA和FAC自身可诱导CX3CL1的释放,通过受体CX3CR1增加小胶质细胞对铁的吸收,提示在PD发生过程中多巴胺能神经元释放的趋化因子CX3CL1可促使小胶质细胞对铁的吸收,从而降低微环境中铁的含量。
有研究发现PD患者脑黑质部位有铁沉积,PD患者黑质新鲜标本中神经元的铁含量异常增加,而且铁含量与残余多巴胺能神经元的数目无关,说明铁的异常沉积不是多巴胺能神经元凋亡后的继发性改变,而很有可能是PD原发性病因[1-2]。6-OHDA是多巴胺神经递质羟基化类似物,可被多巴胺能神经元末梢通过轴突逆转运至黑质内,造成黑质多巴胺能神经元的损伤,是常用的PD模型化学诱导剂[7]。我们成功构建了6-OHDA诱导的PD细胞模型,发现6-OHDA可诱导多巴胺能MES23.5细胞趋化因子CX3CL1的释放。有趣的是,不但6-OHDA可诱导CX3CL1释放,铁离子(FAC)自身也可诱导CX3CL1的释放。说明在PD发生过程中分泌CX3CL1,分泌到胞外的CX3CL1可介导多巴胺能神经元与脑内其他细胞间的相互作用。
小胶质细胞可被趋化因子CX3CL1激活,从而发生炎症或其它应激反应[3-6,8]。本研究结果显示,外源加入CX3CL1,BV2细胞对FAS的吸收增加,且呈剂量依赖性,提示CX3CL1对小胶质细胞铁吸收有诱导作用。如果预先用6-OHDA处理MES23.5细胞的条件培养基孵育BV2细胞,则BV2细胞对铁的吸收也增加,提示条件培养基中的CX3CL1可能发挥了重要作用。非常有意义的是:对BV2细胞预先感染慢病毒,干扰CX3CR1的表达,则MES23.5细胞条件培养基对铁吸收的诱导作用被抑制。上述结果证明,6-OHDA可诱导多巴胺能神经细胞释放CX3CL1,其通过位于受体细胞膜上的CX3CR1增强小胶质细胞对铁的吸收,从而降低细胞微环境中铁的含量。
总之,本研究首次将多巴胺能神经元释放的CX3CL1与小胶质细胞铁吸收结合起来,即从脑内神经元和胶质细胞相互作用的角度,证明PD损伤过程中多巴胺能神经元释放的CX3CL1可作用于小胶质细胞,促进其对铁的吸收,从而调节细胞微环境,为阐明PD发生机制和寻找有效的药物靶标提供新的理论依据。
