脂蛋白(a)遗传学与心血管疾病相关性的研究进展
2021-01-10石惠薇刘硕霖热娜提肉孜吴娜琼
石惠薇 刘硕霖 热娜提·肉孜 吴娜琼
脂蛋白a[Lp(a)]是目前血脂领域的研究热点。 无论流行病学研究,还是孟德尔随机试验均证实Lp(a)升高与心血管疾病密切相关,如心肌梗死、外周动脉粥样硬化以及主动脉瓣狭窄等。 2009 年Kamstrup 等[1]利用孟德尔随机化研究证实Lp(a)水平升高是心血管疾病的病因之一,引起研究者对Lp(a)的浓厚兴趣。 Erqou 等[2]从遗传学角度揭示了Lp(a)与心血管疾病风险呈连续相关,Clarke 等[3]在2 100 个心血管疾病的候选基因中发现LPA 基因的变异是最强的心血管遗传危险因素。 因此Lp(a)在心血管疾病中的病因性作用成为了研究热点。 本综述将重点从遗传学角度来阐述Lp(a)的相关研究进展。
1.脂蛋白(a)血浆浓度与Apo(a)遗传学
Lp(a)复合物由与纤溶酶原(PLG)同源的高分子量糖蛋白Apo(a)亚型和LDL 样颗粒形成二硫键共价结合构成,是一种具有apo(a)基团的低密度脂蛋白样蛋白,而且血浆Lp(a)浓度大部分是由LPA 基因决定,这在揭示Lp(a)与心血管疾病的因果关系中起关键作用[3]。 血浆Lp(a)水平的个体差异很大,健康个体中Lp(a)浓度从<0.1 mg/dL 到>200 mg/dL 不等,跨度超过1 000 倍[4]。 人群中,Apo(a)蛋白大小存在广泛的异质性,有超过40 种不同的异构体,在个体内,80%以上的个体携带2 种不同大小的载脂蛋白(a)亚型,血浆Lp(a)水平由每个异构体中Apo(a)大小确定,而其大小是由KIV-2 拷贝数变异决定,且KIV-2 的拷贝数与血浆Lp(a)浓度成负相关[5]。 在中国人群中,目前尚无大样本的基因检测来阐述LPA 基因变异及相应的Lp(a)血浆浓度变化规律,仍有待于进一步研究。
要了解Lp(a)的遗传学,首先必须了解LPA 基因结构以及这种结构在进化过程中是如何发展的。 在灵长类动物进化过程中,LPA 基因通过从纤溶酶原(PLG)基因的复制和重塑进化而来。 PLG 包含一个蛋白酶结构域和五种类型的kringle 结构域,称为KI 到KV。 人类LPA 基因进化过程中,KI 到KIII 已经丢失,只存在KIV,KV 和蛋白酶结构域,因LPA 基因关键残基突变,LPA 中的蛋白酶结构域发生改变而失去纤溶酶活性[6]。 LPA 基因位点最具特殊性的是KIV,它通过突变扩展成10 种不同的类型(KIV 类型1-10),其中KIV-2 以多个拷贝的形式存在,拷贝数从2 ~40 个范围内不等。 每个重复序列的大小为5.6kB,很少有个体在其基因组中有两个拷贝数相同的等位基因,由此产生了高度多态性和信息丰富的拷贝数变异(CNV),导致大多数群体中杂合度超过95%[4]。 KIV-2 拷贝数变异进一步转录翻译成Apo(a)亚型,其多态性的发现验证了LPA 能够通过关联和同胞连锁研究确定为决定Lp(a)水平的主要因素,而且大约70%~90%的Lp(a)水平变异可以用LPA 位点来解释。
研究中还观察到相同大小的apo(a)异构体在浓度上差别很大,这表明LPA 基因中的KIV-2 拷贝数变异并不是Lp(a)水平变异的唯一原因,事实上LPA 基因中的rs10455872和rs3798220 单核苷酸多态性(SNPs)均与高冠心病风险相关(25%和8% structure)。 孟德尔随机研究发现最主要的SNP 是LPA rs10455872,其解释了白种人群28%的Lp(a)血浆浓度变化[7]。 目前为止,LPA KIV-2 拷贝数和LPA rs10455872 SNP 是在大型孟德尔随机研究中最好的基因工具。 尽管KIV-2 拷贝数>40 以及LPA rs10455872 非携带者均提示Lp(a)低浓度,但相对于中等或低KIV-2 拷贝数而言,rs10455872 杂合性和纯合子型者其血浆Lp(a)浓度分布显著不同。
2.脂蛋白(a)的生理功能及作用机制
Lp(a)的生理功能尚不清楚,但可以确定的是Lp(a)的生理功能恰好能解释其致病性。 Lp(a)定量携带LDL-C,具有LDL-C 的所有致动脉粥样硬化成分。 已知Apo(a)和PLG之间具有高度同源性,这提示Lp(a)或许能同时参与胆固醇运输系统和纤溶系统,并能调节血液凝固和纤溶系统的平衡。 体外实验已经证明Lp(a)确实能通过一些步骤干扰凝血/纤溶级联反应,其通过组织型PLG 激活剂(t-PA)抑制链激酶和尿激酶介导的PLG 激活,并与PLG 竞争结合细胞受体以及增强PLG 激活抑制剂PAI-1 的活性[5]。 KIV-8 和KIV-10 中的Apo(a)赖氨酸结合位点介导与纤维蛋白/纤维蛋白原的结合,这种结合使动脉粥样硬化斑块中胆固醇沉积以及斑块表面纤溶作用受到抑制,有明确证据表明,Lp(a)可以干扰许多关键的凝血/纤溶反应,并沉积在动脉粥样硬化斑块中[8]。
Lp(a)致动脉粥样硬化特性还可通过其结合运输血浆中促发炎症的氧化磷脂得到解释,一项实验观察到氧化磷脂(OxPls)与Apo(a)的KV10 通过赖氨酸结合位点共价结合[9],但这种作用只能在人体观察到。 Kamstrup 等[10]最近发现血浆中基因决定的OxPl-apoB 和OxPl-Apo(a)水平增加一倍与主动脉狭窄风险相关(OR 值分别为1.18 和1.09)。OxPl 与Lp(a)结合的能力优于LDL,且与心血管事件相关。在独立研究中,OxPL 上调炎症基因,并诱导IL-8 和单核细胞趋化蛋白-1 的释放[11]。 单核细胞趋化蛋白-1 生理环境下存在于Lp(a)上,因此可能促进Lp(a)进入血管壁。 最后,Apo(a)含有赖氨酸结合位点,使其能够与裸露的内皮表面紧密结合,进入内膜下腔或主动脉瓣小叶并积聚,从而导致炎症。因此在人体内,Lp(a)是OxPLs 的重要携带者,充当促进炎症反应的生物活性脂质的角色,也被认为是Lp(a)预测心血管疾病的生物标志物。 总之,Lp(a)的遗传特性决定了它具有致动脉粥样硬化、促炎症和抗纤溶的特征(图1)。
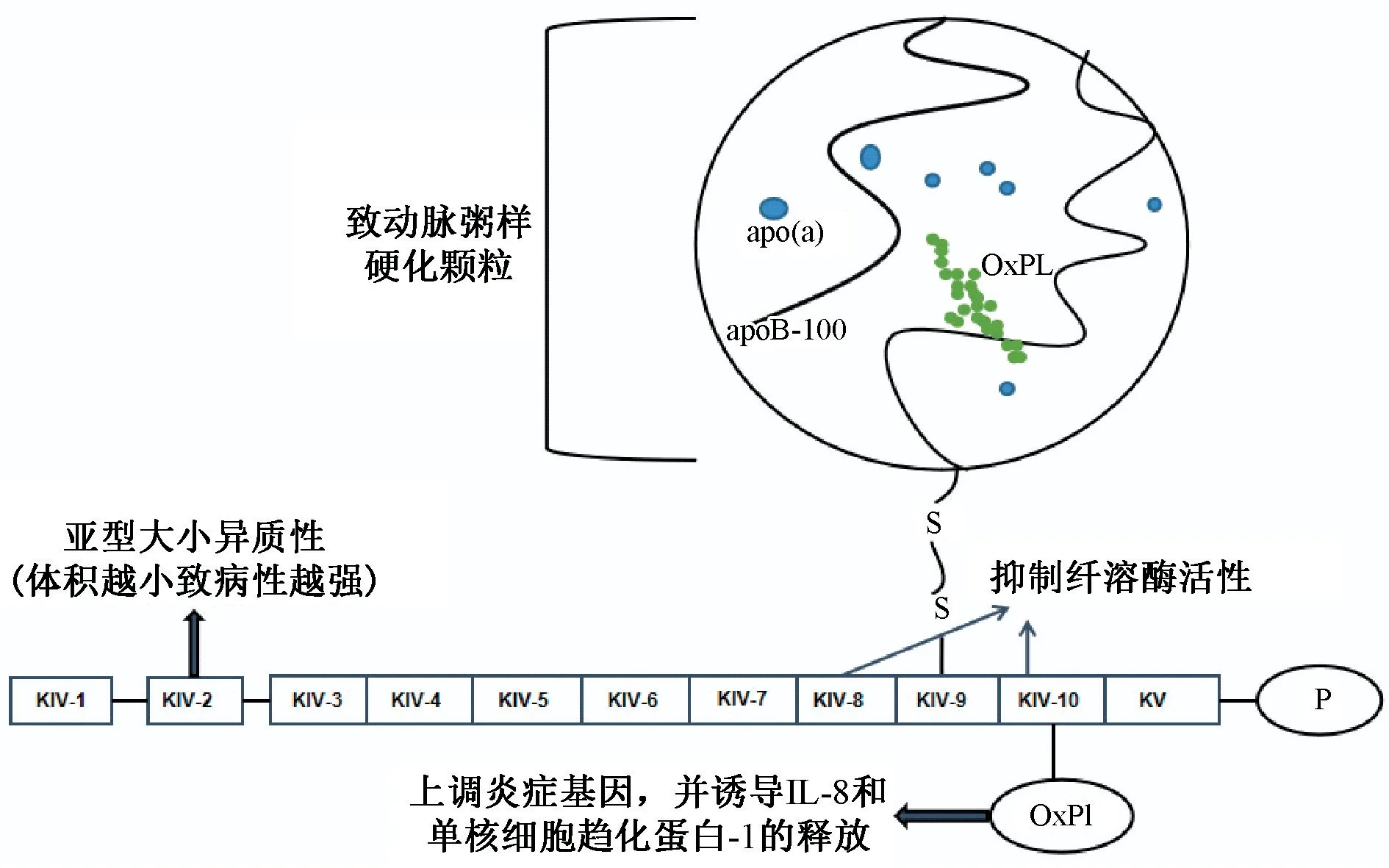
图1 Lp(a)的促动脉粥样硬化、促炎和抗纤溶作用图 Lp(a)由apoB-100 与Apo(a)共价结合而成,Apo(a)来源于Kringle IV(KIV)和KV。 Apo(a)包含10 个KIV 重复序列亚型,由1 个KIV1、多个KIV2、KIV3-10 各1 个、1 个KV 和一个非活性蛋白酶样区(P)组成。 氧化磷脂(OxPL)与Apo(a)共价结合
3.脂蛋白(a)遗传学特性与心血管疾病相关性的研究进展
随着人们对Lp(a)研究的深入,其与心血管疾病的病因学研究逐渐成为热点。 遗传学研究表明由遗传学特性决定的血浆Lp(a)水平与心血管疾病的发病风险存在相关性,包括缺血性心脏病,外周血管疾病,主动脉瓣疾病及家族性高胆固醇血症等[1,12-14]。 目前尚无Lp(a)正常范围的统一界值,2016 加拿大心血管协会血脂异常管理指南推荐Lp(a)<30 mg/dL(<45 nmol/L)为理想水平,可以忽略Lp(a)相关的CVD 与CVAD 风险[15]。 欧洲动脉粥样硬化协会提出Lp (a)<50 mg/dL 作为最佳控制目标。 但是2019 年美国国家脂质协会(NLA)建议Lp(a)测量应使用免疫化学分析方法进行,其根据世界卫生组织/国际临床化学和实验室医学联合会(WHO/IFCCLM)二级参考材料进行校准,并以nmol/L 报告[16]。 这是因为Lp(a)在人群中存在分子量不同的异构体,用mg/dL 报告Lp(a)值会有偏差。
Zekavat 等[17]在新近研究中对8 392 例来自欧洲和非洲的个体进行了全基因组测序,以发现和解释与Lp(a)相关的单核苷酸变异和拷贝数变异。 结果发现,常见的与Lp(a)胆固醇相关的rs12740374 是分拣蛋白1(SORT1)的表达数量性状(eQTL),与LDL-C 无关。 所观察到的罕见非编码变异聚集体的关联在很大程度上可以用LPA 结构变异来解释,即LPA kringle IV2 (KIV2)拷贝数。 同时发现LPA 风险基因型与直接测量的Lp(a)相比,具有更高的发生动脉粥样硬化心血管疾病的相对风险,并且与非裔美国人亚临床动脉粥样硬化的测量显著相关。
(1)心肌梗死和缺血性心脏病 Kamstrup 等[1]于2009年利用孟德尔随机化方法来评估Lp(a)与CVD 的因果关系,发现遗传学决定的Lp(a)水平升高增加MI 的风险。 KIV2拷贝数位于第一分位(6-30KIV2 拷贝数)对应的血浆Lp(a)水平是第四分位(41-99 KIV2 拷贝数)的两倍,其引起MI 的HR 值为1.22(95%CI:1.09 ~1.37)。 同年,Clarke 等[3]确定了两个LPA SNPs(rs10455872 与rs3798220),均与Lp(a)水平升高和CHD 风险增加密切相关。 携带rs10455872 患者发生CHD 的OR 值为1.70(95%CI: 1.49 ~1.95);而携带rs3798220 者 发 生CHD 的OR 值 为1.92(95%CI: 1.48 ~1.49)[3]。 由于遗传学研究通常免于回归稀释偏差,混淆或反向因果关系[18],因而上述研究加强了该论证,即Lp(a)水平可能与CHD 有因果联系(图2)。 Lp(a)浓度的翻倍使得应用LPA KIV-2 拷贝数进行MI 风险评估的HR 值增加15%(95%CI:11%~20%);同时使得应用LPA rs10455872 SNP 进行MI 风险评估的HR 值增加10%(6%~13%)。 Enas等[19]在最新发表的INTER-HEART 研究中纳入来自52 个国家非致死性AMI 共15 152 例,应用Lp(a)来评估南亚不同种族人群发生AMI 的风险。 结果发现研究结果存在显著种族差异。 中国人的Lp(a)水平最低,非洲人的Lp(a)水平最高。 南亚人是第二高。 而且,高Lp(a) (>50 mg/dL)者AMI的风险增加了48%。 但是高Lp(a)没有增加非洲人和阿拉伯人患AMI 的风险,这两类人都是最小的群体。 当排除非洲和阿拉伯人两组后对数据重新分析时,其余高Lp(a)者AMI风险增加到58%。 由此可见Lp(a)在增加AMI 风险方面存在显著的种族差异。
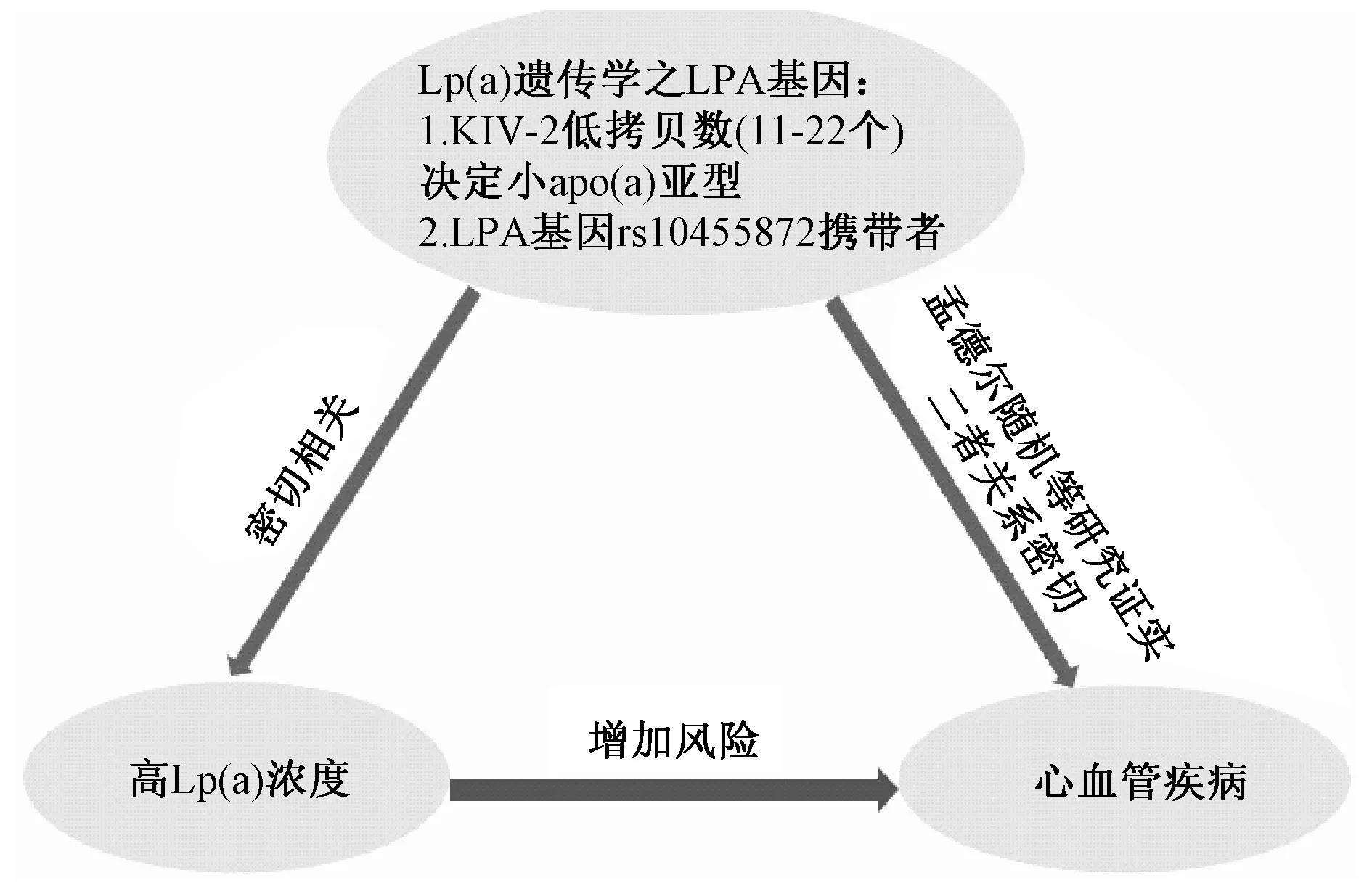
图2 Lp(a)遗传学与心血管疾病之间的相关性孟德尔随机等研究证实KIV 低拷贝数(11-22个)以及LPA 基因rs10455872 携带者均与高Lp(a)水平相关,同时增加心血管疾病风险
总之,现有许多遗传学证据表明高Lp(a)浓度导致MI的发生风险增加。 最近一项研究分析了欧洲七个前瞻性队列,共56 804 例入选(最高随访24 年)[20],发现Lp(a)水平存在地区差异并证实Lp(a)升高会增加主要冠状动脉事件(MCE)的风险。 在经年龄,性别和CVD 危险因素调整的分析中,Lp(a)水平≥90th 百分位数(对应于水平≥43.5 mg/dL)患者未来MCE 风险最高,HR 为1.49(95%CI:1.29 ~1.73)。 队列分析中,非裔美国人发生CVD 事件的HR 为1.35(95%CI:1.06 ~1.74),白种人为1.27(95%CI:1.10 ~1.47),这两大人群Lp(a)水平分别在最高与最低的五分位相[20]。 最近,来自巴基斯坦的心肌梗死风险研究(PROMIS)中,Saleheen 等[21]发现,更小的Apo(a)亚型大小和Lp(a)血浆浓度增加均与CHD 相关。 在该人群中,Lp(a)浓度中每增加一标准差(根据LPA KIV2 复制数和常规脂质调整的数据),其发生MI 的OR 值为1.10(95%CI:1.05 ~1.14, P<0.0001)。
(2)外周血管动脉粥样硬化 哥本哈根缺血性心脏病研究、哥本哈根颈动脉卒中以及哥本哈根心脏研究把Lp(a)浓度分成三组,发现第三分位发生颈动脉及股动脉粥样硬化的风险比第一分位高[22],KIV-2 拷贝数结果类似,对应的OR值分别为1.7(95%CI:1.2~2.5)和1.6(95%CI:1.3 ~2.0)。在InCHIANTI 研究中,对1 002 例60 岁以上人群进行一项随访超过6 年的踝臂指数评估,结果发现高Lp(a)是下肢外周动脉疾病的危险因素[11]。
(3)钙化性主动脉瓣狭窄 血浆高Lp(a)浓度是造成钙化性主动脉瓣狭窄最强的风险因素之一。 2013 年,Thanassouis 等发现LPA rs10455872 SNP 是MI 和CHD 的高危因素,同时也是主动脉瓣钙化和狭窄的最强的基因致病危险因素[23],该LPA SNP 对主动脉瓣钙化的HR 值为2.05(95%CI:1.63~2.57)。 在前瞻性分析中,该LPA SNP 每个等位基因对主动脉瓣狭窄的HR 值为1.68(95%CI:1.32 ~2.15),在瑞典和丹麦总体人群队列中为1.60(95%CI:1.12~2.28)。
哥本哈根市心脏研究发现高Lp(a)浓度增加主动脉瓣狭窄风险[24]。 进行多变量调整后,相比Lp(a)浓度<5 mg/dL,Lp(a)浓度为5~19 mg/dL 时主动脉瓣狭窄发生的HR 值为1.2(95% CI:0.8 ~1.7),Lp(a)浓度为20 ~64 mg/dL 时HR 值为1.6(95%CI:1.1~2.4),Lp(a)浓度为65~90 mg/dL时HR 值为2.0(95%CI:1.6 ~2.8),Lp(a)浓度高于90 mg/dL 时HR 值为2.9(95%CI:1.8~4.9)。 更多研究也证实,高Lp(a)水平是主动脉瓣钙化,主动脉瓣狭窄以及主动脉瓣狭窄进展的强致病风险因素[25],在白人和亚洲人中该结论也得到证实。
(4)家族性高胆固醇血症 早期研究表明在杂合或纯合型家族性高胆固醇血症(FH)患者中,除了LDL-C 水平,Lp(a)浓度也很高,但其机制至今不明。 一项在杂合FH 个体中进行的研究[26]发现,使用PCSK9 抑制剂后Lp(a)水平显著下降25%~30%,这表明Lp(a)至少也有一部分是由LDL受体(LDLR)分解代谢的,可以猜测当FH 患者的LDLR 存在缺陷时,其血浆LDL 和Lp(a)水平都会增加。
一项哥本哈根一般人口前瞻性队列研究[14]对46 200 名参与者进行Lp(a)测量并对家族性高胆固醇血症突变(FH)进行基因分型,得出诊断为FH 患者的Lp(a)浓度比非FH患者高39%~58%,而且1/4 的患者因为高水平Lp(a)而得到诊断,这可由Lp(a)含有LDL-C 成分从而有助于诊断FH得到解释。 另外LPA 危险基因型在FH 患者中更常见。 当用DLCN 标准诊断FH 时,疑似或明确为FH 患者的LPA 基因KIV-2 拷贝数(与Lp(a)浓度成反比)比不可能诊断为FH患者的更低(P<0.0001),LPA rs10455872 SNP(与高Lp(a)浓度有关)在可能(P=0.00012)、很可能(P≤0.001)以及确诊(P=0.21)为FH 患者中都比在不可能为FH 患者中更常见。 这也就不难理解此前欧洲动脉粥样硬化协会(EAS)提出对所有疑似临床FH 患者进行高Lp(a)浓度的筛查[27]。但是值得注意的是,由LPA 基因变异引起的Lp(a)浓度升高不是单基因形式,而是由LDLR、ApoB 和PCSK9 突变引起的多基因形式的FH[14]。
Gudbjartsson 等[28]在最新公布的一项病例对照研究中纳入了143 087 例冰岛人群,包括17 715 例CAD 和8 734 例2型糖尿患者群。 整体人群中具有Lp(a)nmol/L 浓度,KIV-2拷贝数及SNP G4 925 A,LPA 的剪接变异(如rs140570886,rs184278183,rs10455872 等)等信息。 研究发现Lp(a)nmol/L 浓度呈浓度依赖性与CAD 风险,外周血管病,主动脉瓣狭窄,心力衰竭以及寿命具有相关性。 Lp(a)nmol/L 浓度全面解释Lp(a)与CAD 的相关性。 功能缺失型突变的纯合子型所致Lp(a)的低浓度或缺如与2 型糖尿病的发病风险增加之间具有相关性。 nmol/L 浓度是Lp(a)影响心血管疾病发病风险的主要因素。 低Lp(a)浓度(处于最底10%)会增加2 型糖尿病风险。 该研究还发现在Lp(a)浓度最高的20%人群中,药物降低Lp(a)浓度可降低CAD 风险,但不增加2 型糖尿病风险。
综上所述,自1987 年成功测序编码Lp(a)中Apo(a)的LPA 基因以来,有关Lp(a)的遗传学研究得以广泛开展。 目前已知Lp(a)的生理功能是致动脉粥样硬化、促炎症和抗纤溶等作用。 新近一系列基因证据表明Lp(a)水平是多种心血管疾病的直接致病因素,同时我们发现,基于遗传学研究的新证据也提示有关Lp(a)与多种心血管疾病相关性仍存在诸多需深入探索的领域,如实验模型不足,缺乏全球标准化的Lp(a)检测,以及对当前药物治疗Lp(a)的机制理解不足等。 未来针对Lp(a)的基础、机制、临床前和临床研究仍需开展大量深入研究以更好地了解Lp(a)的病理生理学以及更好地服务于临床诊断和实现治疗方面的突破。
