丹参酚酸B调控ROS抑制大肠癌细胞HCT-116增殖并促进其凋亡
2020-12-22郭飘婷闵丽陈建军汪鑫倪思忆
郭飘婷 闵丽 陈建军 汪鑫 倪思忆
大肠癌包括结肠癌和直肠癌,是临床常见的高发病率、高病死率的消化道恶性肿瘤[1]。目前大肠癌的治疗多采用手术、放化疗、中医药、生物靶向疗法等综合治疗手段[2-4]。中医药及其有效成分在大肠癌治疗中具有抑制肿瘤、调节免疫、增效减毒、抗复发转移、提高生活质量等多方面的功效,具有重要地位[5-7]。丹参酚酸B(Salvianolic acid B,SalB)是从丹参中提取的水溶性酚酸类成分之一,相关研究发现,SalB具有抗大肠癌作用,然其确切机制尚不清晰[8-9]。活性氧簇(Reactive oxygen species,ROS)是生物体有氧代谢过程中产生含氧自由基和易形成自由基的过氧化物的总称[10],多项实验表明,ROS参与肿瘤细胞凋亡与增殖的调节[11-12]。本研究以体外培养的人大肠癌细胞HCT-116为研究对象,拟探讨SalB抑制对大肠癌细胞抑制增殖、促进凋亡的作用,通过检测其对细胞内ROS含量的影响,探究其抑制大肠癌生长的有效机制。
1 材料与方法
1.1 材料
人结直肠腺癌细胞HCT-116购自上海中科院细胞库;SalB购自麦克林;过氧化氢(H2O2)购自国药集团化学试剂有限公司;ROS清除剂NAC购自上海源叶生物科技有限公司;MTT试剂盒购自BBI Life Sciences;PBS磷酸盐缓冲液(pH7.2~7.4)、DMEM高糖培养基、Trypsin 0.25%(1×)Solution购自Hyclone;胎牛血清购自浙江天杭生物科技;多聚甲醛购自Maklin;细胞凋亡试剂盒购自BD;细胞周期试剂盒购自联科生物;结晶紫购自上海强顺化学试剂;6孔板购自康宁生物公司。
1.2 细胞培养
HCT-116细胞用含10%胎牛血清(FBS)、100 U/mL青霉素和链霉素的DMEM培养基,在5%CO2,37℃恒温箱内培养,待细胞长至80%~90%时按1∶2~1∶4的密度传代,每2~3 d传代1次。
1.3 MTT试验
MTT实验检测细胞存活率。取对数生长期的HCT-116细胞悬液接种于96孔板内,将培养板放在培养箱内预培养24 h;将SalB以一定浓度梯度(0、20、40、60、80、100 μg/mL)干预细胞,药物处理48 h后,观察各组细胞形态变化,更换新鲜培养基后加入MTT溶液,孵育4 h;孵育结束后,吸弃上清,每孔加入100 μL DMSO溶解,用酶标仪测定在450 nm处的吸光度,计算细胞存活率,细胞活性=(实验组A值-空白调零A值)/(对照组A值-空白调零A值)×100%。计算SalB对HCT-116细胞的IC50值。每组细胞平行测定6个复孔,实验重复3次。
1.4 ROS含量检测
实验分为4个组:HCT-116组、HCT-116+H2O2组、HCT-116+SalB组、HCT-116+SalB+NAC组。取对数生长期的HCT-116细胞种植于6孔板,每孔2 mL工作体积,细胞接种密度为每孔1.2×106个细胞。HCT-116组予完全培养液培养24 h;HCT-116+H2O2组予150 mmol/L H2O2作用24 h;HCT-116+SalB组予40 μg/mL SalB干预24 h;HCT-116+SalB+NAC组先予5 mM NAC作用24 h,换液后予40 μg/mL SalB处理24 h。无血清培养液1∶1 000稀释2′,7′-二氯荧光黄双乙酸盐(DCFH-DA),使其终浓度为10 μmol/L。各组分组处理后,弃去细胞培养液,加入适当体积稀释好的DCFH-DA。常温孵育20 min。用无血清细胞培养液洗涤细胞3次,过筛上机检测,实验重复3次。
1.5 平板克隆形成实验
分组和干预措施与ROS含量检测实验相同。分组处理后收集细胞,以500~1 000个细胞/孔浓度重新接种到6孔板培养板中,每个实验组设3个复孔,培养基为含30%FBS的完全培养基,每隔3 d进行换液并观察细胞状态,显微镜下观察克隆大小。待孔中大多数单个克隆中细胞数大于50,弃上清,PBS洗涤细胞1次,每孔加入1 mL 4%多聚甲醛,4℃冰箱固定细胞60 min,PBS洗涤细胞1次。每孔加入结晶紫染液1 000 μL,染细胞2 min。实验重复3次。
1.6 细胞周期实验
分组和干预措施与ROS含量检测实验相同。吸弃6孔板细胞上清,500 μL~1 mL PBS洗涤2次。每孔加入无EDTA胰酶200 μL进行消化,加入含血清培养基500 μL中止消化,收集细胞到1 mL EP管中,1 000 rpm离心3 min。加入1 mL PBS重悬细胞,1 000 rpm离心3 min,同上弃上清。加入500 μL DNA Staining solutio(含PI染液和RNase A)和5 μL Permeabilization solution重悬细胞。室温避光孵育30 min后1 000 rpm离心3 min,去上清。重悬细胞,过300目滤膜,移至新离心管。送流式细胞仪分析,实验重复3次。
1.7 细胞凋亡实验
分组和干预措施与ROS含量检测实验相同。预冷PBS洗涤2次,调整细胞浓度为1×106个/mL。加入500 μL结合缓冲液,离心弃上清,再加入100 μL结合缓冲液混匀后,分别加入5 μL Annexin V-FITC与10 μL PI,室温避光反应15 min,最后加入结合缓冲液400 μL,1 h内用流式细胞仪检测各组细胞凋亡率。实验重复3次。
1.8 统计学方法
2 结果
2.1 MTT法检测SalB对大肠癌HCT-116细胞毒性作用
SalB药物处理48 h后,各组(20、40、60、80、100 μg/mL)HCT-116细胞存活率与空白对照组相比均显著下降(P<0.01),说明SalB对HCT-116细胞具有抑制作用,且在一定范围内呈浓度依赖性,计算可得SalB对HCT-116细胞的IC50为54.01 μg/mL。后续实验SalB作用浓度选用40 μg/mL(图1)。
2.2 SalB对HCT-116细胞内ROS生成的影响
HCT-116+SalB组、HCT-116+H2O2组细胞ROS水平显著高于HCT-116组(P<0.01),提示SalB和H2O2能显著刺激HCT-116细胞ROS生成。予ROS清除剂NAC 5 mM预处理24 h,换液后予40 μg/mL SalB处理24 h,再通过FCM分析细胞ROS含量变化,结果显示,HCT-116+SalB+NAC组ROS水平较HCT-116+SalB组显著降低(P<0.01),证明NAC逆转SalB引起的HCT-116细胞内ROS升高(图2)。
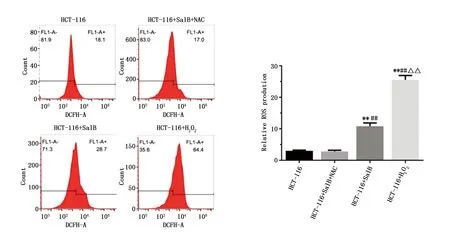
图2 SalB促进HCT-116细胞内ROS生成Figure 2 SalB induced the generation of ROS in HCT-116 cellsNote:**P<0.01,when compared with the HCT-116 group;##P<0.01,when compared with the HCT-116+SalB+NAC group;△△P<0.01,when compared with the HCT-116+SalB group.
2.3 SalB对HCT-116细胞克隆形成能力的影响
与HCT-116组比较,各组的细胞克隆数均下降(P<0.05),其中HCT-116+H2O2组细胞克隆数最少;与HCT-116+SalB组相比,HCT-116+SalB+NAC组细胞的克隆能力显著增强(P<0.01)。提示SalB、H2O2抑制HCT-116细胞增殖,而NAC可部分逆转由SalB引起的细胞抑制作用,表明SalB可通过促进ROS生成抑制HCT-116细胞增殖(表1,图3)。

表1 SalB通过ROS调节HCT-116细胞克隆形成能力Table 1 SalB regulated the ability of colony formation in HCT-116 cells through
2.4 SalB对HCT-116细胞周期阻滞的影响
为探究SalB对HCT-116细胞增殖的抑制作用是否与细胞周期阻滞有关,本研究利用流式细胞术分析各实验条件下细胞周期情况。与HCT-116组相比,HCT-116+SalB组、HCT-116+H2O2组细胞阻滞于G0/G1期,该期细胞数量均显著升高(P<0.01),S期、G2/M期细胞数量均显著降低(P<0.01),可见SalB、H2O2对HCT-116细胞具有周期阻滞作用,阻滞于G0/G1期;与HCT-116+SalB组相比,HCT-116+SalB+NAC组细胞在G0/G1期显著减少(P<0.05),S期无变化(P>0.05),G2/M期显著升高(P<0.01),说明NAC可逆转SalB引起的HCT-116细胞周期阻滞作用,SalB引起HCT-116细胞周期阻滞的作用机制为增加细胞内ROS含量(图4)。
2.5 SalB对HCT-116细胞凋亡的影响
采用Annexin V-FITC/PI双染法分析SalB对HCT-116大肠癌细胞凋亡的影响。SalB、H2O2干预显著增加细胞凋亡率,与HCT-116组相比有统计学意义(P<0.01);先予NAC预处理再用SalB干预时,细胞凋亡率明显低于单独用SalB组(P<0.05),但仍高于对照组HCT-116组(P<0.05)。该实验显示SalB促进HCT-116细胞凋亡,而该作用可被NAC部分逆转,说明SalB促凋亡机制与其上调ROS有关(图5)。

图3 SalB抑制HCT-116细胞克隆形成能力Figure 3 Inhibitory effect of SalB on colony formation of HCT-116 cellsNote:A.The HCT-116 group;B.The HCT-116+SalB+NAC group;C.The HCT-116+ SalB group;D.The HCT-116+H2O2 group.*P<0.05,**P<0.01,when compared with the HCT-116 group;##P<0.01,when compared with the HCT-116+SalB+NAC group; △P<0.05,when compared with the HCT-116+SalB group.

图4 SalB引起HCT-116细胞周期阻滞Figure 4 SalB arrested cell cycle of HCT-116 cellsNote:*P<0.05,**P<0.01,when compared with the HCT-116 group;#P<0.05,##P<0.01,when compared with the HCT-116+SalB+NAC group; △P<0.05,when compared with the HCT-116+SalB group.

图5 SalB促进HCT-116细胞凋亡Figure 5 SalB induced apoptosis of HCT-116 cellsNote:*P<0.05,**P<0.01,when compared with the HCT-116 group;#P<0.05,when compared with the HCT-116+SalB+NAC group.
3 讨论
随着中医学的发展及科研的进步,越来越多的研究证明中医药在大肠癌治疗中具有独特优势[13-14]。在抑制大肠癌生长方面,中药具有多靶位、多途径及毒副作用小、安全性高等治疗优势[15-16],因此中药在抗大肠癌的研究中倍受关注。《灵枢·百病始生》中指出:“凝血蕴裹而不散,津液涩渗,著而不去,而积皆成矣。”提出血液淤滞是积病的病机关键。目前普遍认为大肠癌发病总属本虚标实、虚实夹杂之证,血瘀证为大肠癌实证主要证型之一[17-18]。丹参是最常用的活血化瘀中药之一,SalB是丹参水溶性成分中最主要的活性物质,其在抗肿瘤方面的作用也越来越被重视[19-21]。课题组前期研究已初步证明SalB对大肠癌多药耐药的逆转作用,本研究拟进一步探讨SalB对大肠癌生长的抑制作用及其潜在作用机理。
ROS主要由线粒体产生,当机体处于氧化应激状态时,细胞内ROS蓄积可引起脂质体过氧化,破坏线粒体膜,诱导线粒体跨膜电位耗散,促使线粒体释放促凋亡因子,使绝大多数细胞器,包括线粒体在内产生损伤,严重时导致细胞死亡[22]。大量研究证明,ROS通过影响细胞信号转导参与肿瘤细胞凋亡与增殖的调节[23-25]。本研究采用流式细胞仪测定细胞内ROS含量发现,SalB干预HCT-116细胞使得细胞内ROS含量升高,而NAC可清除SalB产生的ROS。
肿瘤的发生发展与细胞的增殖和凋亡失衡有关[26]。本研究应用MTT法检测SalB对大肠癌HCT-116细胞活性的影响,结果显示在一定浓度范围内SalB量效相关性抑制HCT-116细胞生长。为进一步探究其确切机制,通过克隆形成实验检测细胞克隆形成能力,发现SalB抑制HCT-116细胞克隆形成,NAC预处理可部分逆转由SalB引起的细胞抑制作用,表明ROS参与介导SalB对HCT-116细胞的增殖抑制作用。细胞周期是指细胞从上一次的分裂结束到下一次分裂所经历的过程,共分为G0(静息期)、G1(DNA合成前期)、S(DNA合成期)、G2(DNA合成后期)和M(有丝分裂期),周期进程中有G1→S、S→G2和G2→M三个检查点,G0/G1期阻滞可阻断DNA合成,从而抑制肿瘤细胞增殖。采用流式细胞术检测细胞周期发现,SalB可将HCT-116细胞周期阻滞于G0/G1期,而该周期阻滞作用可被NAC逆转,证明SalB通过上调ROS导致HCT-116细胞周期阻滞,进而降低细胞增殖能力。进一步采用Annexin V-FITC/PI双染法检测SalB对HCT-116大肠癌细胞凋亡的影响,证实SalB可促进HCT-116细胞凋亡,而该作用可被NAC部分逆转,说明SalB促凋亡机制与其增加细胞内ROS含量有关。
综上所述,SalB抑制大肠癌细胞HCT-116生长与细胞内ROS水平升高有关,一方面引起细胞周期G1/S转换过程阻滞,抑制细胞增殖;另一方面促进细胞凋亡。本研究未深入开发ROS效应机制,后续研究中将进一步寻找ROS下游靶标,挖掘SalB抗肿瘤分子机制,为SalB抗肿瘤提供科学依据。
