基于MiSeq高通量测序技术宣恩地区米酒微生物多样性解析
2020-11-19向凡舒刘雪婷代程洋张振东
向凡舒,刘雪婷,代程洋,张振东,郭 壮,2,*
(1.湖北文理学院食品科学技术学院鄂西北传统发酵食品研究所,湖北襄阳 441053; 2.恩施市公共检验检测中心,湖北恩施 445000)
湖北地区居民自古就有制作和饮用米酒的习俗,其中最具名气的当属孝感米酒,孝感米酒现已较好地实现了产业化发展,产品更是远销海内外[1]。
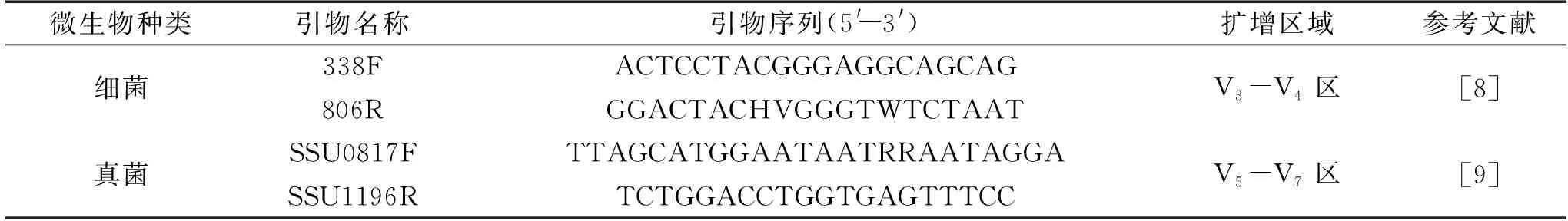
表1 PCR扩增引物序列信息Table 1 The information of PCR amplification primer sequence
除孝感米酒外,湖北其他地区的居民尤其是少数民族居民亦有制作米酒的习俗。米酒是以糯米或籼米为基质,接入米酒曲自然发酵而成,微生物群系对其产品品质的形成具有重要的作用[2]。
国内学者对不同地区产米酒的微生物多样性进行了解析,王艳萍等[3]采用传统的微生物学手段对米酒醪中的微生物进行了分离鉴定,确定了毛霉属是米酒发酵过程中主要的优势菌属,宁亚丽等[4]研究发现吉林延边朝鲜族地区米酒中的优势菌隶属于乳杆菌属(Lactobacillus)和肠杆菌属(Enterobacter),但是传统的微生物学技术主要依赖纯培养的技术,难以获得食品中微生物种群的完整信息。作为第二代测序技术,MiSeq高通量测序不仅测序结果可信度高,且能够对某一微生物群落结构进行全面和客观的分析[5]。采用该技术,本研究团队前期对孝感米酒曲的微生物多样性进行了解析,研究发现,乳球菌属和魏斯氏菌属为孝感米酒曲中的优势细菌[6],而其真菌类群主要由隶属于毛霉亚门和子囊菌门的淀粉霉属、小克银汉霉属、毛霉属、复膜孢酵母属、曲霉属、念珠菌、拟威尔酵母和接合酵母属的8个属组成[7]。而宣恩县侗族居民酿造米酒中微生物的多样性尚待解析。
本研究采用MiSeq高通量测序技术对湖北省恩施土家族苗族自治州宣恩地区米酒的细菌和真菌群落结构进行揭示,通过本研究的实施进一步丰富米酒微生物多样性解析的数据,进而对后续米酒中微生物菌种资源收集、保藏和遗传多样性解析提供理论支撑。
1 材料与方法
1.1 材料与仪器
QIAGEN DNeasymericon Food Kit 德国QIAGEN公司;dNTPs Mix、5×TransStartTM、FastPfu Buffer、FastPfu Fly DNA聚合酶(5 U/μL) 北京全式金生物技术有限公司;DNA1000试剂盒 美国Agilent公司。
DYY-12电泳仪 北京六一仪器厂;vetiri梯度基因扩增仪 美国AB公司;PE 300 MiSeq高通量测序平台 美国Illumina公司;R930机架式服务器 美国DELL公司。
1.2 实验方法
1.2.1 样品的采集和DNA的提取 从湖北省恩施土家族苗族自治州宣恩县李家河镇的农户家中采集3个米酒样品,将样品采集后置于装有冰袋的采样箱中低温运回实验室。根据QIAGEN DNeasymericon Food Kit试剂盒中的方法对样品进行宏基因组的提取,并对DNA的浓度进行测定,将检测合格的样品置于-20 ℃冰箱备用。
1.2.2 PCR扩增及MiSeq高通量测序 参照Qiu等[8]的方法对细菌16S rRNA的V3~V4区进行PCR扩增,参照Rousk等[9]的方法对18S rRNA的V5~V7区进行PCR扩增,使用1%琼脂糖凝胶电泳对扩增产物进行检测,检测合格的产物寄至上海美吉生物医药科技有限公司进行测序。
1.2.3 序列质控及生物信息学分析 参照Sun等[10]的方法对返回的序列进行质量控制并根据核苷酸标签(barcode)区分序列来源,从而得到高质量的序列。参考Du等[11]的方法,通过使用QILME平台[12]对3个米酒样品进行物种以及多样性的分析:首先采用PyNAST[13]将序列对齐,然后用UCLUST[14]软件先按照100%相似度得到无重复的单一的序列,随后按照97%的相似度建立操作分类单元(Operational taxonomic units,OTU),从细菌OTU中选出代表性的序列和SILVE数据库[15]、greengene数据库[16]和RDP(Ribosomal Database Project,Release 11.5)数据库[17]进行比对,并从真菌OTU中选出代表性的序列和SILVE数据库进行比对,从而确定细菌和真菌的各分类学地位,并对物种多样性和香农指数等α多样性进行研究。
1.2.4 核酸登录号 本研究中所有序列数据已提交至MG-RAST数据库[18],ID号为mgp91123。
1.3 数据统计
采用超1指数和香农指数对样品细菌和真菌的丰富度和多样性进行评价,使Origin 8.5完成稀疏曲线和香农曲线的绘制,维恩(Venn)图由在线软件Venny 2.1(http://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制,其他的图均由R进行绘制。
2 结果与分析
2.1 样品测序数据
宣恩米酒细菌和真菌的测序情况和各门、纲、目、科及属的分类地位如表2所示。
由表2可知,3个宣恩米酒样品一共产生了89101条16S rRNA V3~V4区核苷酸序列,平均每个样品产生29700条序列。根据100%的相似度对序列进行划分得到27645条代表性的序列,继而根据97%的相似度对序列进行划分共得到4422个OTU。当测序深度在26010条序列时,XEMJ1、XEMJ2和XEMJ3的超1指数分别为908、854和752,其香农指数分别为5.60、4.31和4.19。由此可见,XEMJ1具有最高的细菌物种丰富度及群落种类多样性。
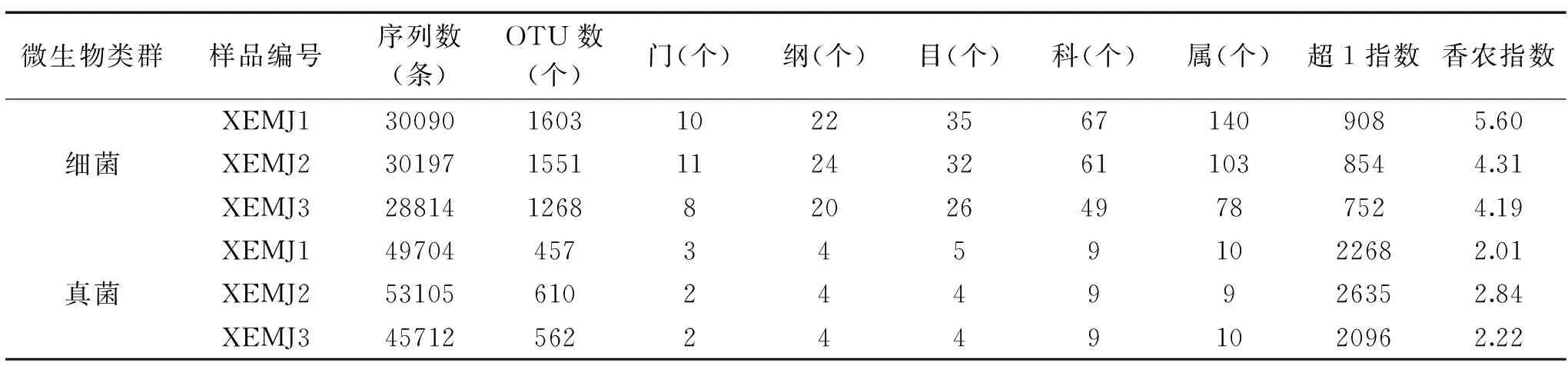
表2 测序情况及各分类地位数量Table 2 Sequencing results and numbers at different taxonomical levels
由表2亦可知,XEMJ1、XEMJ2和XEMJ3产生的18S rRNA V5~V7区核苷酸序列分别为49704条、53105条和45712条,根据100%的相似度对序列进行划分得到21895条代表性的序列,继而根据97%的相似度进行划分共得到1629个OTU。当测序量在44010条序列时,XEMJ2的超1指数和香农指数均最大,分别为2635和2.84,由此可见XEMJ2具有最高的真菌物种丰富度和群落种类多样性。
由图1(A)可知,随着测序深度的增加,细菌和真菌的发现物种数在继续增加。由图1(B)可知,当测序深度大于5000时,细菌和真菌的香农指数开始进入平台期,说明即使增加测序深度,此时的群落种类多样性可能不会增加。因此本研究的测序深度满足后续实验要求。由图1亦可知,XEMJ1的细菌丰度和多样性最大,XEMJ2的真菌丰度和多样性最大,与表2的结果一致。
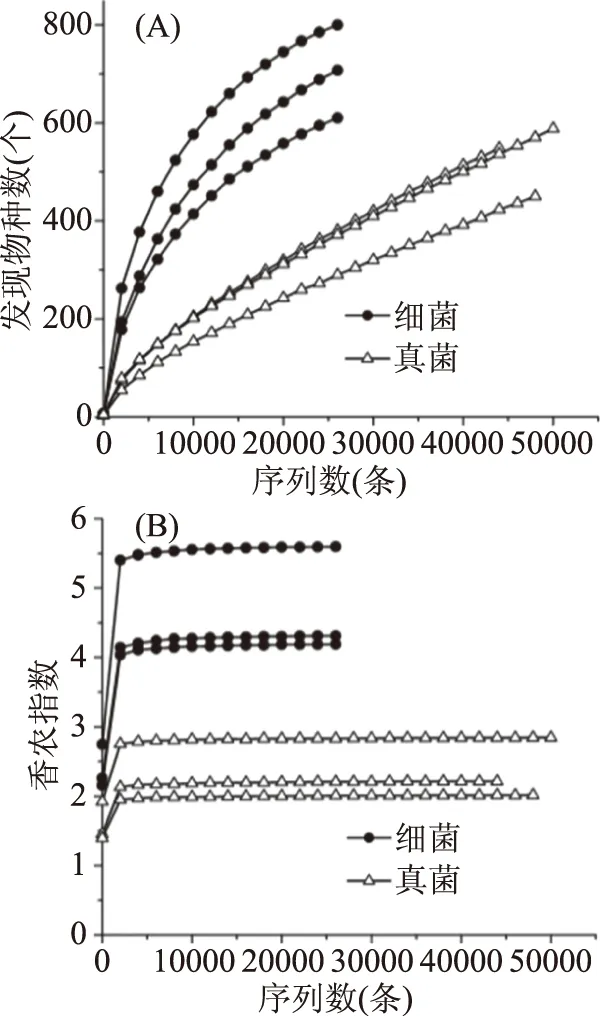
图1 稀疏曲线(A)和香农指数曲线(B)Fig.1 Sparse curve(A)and shannon index curve(B)
2.2 基于门属水平样品细菌和真菌群落组成分析
进一步在门属水平上对宣恩米酒的细菌群落组成进行分析发现,平均相对含量大于1.0%的门有3个,本研究将这3个门定义为优势细菌门,平均相对含量大于1.0%的属有6个,将其定义为优势细菌属,其在每个样品中相对含量如图2所示。
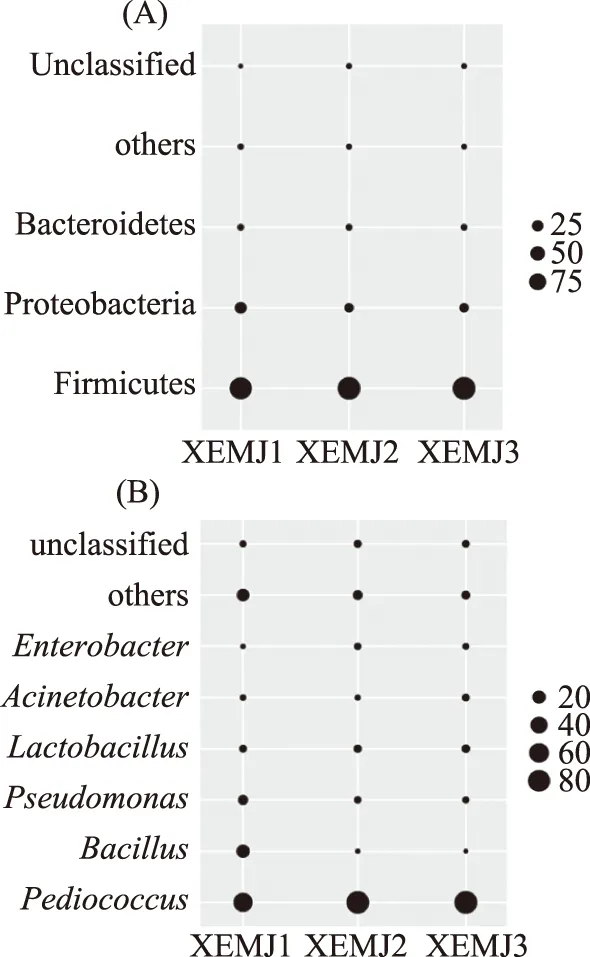
图2 优势细菌门(A)和属(B)相对含量Fig.2 Relative abundances of domainbacterial phylum(A)and genera(B)
由图2(A)可知,宣恩米酒中主要的细菌门分别为Firmicutes(硬壁菌门)、Proteobacteria(变形菌门)和Bacteroidetes(拟杆菌门),其平均相对含量分别为89.53%、8.72%和1.10%。由图2(B)可知,宣恩米酒中优势细菌属分别为Pediococcus(片球菌属,74.10%)、Bacillus(芽孢杆菌属,6.32%)、Pseudomonas(假单胞菌属,3.58%)、Lactobacillus(乳杆菌属,3.03%)、Acinetobacter(不动杆菌属,1.22%)和Enterobacter(肠杆菌属,1.08%)。由此可见,宣恩米酒中的细菌主要由隶属于硬壁菌门的片球菌构成。片球菌是革兰氏阳性菌,可以利用碳水化合物产生乳酸,不产气,不能够分解蛋白,但是可以促进发酵食品产生一些特殊的风味物质,已报道的片球菌不仅可以作为促酵物来参与肉类和蔬菜的发酵[19],而且可以降低发酵物种的含胺量[20],因此片球菌在米酒的发酵过程中起着非常重要的作用。向凡舒等[21]采用DGGE和Illumina MiSeq高通量测序技术对恩施地区的米酒的细菌多样性进行分析发现,硬壁菌门、变形菌门和拟杆菌门为恩施地区米酒中的优势细菌门,与本研究的结果一致,但Pediococcus、Enterococcus、Weissella、Kosakonia和Prevotella为恩施地区米酒中的优势细菌属。而本研究中宣恩米酒的细菌优势属与恩施地区米酒中的微生物群系构成不同,且宣恩米酒中的乳杆菌属是细菌群系中的优势细菌属,乳杆菌可在米酒的发酵过程中将糖类物质转化成乳酸,同时产生乙醇和乙酸等副产物,从而赋予米酒特有的风味,并有效的抑制其他杂菌的生长。对宣恩米酒样品中优势真菌门和属相对含量的分析结果如图3所示。
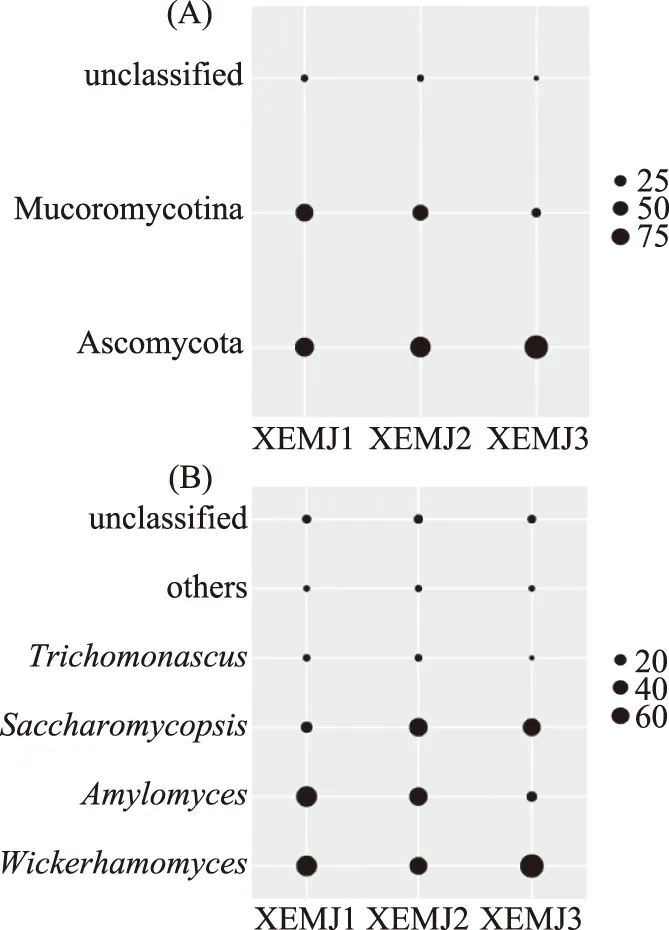
图3 优势真菌门(A)和属(B)相对含量Fig.3 Relative abundances of domainfungal phylum(A)and genera(B)
由图3(A)可知,宣恩米酒中主要的真菌门是Ascomycota(子囊菌门)和Mucoromycotina(毛霉亚门),其相对含量分别为71.25%和27.52%。由图3(B)可知,宣恩米酒中优势真菌属分别是Wickerhamomyces(异常威克汉姆酵母属,44.67%)、Amylomyces(淀粉菌,27.06%)、Saccharomycopsis(扣囊复膜酵母,23.10%)和Trichomonascus(1.20%)。异常威克汉姆酵母属在食品的发酵过程中起着重要的作用,具有提高乙酸乙酯产量从而增加发酵食品的口感和风味的作用[22]。
2.3 基于OTU水平样品细菌和真菌群落组成分析
本研究进一步在OTU水平上对米酒微生物类群进行了揭示,若某个OTU仅在一个样品中出现,将其定义为该样品中的特有序列,若在3个样品中均存在则将其定义为核心OTU,结果图4所示。
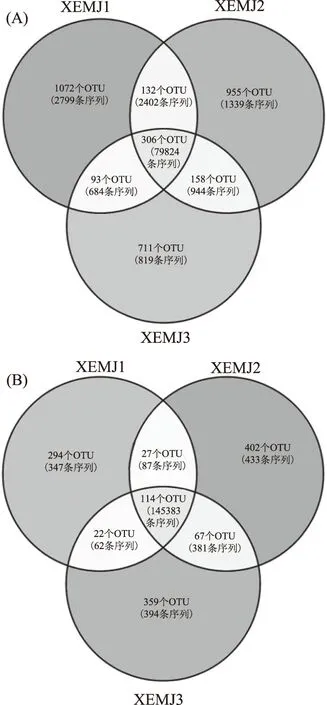
图4 细菌(A)和真菌(B)OTU的veen图Fig.4 Veen diagram of bacterial(A)and fungal(B)OTU
由图4(A)可知,XEMJ1、XEMJ2和XEMJ3样品中特有的细菌序列分别为2799条、1339条和819条。虽然细菌核心OTU仅有306个,但序列条数有79824条,占所有序列的89.88%。由图4(B)可知,XEMJ1、XEMJ2和XEMJ3样品中特有的真菌序列分别为347条、433条和394条,虽然真菌的核心OTU有114个,但所含序列数有145383条,占所有序列的98.8%,由此可见,虽然含有少量的特有微生物类群,但是宣恩米酒样品中存在大量的核心细菌和真菌类群。
若某个核心OTU在3个宣恩米酒样品中的相对含量大于1.0%,将其定义为核心优势OTU,其相对含量的热图如图5所示。
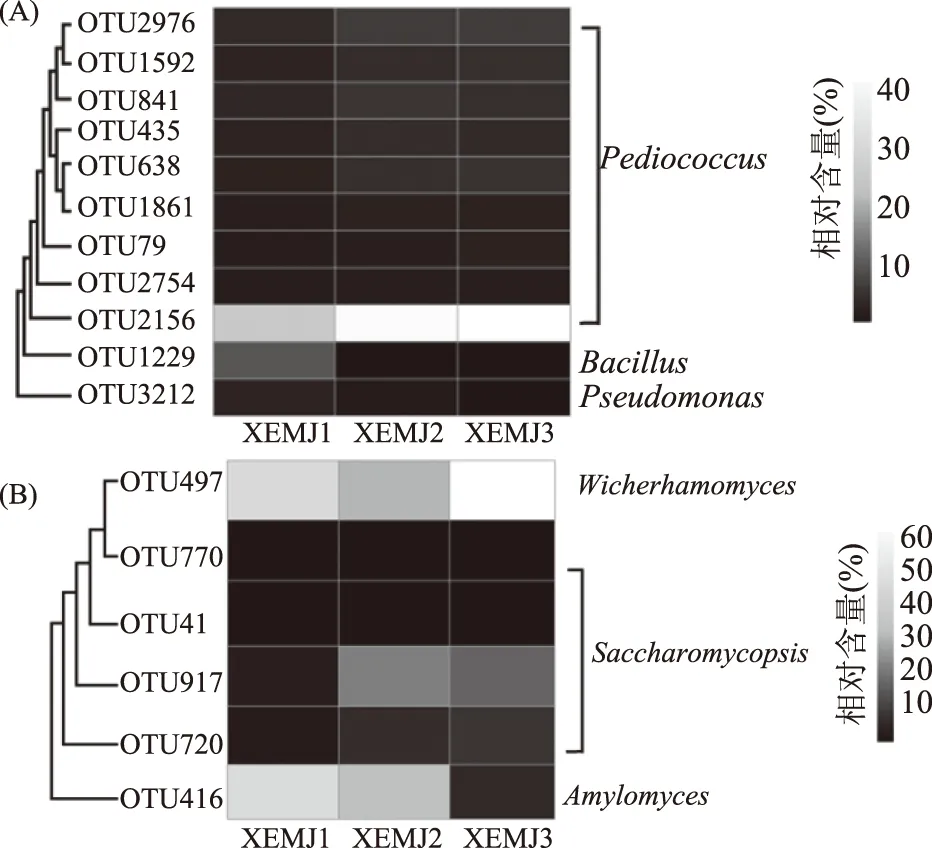
图5 细菌(A)和真菌(B)核心优势OTU相对含量的热图Fig.5 Heat map of relative abundances ofcore domainbacterial(A)and fungal(B)OTU
由图5(A)可知,11个细菌核心优势OTU中有9个隶属于Pediococcus(片球菌属),1个隶属于Bacillus(芽孢杆菌属),1个隶属于Pseudomonas(假单胞菌属)。在9个核心优势OTU中,OTU2156在样品中的相对含量均是最高的,其在3个宣恩米酒样品中的相对含量分别为25.28%、41.80%和43.40%,该OTU隶属于Pediococcus(片球菌属)。由图5(B)可知,在对真菌核心优势OTU进行分析可知,6个核心优势OTU中,OTU770、OTU41、OTU917和OTU720均隶属于Saccharomycopsis(复膜酵母菌属),平均相对含量分别为1.17%、1.02%、13.51%和5.18%;OTU497隶属于Wickerhamomyces(异常威克汉姆酵母属),平均相对含量为44.67%,而OTU416隶属于Amylomyces(淀粉霉属),平均相对含量为26.94%。上述结果也进一步证明宣恩米酒样品中存在大量的核心细菌和真菌类群。
2.4 优势细菌和真菌属的相关性分析
本研究发现了6个优势细菌属和4个优势真菌属,其相关性结果如图6所示。
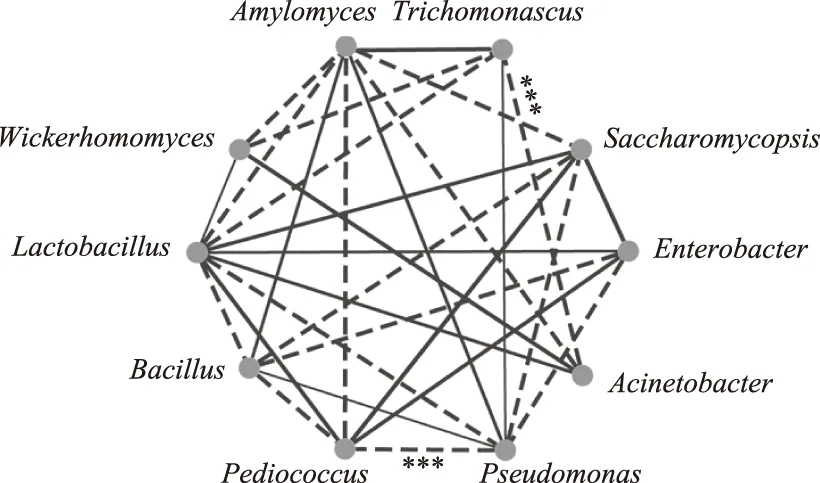
图6 细菌和真菌优势属相关性网络图Fig.6 Network diagram of domainbacterial(A)andfungal(B)genera based on correlation coefficient注:实线表示正相关,虚线表示负相关,线越粗表示相关性越强;***表示P<0.001。
由图6可知,Trichomonascus和Acinetobacter(不动杆菌属)之间呈极显著负相关(r=-0.998,P<0.001),Bacillus(芽孢杆菌属)和Pediococcus(片球菌属)之间呈极显著负相关(r=-0.999,P<0.001),Pediococcus(片球菌属)和Pseudomonas(假单胞菌属)之间呈极显著负相关(r=-0.999,P<0.001),其他优势菌属之间的相关性差异并不显著(P>0.05)。微生物构成是发酵食品品质形成的重要因素,不同的微生物在食品发酵过程中也具有不同的作用。崔梦君等[23]对豆瓣酱中的优势细菌属与COGs功能进行分析知,碳水化合物的运输和代谢与片球菌属呈显著正相关。由此可见,片球菌属对食品的发酵过程具有促进作用。
3 结论
本研究采用Illumina MiSeq测序技术对宣恩米酒微生物多样性进行了解析,结果显示优势细菌门分别为Firmicutes(硬壁菌门)、Proteobacteria(变形菌门)和Bacteroidetes(拟杆菌门),优势细菌属分别为Pediococcus(片球菌属)、Bacillus(芽孢杆菌属)、Pseudomonas(假单胞菌属)、Lactobacillus(乳杆菌属)、Acinetobacter(不动杆菌属)和Enterobacter(肠杆菌属),优势真菌门为Ascomycota(子囊菌门)和Mucoromycotina(毛霉亚门),优势真菌属分别为Wickerhamomyces(异常威克汉姆酵母属)、Amylomyces(淀粉菌)、Saccharomycopsis(复膜酵母菌属)和Trichomonascus。虽然含有少量的特有微生物种群,但样品中存在大量的核心细菌和真菌类群。
