一株海洋发光细菌的分离、鉴定及发光特性
2020-11-06于振豪吕岚清刘文侃李玉洁卓文琪
于振豪,吕岚清,刘文侃,黄 馨,李玉洁,卓文琪,陈 燕,马 军,黄 海
(1.海南热带海洋学院 a.热带海洋生物资源利用与保护教育部重点实验室;b.海南省热带海洋渔业资源保护与利用重点实验室;c.水产与生命学院,海南 三亚 572022;2.宁波大学 海洋学院,浙江 宁波 315823)
0 引言
发光细菌是一类在正常生理条件下能产生荧光素酶并利用其发射可见荧光的细菌.目前,已知的发光细菌主要涉及弧菌属(Vibrio)、希瓦氏菌属(Shewanella)、发光杆菌属(Photobacterium)和光杆菌属(Photorhabdus)[1],其中,明亮发光杆菌(P.Phosphoreum)、费氏弧菌(V.fischeri)和青海弧菌(V.qinghaiensis)等被广泛应用于环境毒性检测[2-4].这些发光细菌都是在氧气的作用下,由细菌荧光素酶催化长链脂肪醛(RCHO)和还原型黄素单核苷酸(FMNH2)的氧化还原反应,释放出波长450~490 nm的可见荧光.发光细菌的发光特性一直是人们比较关注的问题,各国研究人员对此进行了不少研究,如发光细菌的发光机制,发光基因Lux系统及其表达产物荧光素酶等[5-8].研究表明,任何干扰或损害细菌正常生理代谢过程的因素均会对发光细菌的发光强度产生不同程度的影响[9-10].因此,利用发光细菌作为指示生物监测环境中有毒有害物质的污染风险,已成为发光细菌的主要用途之一.发光细菌与环境急性毒性物质的关系,以及利用海洋发光细菌作为生物传感器的研究也是目前的热点之一[11-12].发光细菌发光所依赖的荧光素酶是一种与细胞膜结合的糖蛋白,其与细菌呼吸代谢密切相关[13].通过改变细胞膜的渗透性、阻碍细胞膜的电子传递、抑制蛋白质的合成等方式均能影响细胞呼吸链的正常运行,从而影响发光细菌的荧光强度.研究表明,不同盐浓度、pH值和温度对不同发光细菌的生长及发光产生不同程度的影响[14],而不同发光细菌对环境中不同类型重金属的敏感程度存在显著性差异[15].因此,深入探究发光细菌的发光特性是进一步应用发光细菌的前提和基础.本研究通过对一株海水中分离得到的发光细菌进行发光特性的探索,旨在发现该菌株的应用前景,为进一步拓展其应用领域提供理论依据.
1 材料与方法
1.1 试剂
高盐培养基(固体):酵母膏5.0 g,胰蛋白胨5.0 g,氯化钠30 g,磷酸氢二钠5.0 g,磷酸二氢钾1.0 g,甘油0.6 g,琼脂粉15 g,去离子水1 000 mL,pH(7.5±0.2),高温高压灭菌后备用.
液体培养基:酵母膏5.0 g,胰蛋白胨5.0 g,氯化钠30 g,磷酸氢二钠5.0 g,磷酸二氢钾1.0 g,甘油0.6 g,去离子水1 000 mL,pH(7.5±0.2),高温高压灭菌后备用.
磷酸盐缓冲溶液(PBS):氯化钠8.0 g,氯化钾0.2 g,磷酸氢二钠1.42 g,磷酸二氢钾0.27 g,去离子水1 000 mL,高温高压灭菌后备用.
1.2 实验方法
1.2.1 菌株分离
从三亚湾近岸(E/W:109°493 472′;N/S:18°259 866′)采集海水500 mL(pH8.2,盐度33),将取样的海水静置30 min后取上清液,按一定浓度梯度稀释后涂布于高盐培养基上,30 ℃恒温培养18~24 h,在暗环境中观察平板上菌落的发光情况,并标记,挑取一枚发光良好的菌落,命名为L2.
1.2.2 菌株鉴定
细菌生理生化实验参考《常见细菌系统鉴定手册》[16]和《伯杰氏细菌鉴定手册》[17].菌株16S rRNA基因保守序列使用通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′进行PCR扩增.PCR反应体系(50 μL)中,含有2 μL DNA模板,引物各0.5 μL,4 μL dNTPs混合液,10×PCR缓冲液5 μL,ExTaqDNA聚合酶0.25 μL.扩增前95 ℃预变性3 min,扩增循环为95 ℃变性30 s,50 ℃复性30 s,72 ℃延伸90 s,30次循环.扩增产物经PCR产物纯化试剂盒(Axygen PCR清洁试剂盒)纯化后,送北京六合华大基因科技有限公司测序.
测得的菌株16S rRNA基因序列在GenBank数据库中进行BLAST比对分析.采用MEGA-X软件的Neighbor-Joining算法构建系统发育树,进化距离使用Kimura 2-parameter模型进行计算,系统发育树使用1 000次重复的Bootstraps进行统计学检验.
1.2.3 发光强度与细菌菌量的关系
将菌株接种于固体培养基上,挑取单个菌落接种于5 mL液体培养基中,在30 ℃下150 r·min-1摇床振荡培养24 h.以0.1%的接种量将种子液接种在液体培养基中,在30 ℃下150 r·min-1摇床振荡培养6 h,吸取1 mL菌液作为原液,使用PBS按照5倍稀释梯度获得不同浓度的菌液,各取200 μL加入96孔板上,每个浓度至少3个孔,用化学发光仪(Analytik Jena,ChemStudio SA2)对其进行曝光10 min处理,之后用分析软件VisionWorks(v8.20)对结果进行分析,读出荧光强度值;另外取不同浓度的菌液200 μL,涂布于营养琼脂平板,30 ℃恒温培养12 h后,读取平板上的菌落数量,根据稀释倍数计算出原液及不同稀释倍数下单位体积的细菌菌落形成单位(cfu·mL-1),以Lg(cfu·mL-1)为横坐标,不同浓度菌液的荧光强度为纵坐标,绘制发光强度与细菌菌量的关系图,同时进行线性回归分析.
1.2.4 菌株生长曲线及发光强度变化曲线的绘制
以0.1%接种量将细菌L2转接至24个含有100 mL培养基的三角瓶中,在30 ℃下恒温培养24 h.从0 h开始,每隔1 h取1 mL菌液,10 h以后,每隔2 h取1 mL菌液.不同时间点所取的菌液分为2份,1份按10倍梯度稀释涂平板,培养24 h后,读取单菌落数量,并计算cfu·mL-1;取另一份菌液200 μL读取发光强度.以时间为横坐标,Lg(cfu·mL-1)或荧光强度为纵坐标,绘制生长曲线和发光强度曲线.
1.2.5 不同培养温度、pH值和氯化钠浓度对发光强度的影响
以0.1%接种量将细菌L2转接至不同培养条件下的培养基中,培养温度设置为15,20,25,30,35,40 ℃;初始pH值设置为4,5,6,7,8,9,10,11,12;氯化钠浓度设置为0,1%,2%,3%,4%,5%,6%,7%,8%.不同单因素条件培养24 h,取200 μL读取发光强度.以时间为横坐标,荧光强度为纵坐标绘制发光强度的曲线.
1.2.6 数据处理及分析
采用SPSS(v20)软件对实验数据进行统计分析.所有实验数据均重复3次,并计算标准误差,结果以“平均值±标准差(Mean ± SD)”表示.
2 结果与分析
2.1 菌株鉴定
从图1(a)和图1(c)可知,L2单菌落为圆形,边缘较光滑,中心稍微隆起,略呈乳白色,能在暗处发出蓝绿色荧光.L2菌体呈短杆状,革兰氏染色为紫红色,确定是革兰氏阴性菌图1(b).从表1可知,L2细菌不能在4 ℃或40 ℃生长,不产淀粉酶和明胶酶等,可以利用D-果糖、葡萄糖、蔗糖和麦芽糖,接触酶反应为阴性,V.P试验和吲哚试验均显阳性,这些特征与发光杆菌属的鳆鱼发光杆菌(P.leiognathi)较为相似.

图1 L2菌株的菌落形态、革兰氏染色及其荧光图

表1 不同菌株的生化特征分析
2.2 16S rRNA 序列分析
16S rRNA序列比对结果进一步确定L2菌株与P.leiognathi(X74686)最为接近,相似度为96.8%,详细结果见图2.

图2 基于16S rRNA序列构建的系统发育树
2.3 发光强度与细菌菌量的关系
本研究用荧光/化学发光检测仪检测发光细菌的荧光强度,需要确定荧光强度的检测范围及其与细菌菌量的关系.从图3可知,不同浓度的细菌所产生的荧光强度与菌量Lg(cfu·mL-1)成较为明显的线性关系(R2=0.962 2),荧光强度检测的有效范围在(371.50±28.81)~(24 639.31±181.91).

图3 不同细菌浓度的荧光强度及线性回归分析
2.4 菌株生长曲线及发光强度变化曲线
如图4所示,在5 h左右时,菌体已经进入生长期,此时细菌才开始发光,发光强度相对较弱,细菌发光与生长周期不同步,相对滞后,属于非耦联关系.培养5~9 h过程中,菌量逐渐升高并趋于稳定,进入稳定期,而此时细菌发光强度快速增长,在9 h时达到最大值,但维持时间较短.此后,发光强度则呈现出明显的下降趋势,在15 h以后,发光强度下降趋势逐步减缓,而此时细菌也进入衰亡期,这可能是由于细菌快速增长消耗大量氧气,而氧气是细菌生长及发光过程中的必备条件之一.

图4 菌株L2的生长曲线及发光曲线
2.5 发光影响因素分析
2.5.1 不同培养温度对发光强度的影响
从图5可看出,细菌L2在15~40 ℃之间均可以生长,但其发光的温度范围为20~35 ℃,其中30 ℃为最佳发光条件,培养温度低于或超过30 ℃时,细菌生长均出现一定程度的下降,细菌发光强度也明显受到抑制,尤其是温度低于20 ℃时,荧光强度降低了约73%,这说明该菌对温度较为敏感.

(a)荧光强度变化情况 (b)细菌生长变化情况图5 不同培养温度下L2菌株发光强度及细菌生长变化情况
2.4.3 不同氯化钠浓度对发光强度的影响
从图6(a)和图6(b)可知,细菌L2在盐浓度为0~8%之间均可以生长,属于广盐性细菌.当氯化钠浓度为1%~4%时,细菌L2生长最为旺盛,在此范围内,荧光强度随氯化钠浓度上升而增强,氯化钠浓度为4%时,荧光强度达到最大值,此后,荧光强度随氯化钠浓度上升而快速下降.当培养基中没有氯化钠时,细菌L2完全丢失发光特性,这说明该菌的发光特性需要氯化钠等盐离子的参与;当培养基中氯化钠浓度达到8%时,该菌的发光特性受到强烈抑制,这有可能是过高的盐离子浓度破坏了菌体渗透压平衡,致使发光特性下降或丢失.

(a)荧光强度变化情况 (b)细菌生长变化情况图6 不同氯化钠浓度下L2菌株发光强度及细菌生长变化情况
2.4.4 不同初始pH对发光强度的影响
从图7(a)和图7(b)可知,细菌L2可以在pH为4~10的初始条件下生长,其中在pH为5~10的范围内,该菌都有不同程度的发光,初始pH为8时发光最优.同时,细菌L2在弱碱环境中比在弱酸环境中发光更强,而强碱(pH≥10)和强酸(pH≤4)都会严重影响细菌L2的发光特性,这可能是偏酸或偏碱环境会严重影响细菌的生长.
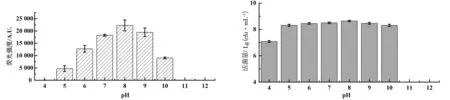
(a)荧光强度变化情况 (b)细菌生长变化情况图7 不同初始pH下L2菌株发光强度及细菌生长变化情况
3 讨论
发光细菌的发光本质是由于细菌含有荧光素酶,该酶被氧化催化后发生复杂的化学反应从而发出一种波长约为450~490 nm的可见荧光.从20世纪开始,关于细菌发光强度的判定主要是以肉眼观察到的结果为依据,因此,具有较强的主观性,会影响实验结果的准确性.后来,出现了专业的测光仪,对发光强度的测定有了更可靠的依据.吴伟等[21]就采用DXY-1型生物发光光度计进行测定,刘彩琴等人[22]的研究中使用了F96荧光分光光度计,从而可计算发光细菌的相对发光强度,使结果更准确.本研究采用更为先进的荧光/化学发光分析仪检测细菌的发光强度,并利用专业分析软件对荧光强度进行定量分析,该方法操作简便、快捷、准确,这为今后细菌发光强度的定量分析及检测开辟了新的途径.
海洋发光细菌对环境pH的变化较为敏感,其生长和发光的pH范围通常在6~8.5之间.本研究中分离到的菌株L2,可以在pH4~10的环境中生长,其中,发光范围在5~10之间,在应用的环境中对酸碱的耐受范围更广.相对于弱酸环境(pH5)来说,该菌在强碱环境(pH10)中有更好的发光特性,这可能与其自然状态下的生境有关.海水的pH一般在7.5~8.3之间,说明该菌的发光特性与自然条件基本符合.
杜宗军等[23]从青岛海洋沉积物中分离得到的一株海洋发光细菌,该菌能在氯化钠浓度为0.5%~5%的条件下生长和发光.许鸿章等[24]发现,有的海洋细菌可以在氯化钠浓度高达7.5%的培养基中生长,但是其最适生长和发光的氯化钠浓度为3%.本研究中分离到的菌株L2,在氯化钠浓度为0~8%的培养基中均能生长,其中发光范围在1%~7%之间,在氯化钠浓度为4%时,发光强度值达到最大,这说明该菌株具有范围更广的耐盐性,可应用于一些高盐度环境中的毒性监测,如监测盐碱地中的环境毒性以及海水养殖中的生物毒性等.
