施铁对泰来草幼苗生长及环境铁含量的影响
2020-11-06赵牧秋秦福广陈文滢陈棣凯韩秋影史云峰
赵牧秋,王 慧,王 帅,秦福广,陈文滢,陈棣凯,韩秋影,史云峰
(海南热带海洋学院 a.热带海洋生物资源利用与保护教育部重点实验室;b.海南省现代化海洋牧场工程研究中心;c.生态环境学院,海南 三亚 572022)
0 引言
在所有被子植物中,只有大约0.02%能够进行海洋沉水生活并在海水中完成种子萌发、幼苗生长、开花结果等生命历程,这部分高等植物被称为“海草”[1].全世界共有6科13属74种海草[2],在我国海域迄今已发现4科10属22种[3].海草通常在沿海浅水及潮间带区域形成植被茂密的海草床.虽然全球海草床的分布面积不足海洋总面积的0.05%,但由于其是一种初级生产力极高的生态系统,因此具有非常重要的生态功能和服务价值[4].不幸的是,在人类活动和全球气候变化的共同影响下,海草床的衰退速率超过了地球上大部分的生态系统:1993年到2003年间,全世界约2.6×104km2的海草床消失;在过去的20年里,全球丧失了约18%的海草床;当前海草床的消失速度是热带森林的2~15倍,且衰退速度还在加快[5].
铁(Fe)是植物合成多种酶和细胞色素所必需的元素,其对于海洋植物生长限制的“临界浓度”尤为重要[6].通常淡水植物体内Fe含量超过3.0×103mg·kg-1,而被子植物维持生长时叶片的最低Fe含量为100 mg·kg-1[7]131.在热带海草床中,沉积物中Fe的含量一般低于200 mg·kg-1,且大多数被碳酸盐束缚而不能被海草利用;加上缺少陆源Fe输入,海草生长很容易受到Fe限制[8].研究表明,生长于碳酸盐沉积物中的海草,其净增长量与Fe的输入成正相关,当Fe的输入低于43 mg·m-2·d-1时,海草床就会有衰退的风险[9].施Fe对海草的生长能起到显著的促进作用,比如添加Fe可使大洋波喜荡草(PosidoniaOceanica)叶片的生产力提高55%[10]721.另有研究表明,Fe可提高海草碱性磷酸酶活性,促进海草对磷(P)素的吸收利用[11]462.
泰来草(ThalassiaHemprichii)主要分布于热带西太平洋-印度洋海区,同时也是海南岛周围海区以珊瑚碎屑为主的碳酸盐沉积物上的优势种[12-13].同世界上其他海草床一样,在水体富营养化、过度捕捞、海洋污染、生境破坏等因素的干扰下,泰来草床也面临着快速衰退的困境.因此,人们已经尝试通过多种方式恢复正在衰退的海草床[14].在泰来草床生态修复和种群恢复的过程中,幼苗期是其单株存活和种群扩展的决定性阶段,也是其生活史中非常关键和非常敏感的时期,在这个时期植物个体对生态因子的变化非常敏感,个体损失率非常高,从而制约了海草床规模化修复工作的开展[15].而广泛分布于碳酸盐沉积物上的泰来草,其幼苗是否同母株一样受到Fe缺乏的胁迫,外源施Fe是否能有效提升泰来草幼苗的成活率和生长状况,这些问题至今为止尚未通过实验的验证.
鉴于此,本研究采用室内模拟实验,探讨了不同外源施Fe量对泰来草幼苗生长速度、叶绿素含量及植株Fe含量的影响,同时探讨了施Fe对泰来草幼苗栽培系统海水及沉积物Fe含量的影响,以期为Fe肥在泰来草幼苗培育及海草床生态恢复中的应用提供依据.
1材料与方法
1.1 泰来草幼苗的获取
成熟的泰来草果实采集于三亚情人湾海区.果实采集后置于盛有天然海水的容器中,一般会在24 h内开裂并释放出泰来草种子.在聚乙烯塑料育苗容器底部置入厚5 mm的细沙(粒径<2 mm),将收集的泰来草种子子叶端朝上,一半埋入沙中.容器内充入海水,水面距沙上表面5~10 cm.水体持续充气,每3天换水1/2.育苗容器置于温室内并覆盖双层遮阳网以免暴晒,保持水温不高于30 ℃,盐度32~35 psu.培养7天后,泰来草幼苗平均叶长达到2 cm,根长1.4 cm,可用于进行下一步实验.
1.2 泰来草幼苗施Fe栽培实验
本实验所用沉积物为采自三亚情人湾泰来草分布区的沉积物,CaCO3含量58.2%,全Fe含量3.53×102mg·kg-1,属典型碳酸盐沉积物.沉积物采回实验室后,日光暴晒消毒,过1 mm孔径筛.取10 kg沉积物,置于38 cm×26 cm×20 cm(长×宽×高)塑料箱中,厚度约5 cm.取6株健康泰来草幼苗,将幼根栽入沉积物中,幼叶露出.向箱中加入10 L不同Fe含量的海水后,将培养箱置于日光温室内培养.
本研究按照海水中Fe添加量,共设5个处理:CK(仅添加天然海水,含Fe量16 μg·L-1,不施Fe)、Fe-2.5(海水按2.5 mg·L-1添加Fe)、Fe-5(海水按5 mg·L-1添加Fe)、Fe-10(海水按10 mg·L-1添加Fe)、Fe-20(海水中按20 mg·L-1添加Fe).Fe均以七水硫酸亚铁(FeSO4·7H2O)形式加入,每个处理重复3次.
通过设置遮阳网的厚度调整温室内光合有效辐射不高于2.0×102μmol·m-2·s-1;通过风机-水幕系统调整栽培系统海水最高温度不高于30 ℃;培养过程海水盐度控制在32~35 psu范围.培养开始时,按照10 g·m-2施入控释肥料(N含量15%,P含量9%,释放期90天).整个培养期内持续鼓泡充气.栽培实验共持续30 d.
分别于培养开始后的6,12,18,24 d,从各塑料栽培箱中取出5 L海水,并回补同样体积的施Fe天然海水,海水的Fe添加量与各处理要求的Fe添加量一致.
1.3 测定指标与方法
栽培实验的最后5 d,每个处理随机选择5株泰来草幼苗,采用针孔标记法[16]测定各处理海草幼苗的生长速度.栽培实验结束后,每个处理随机选择5株泰来草幼苗,测定其株高及叶片叶绿素含量[17].另每个处理随机取5株海草,分割为地上和地下两部分,65 ℃烘干过夜并测定其Fe含量.
实验结束后,分别应用邻菲罗啉比色法[18]测定每个栽培箱上覆海水和间隙水中Fe含量;应用HCl提取法[19]测定沉积物活性Fe含量;应用HNO3-HF-HClO4消解法[20]提取并测定沉积物全Fe含量.
1.4 数据处理与分析
用Excel 2016及SPSS 22.0对所测数据进行分析;采用One-Way ANOVA比较泰来草生长指标、叶绿素含量、Fe含量,以及海水、沉积物Fe含量的差异..
2 结果与分析
2.1 施Fe对泰来草幼苗的影响
如图1(A)所示,泰来草幼苗施Fe栽培实验结束时,CK处理泰来草幼苗平均株高仅为(4.10±0.27) cm.各施Fe处理泰来草幼苗平均株高达到(6.58±1.08) cm,均显著(P<0.05)高于CK处理,但各施Fe处理之间泰来草幼苗株高无显著性(P<0.05)差异.栽培实验结束的前5 d内,CK处理泰来草幼苗的生长速度为(11.0±2.2) mm·d-1[如图1(B)].各施Fe处理泰来草幼苗的生长速率均显著(P<0.05)高于CK,且随Fe添加量的增加而加快,Fe-2.5、Fe-5、Fe-10和Fe-20处理泰来草的生长速率分别较CK处理增加41.5%、63.6%、80.7%和92.7%.
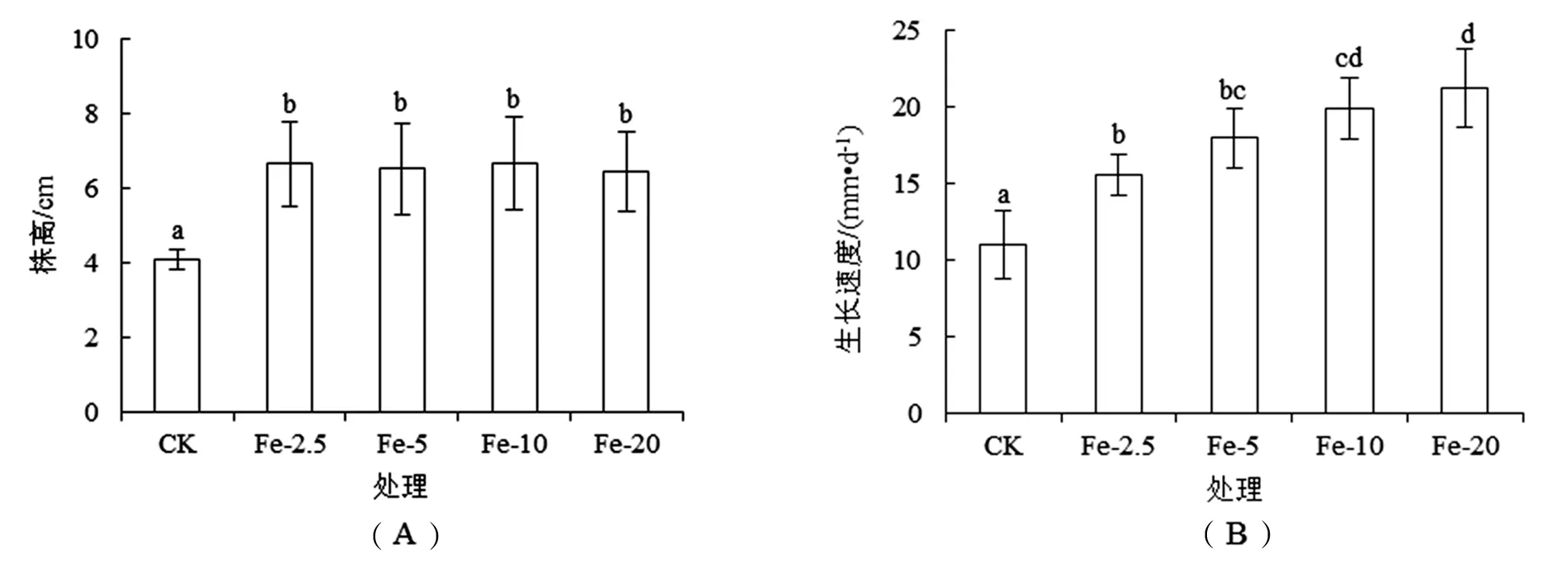
图1 施Fe对泰来草幼苗株高(A)和生长速度(B)的影响
CK处理泰来草幼苗叶绿素a含量较低,仅为(1.64±0.32) mg·g-1;随施Fe量的增加,幼苗叶绿素a含量随之升高[图2(A)],Fe添加量高于2.5 mg·g-1,各处理(Fe-5、Fe-10和Fe-20)泰来草幼苗叶绿素a含量均显著(P<0.05)高于CK.施Fe对泰来草幼苗叶绿素b含量无影响[图2(B)].

图2 施Fe对泰来草幼苗叶绿素a(A)和叶绿素b(B)含量的影响
CK处理泰来草幼苗地上部分Fe含量为(7.07×102±1.35×102) mg·kg-1[图3(A)].随Fe添加量的增加,幼苗地上部分Fe含量呈增加趋势,并均显著(P<0.05)高于CK.施Fe对泰来草地下部分Fe含量基本无影响[图3(B)].
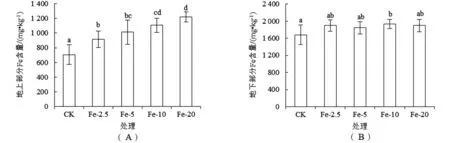
图3 施Fe对泰来草幼苗地上部分(A)和地下部分(B)Fe含量的影响
2.2 施Fe对栽培环境Fe含量的影响
泰来草幼苗栽培系统上覆水和间隙水Fe含量均较低[图4(A)、[图4(B)],各处理平均仅为(59.4±18.0) μg·L-1和(1.13×102±18.9) μg·L-1.对于上覆水,仅Fe-2.5和Fe-5处理Fe含量显著(P<0.05)高于CK;对于间隙水,仅Fe-5处理Fe含量显著(P<0.05)高于CK.

图4 施Fe对泰来草幼苗栽培系统上覆水(A)和间隙水(B)Fe含量的影响
沉积物活性Fe含量及全Fe含量均随Fe添加量的增加而升高[图5(A)、[图5(B)].Fe-2.5、Fe-5、Fe-10、Fe-20处理沉积物活性Fe含量较CK处理分别高出0.51、0.96、1.29、1.42倍;全Fe含量较CK处理分别高出0.24、0.41、0.77、1.45倍.
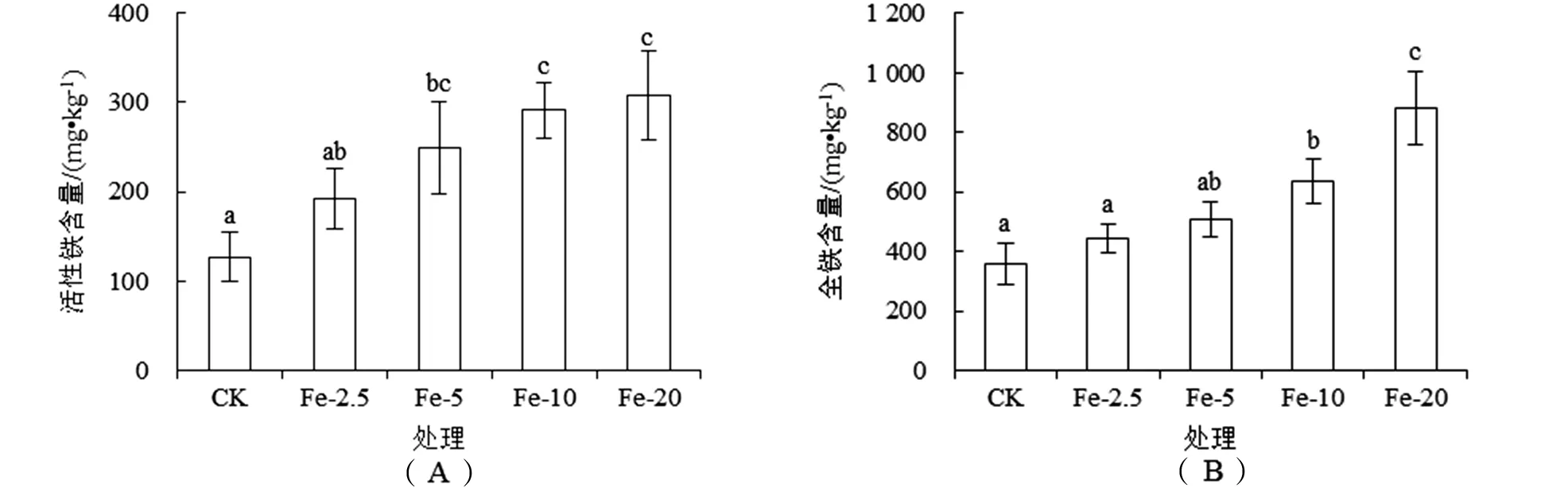
图5 施Fe对泰来草幼苗栽培系统沉积物活性Fe(A)和全Fe(B)含量的影响
2.3 沉积物Fe含量与泰来草幼苗生长及Fe含量的相关关系
对沉积物活性Fe和全Fe含量与泰来草幼苗生长速度、叶绿素a含量及地上部分Fe含量进行相关关系分析,结果[图6(A)~[图6(F)])表明:沉积物活性Fe含量与泰来草幼苗生长速度、叶绿素a含量及地上部分Fe含量具有极显著相关关系(P<0.01,R2分别为0.989、0.972、0.975,n=5);沉积物全Fe含量与泰来草幼苗生长速度、叶绿素a含量及地上部分Fe含量具有显著相关关系(P<0.05,R2分别为0.772、0.772、0.853,n=5).
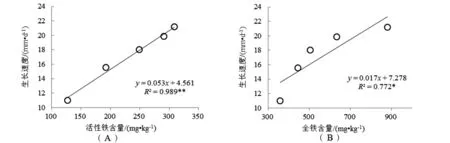
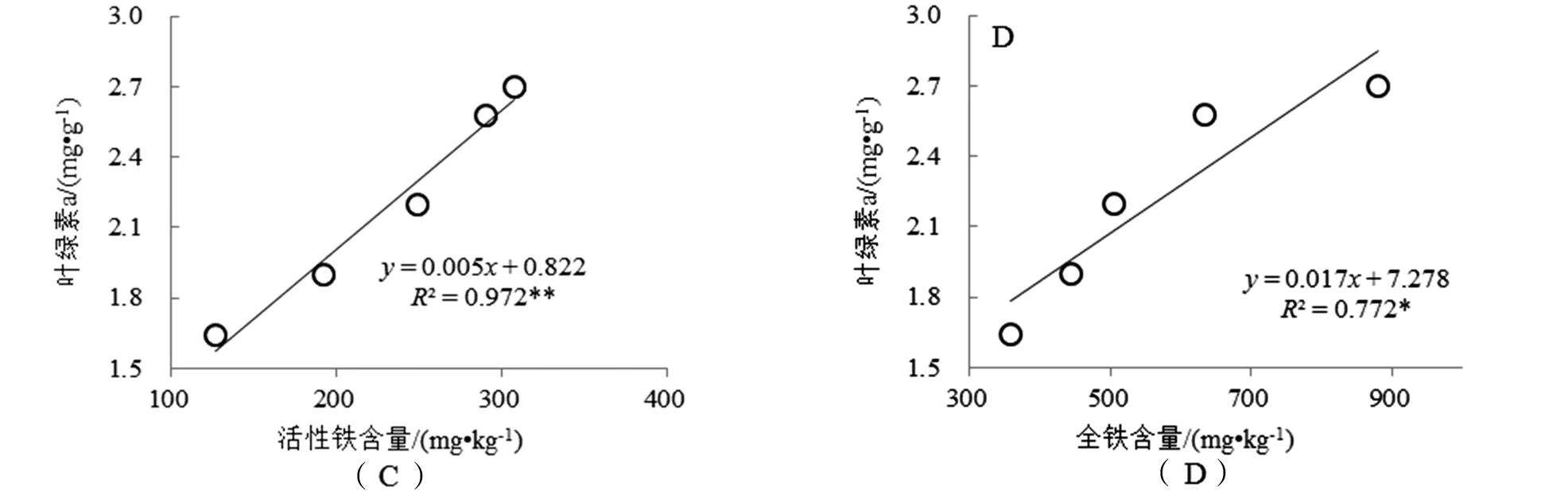

图6 沉积物活性Fe和全Fe含量与泰来草幼苗生长速度、叶绿素a含量及地上部分Fe含量的相关关系注:*代表显著相关(P<0.05),**代表极显著相关(P<0.01).
3 讨论
Fe元素是植物生长必不可少的中微量元素之一,对于海洋中营沉水生活的唯一高等植物海草亦不例外.大量研究均表明,在海草床中添加Fe能够显著改善海草的生长状况.比如,Duarte等[21]向沉积物中添加4 g·m-2的Fe元素,发现施Fe可使泰来草叶片生长速率提升约30%,由此作者认为Fe是限制海草生长的关键营养元素之一.Holmer等[10]723研究发现,Fe元素对于位于地中海的大洋波喜荡草是一个限制性营养因子,添加Fe对海草的生长和沉积物中活性Fe的含量均起到提升作用.本研究的结果也表明,向泰来草幼苗生长系统中添加一定量的Fe元素,可有效提升其株高,促进其叶片生长.
向泰来草幼苗栽培系统中添加Fe元素能够促进海草幼苗生长的原因可能有如下几点.其一,施Fe消除了碳酸盐沉积物导致的Fe限制.本研究中不添加Fe的CK处理泰来草幼苗地上部分Fe元素含量为(7.07×102±1.35×102) mg·kg-1,远低于一般水生植物Fe元素含量(3.17×103mg·kg-1)[7]132,且泰来草幼苗叶片Fe含量随施Fe量的增加而升高,都能够说明本研究设定的对照(CK处理)环境是一种泰来草生长受Fe限制的环境,且随Fe添加量的增加,这种限制作用逐渐消除.其二,在植物的光合作用中,Fe作为一种必要元素在特定的蛋白质和酶中起着运载电子的作用[22].施Fe提升了海草幼苗叶片叶绿素a含量[图2(a)],增强了海草叶片的光合作用效率,进而促进植株生长.其三,施Fe可能促进海草对P元素的吸收.由于在碳酸盐沉积物环境中,活性P可形成磷灰石而沉淀,同时易被Fe(III)的氢氧化物强烈吸附,因此海草的生长往往受到Fe和P的双重限制[23].但也有研究表明沉积物中的Fe可促进泰来草、海菖蒲(EnhalusAcoroides)及圆叶丝粉草(CymodoceaRotundata)对P的吸收,而沉积物中的P也明显促进上述海草对Fe的吸收[7]133,[11]463.其四,已有研究表明,当沉积物间隙水中H2S含量超过10 μmol·L-1时,就会引起海草床的衰退[24].Fe2+能与S2-反应形成难溶的FeS,因此施Fe能够有效降低硫化物对海草幼苗的毒害作用,进而促进海草幼苗生长.
海草可通过多个部位、多种形式吸收生长所需的矿质养分,并可同时通过根和叶分别从沉积物间隙水和上覆水中获得生长所需矿质元素.但由于沉积物间隙水中的养分含量往往高于上覆水,所以通常认为沉积物是海草体内营养物质的主要来源[25].但也有学者认为海草主要通过叶片从海水中获取金属类矿质元素,比如Whelan等[26]对泰来草各组织和沉积物中的Fe含量进行了相关分析,结果显示各相关系数均为负值,表明海草对这些金属元素的吸收是通过海水而不是沉积物;Schlacher-Hoenlinger等[27]认为,大洋波喜荡草主要通过叶片从海水中获得金属元素,而金属元素在海草各组织及其附着植物中的含量是沉积物的10多倍;而Xu等[28]则通过海草组织分隔供Fe实验,直接证实了鳗草(ZosteraMarina)主要是通过叶片从周围水体中吸收Fe元素.在本研究中,向泰来草幼苗栽培系统添加Fe元素,并未有效提高海草地下部分Fe含量[图3(b)],而幼苗地上部Fe含量却随Fe元素添加量的增加而升高,这也进一步间接证实了上述结论.
