高亲和力重组人硫氧还蛋白还原酶的原核表达、纯化和初步活性鉴定
2020-11-04朱弋宝范庆祝吕晓梅赵文英刘晓平
朱弋宝,范庆祝,吕晓梅,张 超,赵文英,刘晓平
(1.皖南医学院 药物筛选与评价研究所,安徽 芜湖 241002;2.皖南医学院第一附属医院 弋矶山医院 肿瘤科,安徽 芜湖 241001)
硫氧还蛋白还原酶(thioredoxin reductase,TrxR)是目前研究发现唯一能还原细胞中硫氧还蛋白(Thioredoxin,Trx)的酶,同时也是重要的活性氧自由基(reactive oxygen species,ROS)清除酶。TrxR在调节细胞内氧化还原稳态中起重要作用,可保护肿瘤细胞免受ROS蓄积所导致的细胞死亡。TrxR因其碳端有一个pKa值较低的Sec活性位点,很容易与亲电试剂发生反应。当TrxR被结合修饰后,可以诱导细胞发生凋亡反应。因此,TrxR有很大潜力成为抗肿瘤药物开发的靶点。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株 pET-TRSTER质粒由Elias Arnér教授馈赠(Addgene plasmid # 78865;http://n2t.net/addgene:78865;RRID:Addgene_78865);大肠埃希菌E.coli Rosetta(DE3)感受态细胞购自General Biosystems公司。
1.1.2 主要试剂与仪器 重组人TrxR-ΔC蛋白(AA.151-647,删除 C端硒半胱氨酸)由本实验室构建并表达纯化;BCA蛋白浓度测定试剂盒(美国Thermo公司);大鼠肝脏提取TrxR蛋白(Sigma-Aldrich公司);硫氧还蛋白还原酶抑制剂金诺芬(Auranofin)(美国MCE公司);2′5′-ADP琼脂糖凝胶(2′,5′-ADP Sepharose 4B)、AKTA Pure 5M(瑞典GE公司);电泳仪、小型垂直电泳槽(Bio-Rad公司)。
1.2 方法
1.2.1 pET-TRSTER质粒的转化和克隆 将pET-TRSTER重组质粒转化至E.coli Rosetta BL21(DE3)感受态细胞中,涂布至LB 固体培基(含50 μg/mL Kanamycin),37 ℃ 过夜培养。挑选出大小合适的单克隆菌落,加入至5 mL LB液体培养基(含50 μg/mL卡那霉素),37℃,220 r/min,扩菌。
1.2.2 TrxR重组蛋白的诱导温度与时间的优化 将表达菌接种于5 mL LB 液体培养基(含50 μg/mL Kanamycin)中,设置诱导温度为37℃,以0.05 mmol/L IPTG 分别诱导不同时间点。在每个时间点收集等量的菌体,以10% SDS-PAGE进行凝胶电泳,观察TrxR重组蛋白的表达量。将诱导温度设置为25℃,重复上述操作。
1.2.3 TrxR重组蛋白的可溶性分析 破菌裂解液重悬菌体,置于冰水混合物中。超声破碎30 min,至菌液澄清。10 000 r/min,4℃离心,分别留取上清液和沉淀,制作样品,10% SDS-PAGE凝胶电泳,考马斯亮蓝染色。观察沉淀和上清液中目的蛋白的含量。
1.2.4 TrxR重组蛋白的纯化和鉴定 将破碎完的菌液10 000 r/min,4℃ 离心10 min,0.22 μm滤过膜滤过。用AKTApurifier蛋白纯化系统纯化蛋白,梯度浓度的氯化钠溶液(起始浓度为100 mmol/L NaCl)洗脱。10% SDS-PAGE凝胶电泳,选出最佳洗脱浓度。
1.2.5 TrxR重组蛋白的活性分析 用DNTB法[1]检测TrxR重组蛋白、天然鼠肝TrxR蛋白和TrxR-ΔC蛋白3种蛋白的蛋白活性。对应加入不同浓度的药物和NADPH预还原的蛋白于孔板中,在室温下孵育,加入配制好的DNTB和NADPH混合液,立即测定412 nm处的吸光度。
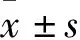
2 结果
2.1 TrxR重组蛋白的最佳诱导温度与时间 表达菌经不同诱导温度和时间培养后,离心收集等量菌液,用10% SDS-PAGE 和Clinx Image Analysis 软件分析TrxR重组蛋白表达量。实验结果表明,诱导温度为37 ℃时,目的蛋白的诱导效果不明显(图1A);诱导温度为25 ℃时,14 h时TrxR重组蛋白表达量约为23.48%并趋于稳定,考虑IPTG长时间诱导,对表达菌有一定的毒性作用,从而选择14 h为最佳诱导时间(图1B)。可见,TrxR重组蛋白的最佳诱导温度为25 ℃,最佳诱导时间为14 h。
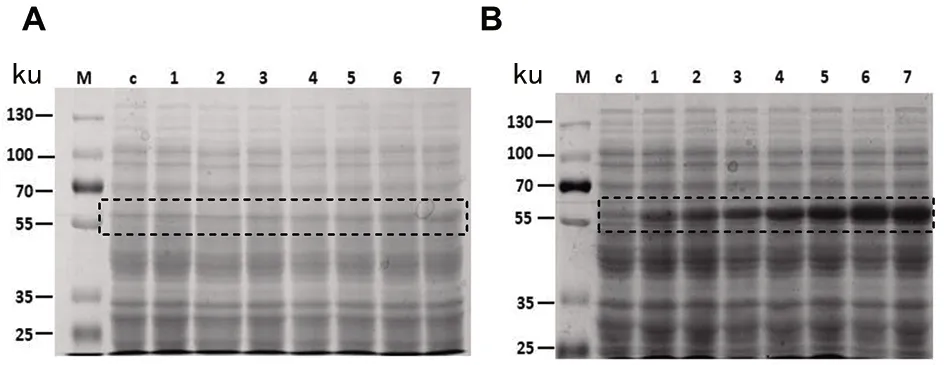
A:诱导温度 37℃;B:诱导温度25℃;M:蛋白Maker;C:对照;1~7:诱导时长:0 h、6 h、8 h、10 h、12 h、14 h、16 h。
2.2 TrxR重组蛋白的可溶性分析 破碎诱导不同时间后的菌体,通过SDS-PAGE凝胶电泳,观察上清液与沉淀中的目的蛋白的含量,比较不同诱导时间后的上清溶液中TrxR蛋白的含量差异。结果显示:3个时间点的目的蛋白大部分存在于上清液中,且上清液中的目的蛋白表达量基本相同(图2)。
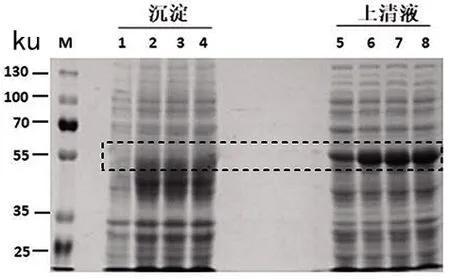
M:蛋白Maker;1:沉淀对照;2:12 h 沉淀;3:14 h 沉淀;4:16 h沉淀;5:上清液对照;6:12 h 上清液;7:14 h上清液;8:16 h 上清液。
2.3 TrxR蛋白的纯化与鉴定 应用亲和层析的方法,使用上样缓冲液(10 mmol/L Tris-HCl,1 mmol/L EDTA,pH=8.0,A液)和1 mol/L氯化钠盐溶液(B液)混合进行梯度洗脱,得到目的蛋白,并用10% SDS-PAGE凝胶电泳进行纯化后的蛋白纯度分析(图3)。当混合洗脱液中的B液浓度由10%升至30%和50%升至70%时出现两个洗脱峰,经由SDS-PAGE验证发现,两个洗脱峰均为TrxR蛋白。而50%~70%洗脱峰收集的蛋白浓度远大于10%~30%洗脱峰所收集蛋白。我们推测可能是目的蛋白表达量大,超过柱载量上限,所以部分目的蛋白和柱子结合不牢,在含低浓度氯化钠的洗脱液中被洗涤下来,导致出现10%~30%处的洗脱峰,综上确定最佳混合洗脱液为含有50%~70%的B液。运用BCA蛋白定量法测定纯化的TrxR重组蛋白浓度为3.2 g/mL。

M:蛋白Maker;1:流穿峰;2~10:混合洗脱液中含有1 mol/L氯化钠溶液的终浓度分别为20 %、30%、40%、50%、60%、70%、80%、90%、100%。
2.4 3种蛋白的活性比较 结果显示,当测量时间为30 s时,3种蛋白之间差异无统计学意义(P>0.05)。当测量时间为60 s和90 s时,TrxR和pET-TRSTER之间差异无统计学意义(P>0.05),但均高于 TrxR-ΔC的吸光度(P<0.05)。其他8个测量时间点,TrxR的吸光度>pET-TRSTER>TrxR-ΔC(P<0.05)。见表1。
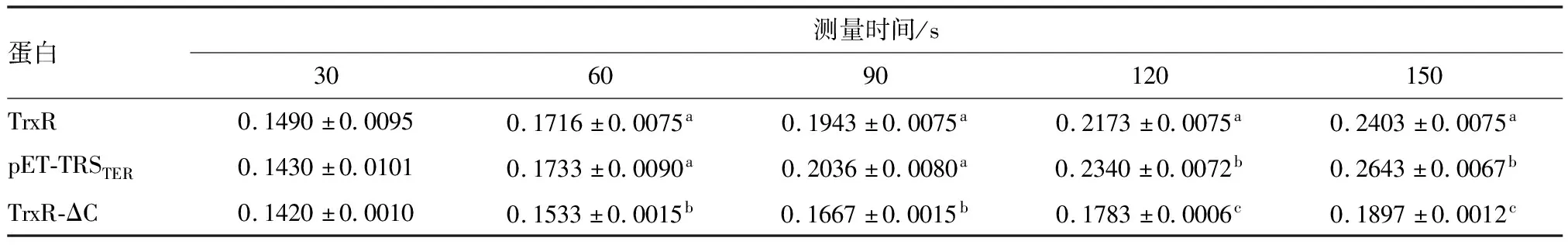
表1 3种蛋白活性的吸光度比较(n=3)
2.5 金诺芬对3种蛋白的活性抑制效果 结果显示,TrxR和pET-TRSTER当抑制剂浓度>0.0049 μmol/mL时蛋白的抑制率差异无统计学意义(P>0.05),但在0.0049 μmol/mL之后蛋白活性抑制率均低于0.019 50~5.000 00浓度(P<0.05);0.000 004 77~0.001 221抑制剂浓度的蛋白活性低于0.0049浓度(P<0.05);0.000 004 77~0.000 305抑制剂浓度的蛋白活性低于0.001 221浓度(P<0.05);0.000 004 77~0.000 076 3抑制剂浓度的蛋白活性低于0.000 305浓度(P<0.05),但0.000 004 77~0.000 076 3浓度之间无统计学意义(P>0.05)。TrxR-ΔC蛋白在抑制剂浓度0.000 004 77 μmol/mL的活性低于其他10个浓度(P<0.05);0.000 019 1抑制剂浓度的蛋白活性低于5.000 00浓度(P<0.05);其他不同抑制剂浓度的蛋白活性之间差异无统计学意义(P>0.05)。见表2。
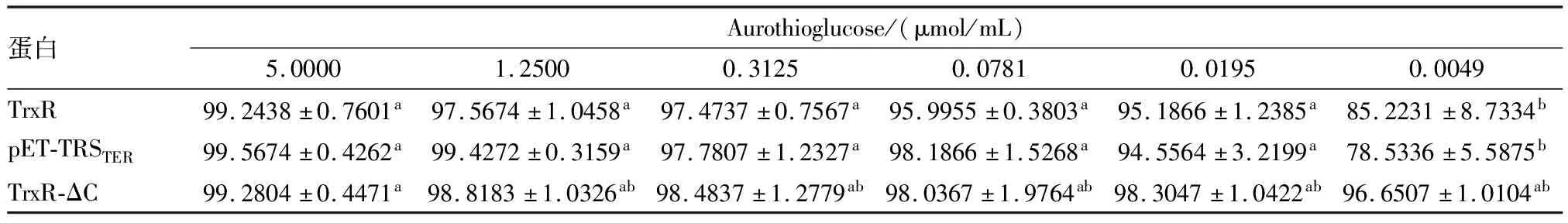
表2 金诺芬对3种蛋白的活性抑制效果(n=3)
3 讨论
癌症在我国已成为人们十分关注的公共卫生问题。随着人口老龄化的逐步加剧,癌症带来的社会负担也在逐步加重[2],肿瘤防治已成为社会发展不得不面对的重要问题。
肿瘤细胞因代谢紊乱而导致内源性活性氧水平升高[3]。增加的活性氧水平可能与肿瘤细胞的氧化还原能力增强和肿瘤抑制功能的丧失有关[4-5]。据文献报道,活性氧在肿瘤的长期进展中起着关键作用,它通过调节不同的信号通路,促进肿瘤的增殖,导致癌症恶化[6]。肿瘤细胞通过上调氧化还原通路的方式逃避由活性氧升高而产生的细胞毒性作用,以此来维持细胞活性[7]。
硫氧还蛋白(Trx)系统是细胞主要的氧化还原系统之一。硫氧还蛋白还原酶(TrxR)作为一种重要的ROS清除酶,保护癌细胞免受大量ROS引起的细胞凋亡[8]。硫氧还蛋白(Trx)的家族有三种酶:硫氧还蛋白(Trx)、硫氧还蛋白还原酶(TrxR)以及还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH),它们是细胞氧化应激反应调控的重要组成部分[9]。TrxR在细胞中广泛表达[10],根据分布区域的不同而被分为3种同工酶[11]。最早发现的是TrxR1,也是目前为止研究最多的一种同工酶。据文献报道,肿瘤细胞中TrxR1呈高表达状态,且是肿瘤细胞维持细胞活性不可或缺的酶[12-13]。在哺乳动物中硫氧还蛋白还原酶(TrxR)的碳末端倒数第二位具有一个活性尾巴——硒半胱氨酸(Sec)的含硒氨基酸[14]。大量研究表明,具有活性的突出于酶表面的碳端C尾,在肿瘤发生发展中具有重要作用。
由于诱导温度和时间是原核表达系统表达外源基因效率的重要影响因素[15],本实验通过摸索诱导温度和时间来提高目的蛋白的表达产量。纯化出的目的蛋白可溶性良好,表达效率较高。蛋白活性检测表明其纯化且蛋白活性较好。TrxR活性抑制实验表明C端含硒半胱氨酸是TrxR蛋白发挥活性的必须氨基酸。
综上所述,C端含硒半胱氨酸是TrxR发挥蛋白活性不可或缺的部分。同时应用原核表达系统以低廉高效的方式纯化出比天然TrxR蛋白活性更好的TrxR重组蛋白,为后续TrxR蛋白抑制药物的广谱筛选提供了一定的基础。
