纳滤法制备高纯度雪莲果低聚果糖及其结构表征
2020-10-10曲晓萌张泽浩
曲晓萌, 杨 革, 张泽浩, 张 兰
(1.山东省济宁卫生学校,山东 济宁 272000; 2.曲阜师范大学 生命科学学院,山东 曲阜 273165;3.山东第一医科大学,山东 泰安 271000; 4.牡丹江医学院,黑龙江 牡丹江 157011)
雪莲果(Smallanthussonchifolius) 别名亚贡、菊薯,为菊科多年生草本植物[1-3],原产于安第斯山脉,是一种缓解糖尿病、肠道功能紊乱等多种慢性疾病的药食两用植物。近年在我国引种成功,目前部分省份已大面积种植[4]。低聚果糖由于具有独特的生理功能、优良的理化性质及良好的食品加工特性,在食品、保健品及医药等领域得到了广泛应用[5-7]。低聚果糖的传统生产方法是以蔗糖或菊糖为底物,通过酶法生产[8-11],其产率不高,副产物较多,反应条件不易控制,生产成本较高。因此,寻找新的低聚果糖的提取原料具有重要的实践意义。雪莲果块茎中的低聚果糖占干质量的40%~60%,且聚合度较低(平均聚合度为4.8),是提取低聚果糖的优良原料[12]。
目前雪莲果低聚果糖的提取分离通常采取水提的方法,得到的低聚果糖产品纯度较低,一般为30%左右[4],主要杂质有色素、蛋白质及相当数量的无机盐小分子物质、多糖以及聚合度较大的果寡糖[13],为了获得蔗果三糖、蔗果四糖、蔗果五糖必须经过进一步分离提纯。对低聚果糖提纯有化学和物理两类方法,化学法主要采用生物酶技术,此方法提纯的产品纯度仅有70%~80%[14],操作复杂且成本高;物理法有高效液相色谱法和膜分离法,其中色谱法可制备90%以上的高纯低聚糖产品,但该技术设备复杂,仅在日本有过报道。纳滤是一种新型的膜分离技术,纳滤的截留分子质量介于反渗透与超滤之间,而且纳滤操作所需压力要比反渗透低得多,试验证明纳滤对蔗果低聚糖体系具有很好的分离提纯效果。化学结构是生物活性物质呈现活性的基础,高分子的一级结构是决定高分子基本性质的主要因素,为活性多糖的结构与效应关系的研究及人工合成活性寡糖提供参考数据。本研究采用二级纳滤技术对提取的雪莲果低聚果糖进行分离纯化,通过中心组合设计及响应面分析,建立了纳滤制备高纯度低聚果糖的数学模型,优化分离纯化工艺,并对分离得到的低聚果糖样品进行含量测定和一级结构分析,以期为低聚果糖的工业制备提供参考,并为雪莲果的精深加工和雪莲果低聚果糖的生物学活性的实践应用提供理论依据。
1 实 验
1.1 材料与仪器
雪莲果块茎由贵州红星发展都匀绿友有限责任公司提供,D-(+)-葡萄糖标准品、蔗果三糖(GF2)、蔗果四糖(GF3)、蔗果五糖(GF4)购自Sigma公司, 实验用水为重蒸水,所用其他试剂均为国产分析纯。
纳米膜分离系统购自上海朗极化工有限公司,膜组件从美国海德能公司购进,101型膜用于分离单糖与二糖,截留相对分子质量≥342,膜面积为2.0 m2;304型膜用于分离多糖,截留相对分子质量≥880,膜面积为2.0 m2。
Agilent 1100高压液相-质谱联用仪,美国Agilent公司;370FT 2IR傅里叶变换红外光谱仪,美国Thermo Niclet公司;Bruker AVANCE- 600超导体超屏蔽傅里叶变换核磁共振波谱仪,瑞士Bruker公司;RID26A示差折光检测器,日本岛津公司。
1.2 雪莲果低聚果糖样品的制备
取雪莲果块茎洗净去皮,迅速放入0.25%抗坏血酸水溶液中护色后高速破碎使之匀浆,去离子水为溶媒以3 ∶1(g ∶mL)的料液比、提取温度为25 ℃、提取时间为60 min的条件采用热水浸提法进行提取,过滤之后的滤渣进行第二次提取。合并提取液,4 000 r/min离心20 min保留上清液,经D101、 D72、 D315树脂层析柱,调整提取液pH值为3,除去色素、黄酮、蛋白等大分子物质。得到的滤液经冷冻干燥后制得雪莲果低聚果糖样品。
1.3 纳滤膜性能的测定
本实验的核心是膜组件的设计,考虑适用性、可操作性和经济性。适用性体现在膜的截留相对分子质量和截留率的大小[15],本研究采用101型与304型纳滤膜二级串联的方式,可以很好滤去相对分子质量超过880的多糖等大分子物质以及相对分子质量低于342的单糖、无机盐等物质,从而得到相对分子质量为342~880的雪莲果低聚果糖。测纯水透过系数的目的是为了利用非平衡模型来检验非平衡热力学模型的实用性及准确性。本实验以101型膜的纯水系数来表征膜组件的稳定性[16]。
纯水系数计算公式:JV=LP△P=V/(S·t)。其中,JV为膜通量,mL/(min·m2),即单位时间内单位面积膜面上滤出渗透液的体积;V为渗透液透过量,mL;S为有效膜面积,m2;t为得到渗透液体积为V的相应时间,min;LP为纯水系数,△P为操作压力差[17]。分别在操作压力为0.19、 0.23、 0.25和0.27 MPa条件下测定膜通量,温度20 ℃,每10 min取一次观测值,历时4 h。
1.4 操作因素对纳滤膜分离性能的影响
1.4.1料液pH值 以pH值分别为1、2、4、6、7、9、11的雪莲果低聚果糖提取液,温度20 ℃,操作压力为0.07 MPa,循环流量为8 mL/min,料液10 g/L,纯化倍数4次,以盐截留率为指标考察pH值对低聚果糖体系的影响。截留率=(1-Cb/Ce)×100%。其中,Cb为透过液盐浓度,mol/L,Ce为原料液盐浓度,mol/L,盐浓度测定采用导电率法[18]。
1.4.2循环流量 调节循环流量分别为5、10、15和20 mL/min,操作压力固定在0.15 MPa,温度20 ℃,测定截留率,以透析液在100 mL处时的截留率为指标考察循环流量对膜分离性能的影响。
1.4.3料液浓度和操作压力 调节低聚果糖溶液质量浓度分别为1、5、10 g/L及相应压力下,在温度20 ℃,循环流量8 mL/min,pH值2,纯化倍数4次条件下考察料液浓度和操作压力对膜分离性能的影响。
1.4.4纯化倍数 实验中料液原始体积为500 mL,在温度20 ℃,操作压力为0.1 MPa,循环流量为8 mL/min,料液10 g/L,pH值为2条件下预浓缩料液至原始体积的一半,测盐截留率与低聚果糖浓度;加水至原始体积,纳滤脱盐至体积为原始体积一半处停止,测其操作时间和截留率;再加水至原始体积,纳滤脱盐,如此反复。
1.5 低聚果糖纳滤纯化的RSM实验设计
以操作压力(Х1)、pH值(Х2)、循环流量(Х3)和纯化倍数(Х4)为因子,溶液中低聚果糖纯度为响应值。在单因素试验的基础上,确定中心组合实验设计的实验方案,通过响应面分析(RSA)方法进行数据的回归分析及显著性检验,以确定低聚果糖纯化的最佳工艺条件。每个试验点重复2次,结果取平均值。
1.6 雪莲果低聚果糖一级结构表征
1.6.1组分含量测定 雪莲果低聚果糖组分含量测定方法如下:将10 g/L样品溶液经HPLC分离,根据峰型判断样品纯度。经二级纳滤纯化的雪莲果低聚果糖样品用蒸馏水溶解后,经0.5 μm微孔膜过滤供HPLC分析用。低聚果糖测定采用HPLC法,色谱条件参照QB/T 2491—2000标准,以峰面积归一化测定蔗果三糖、蔗果四糖、蔗果五糖的纯度[19]。
1.6.2组分分子质量的确定 将样品用重蒸水溶解后,以0.2 μm膜过滤后导入质谱离子源。质谱四极杆温度150 ℃,离子源温度230 ℃,加速电压6 kV,电子能量70 eV,扫描范围20~600 u,分辨率600 bp;以2 ℃/min 从150 ℃梯度升温至195 ℃,持续10 min。
1.6.3组分结构分析 取样品210 mg(KBr压片),在500~4000 cm-1范围内进行红外扫描。取50 mg样品溶于0.5 mL D2O中,于323 K下测定1H NMR谱及13C NMR谱。
2 结果与讨论
2.1 纳滤膜纯水系数的测定
如图1所示,纳滤膜的膜通量随压力的上升而平稳升高[20],应用线性归元法(P<0.01)计算得:JV=0.238△P,线性关系成立,说明该膜组件稳定性、清洁度很好。应用公式计算得出20 ℃时纳滤膜的纯水透过系数为0.238 mL/(min·m2)。
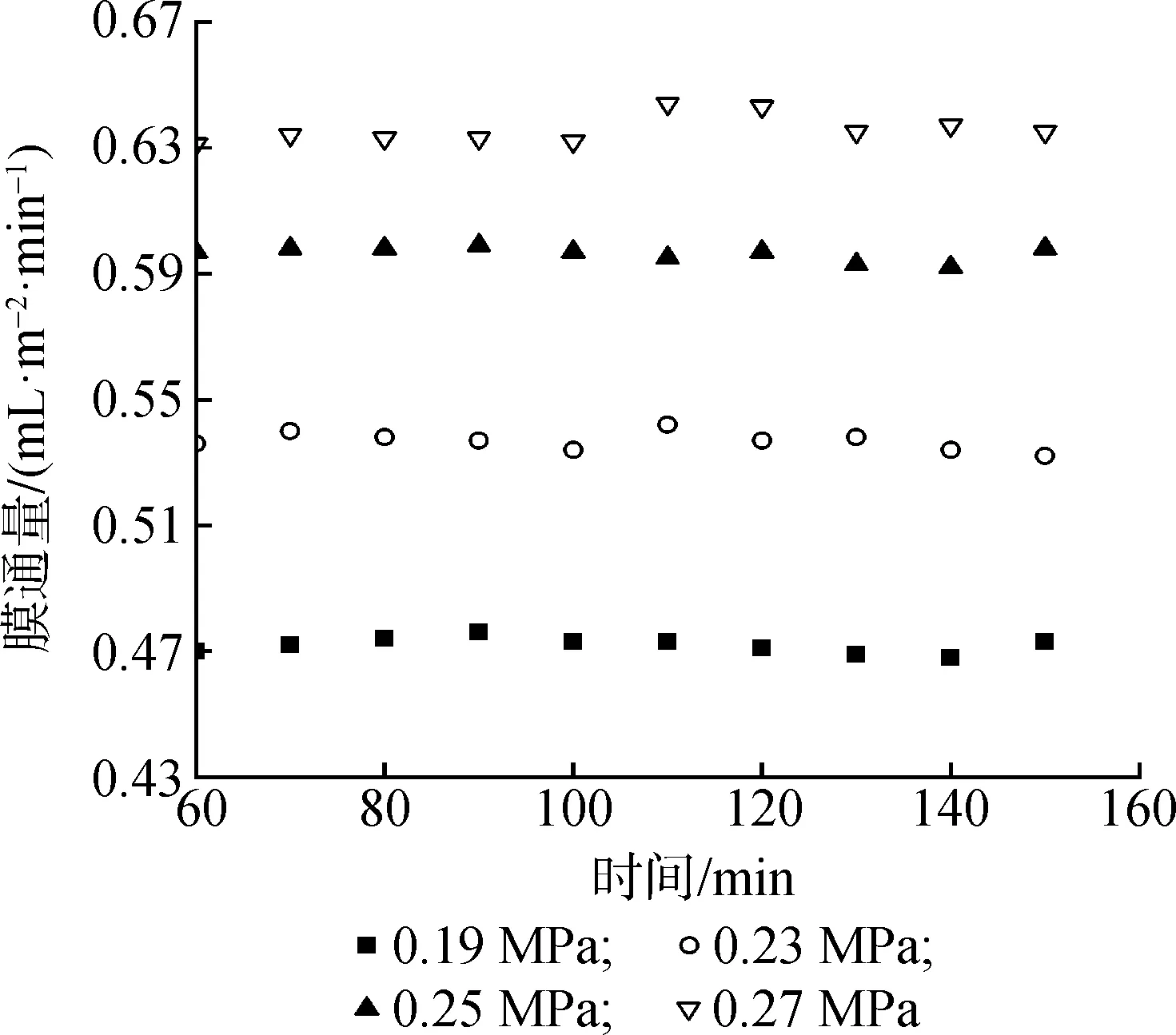
图1 压力对膜通量的影响Fig.1 Influence of pressure on membrane flux
2.2 不同因素对纳滤膜分离性能的影响
2.2.1料液pH值 图2给出了料液不同pH值条件下盐截留率与膜通量的关系。压力相同时,在酸性条件(pH值1~2)下盐截留率随pH值增大而增大。碱性条件下截留率普遍比酸性条件下高[21],随着pH值增大在一定范围内上下波动,表明pH值直接影响糖的分离性能。因此,选择在酸性条件下进行脱盐脱糖实验,可以有效降低单价盐截留率,提高分离效率,强化脱盐脱糖效果。
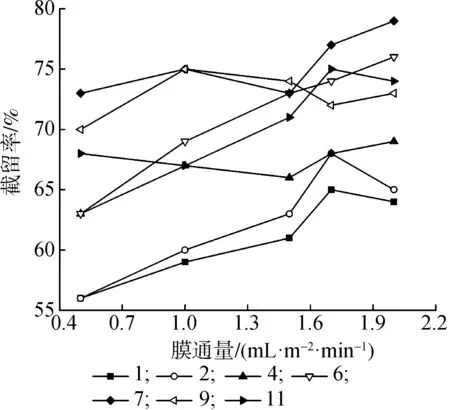
图2 不同pH值下盐截留率随膜通量变化曲线Fig.2 Variation curve of salt rejection rate with membrane flux at different pH values
2.2.2循环流量 由图3可知,盐截留率和膜通量随循环流量增大而增加。根据浓差极化模型理论,循环流量越高,即膜面切向流速越高,传质系数越大,相同操作压差下浓差极化程度越小,膜通量将越高,本研究结果与此相一致。然而就脱盐效果而言,应在保证一定的膜通量下采用较低的循环流量,循环流量在5~10 mL/min之间较适合。
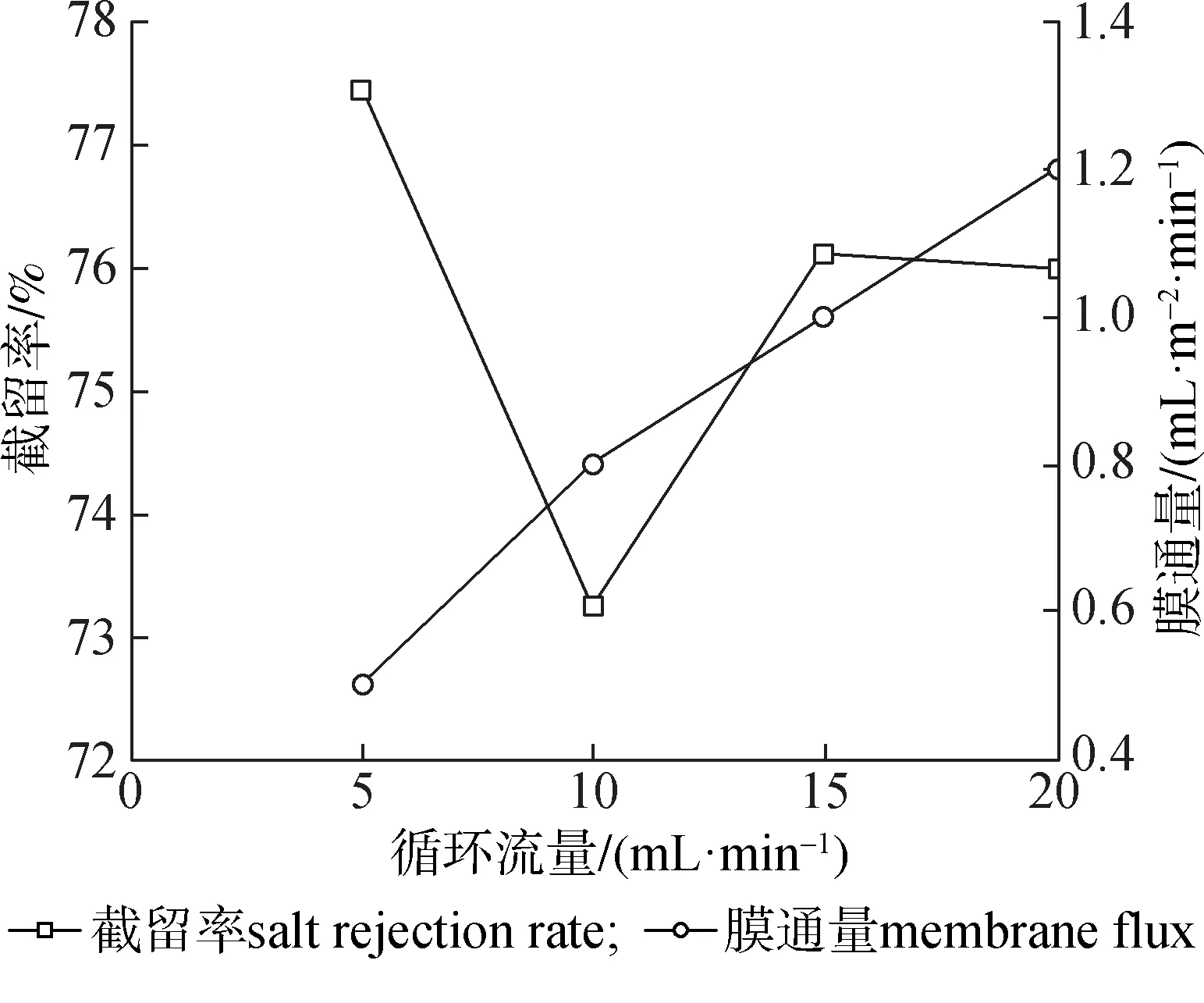
图3 循环流量与盐截留率和膜通量的关系Fig.3 Relationship of circulation flow rate and salt rejection rete as well as membrane flux
2.2.3料液浓度和压力 图4给出了不同质量浓度的低聚果糖料液膜通量随压力变化曲线,相同压力下膜通量随溶液质量浓度的增加而下降。图5为不同质量浓度料液截留率随膜通量变化曲线,相同膜通量下截留率随质量浓度的增加而下降。这是由于随着溶液质量浓度的增加,膜面浓度也增加,膜面浓差极化程度增大,膜孔中的电势亦随之降低, 无机离子受到膜电荷的影响变小,导致截留率降低膜通量下降。所以,在分离体系中适当降低料液浓度使膜的通道变大,会使无机离子更容易通过。
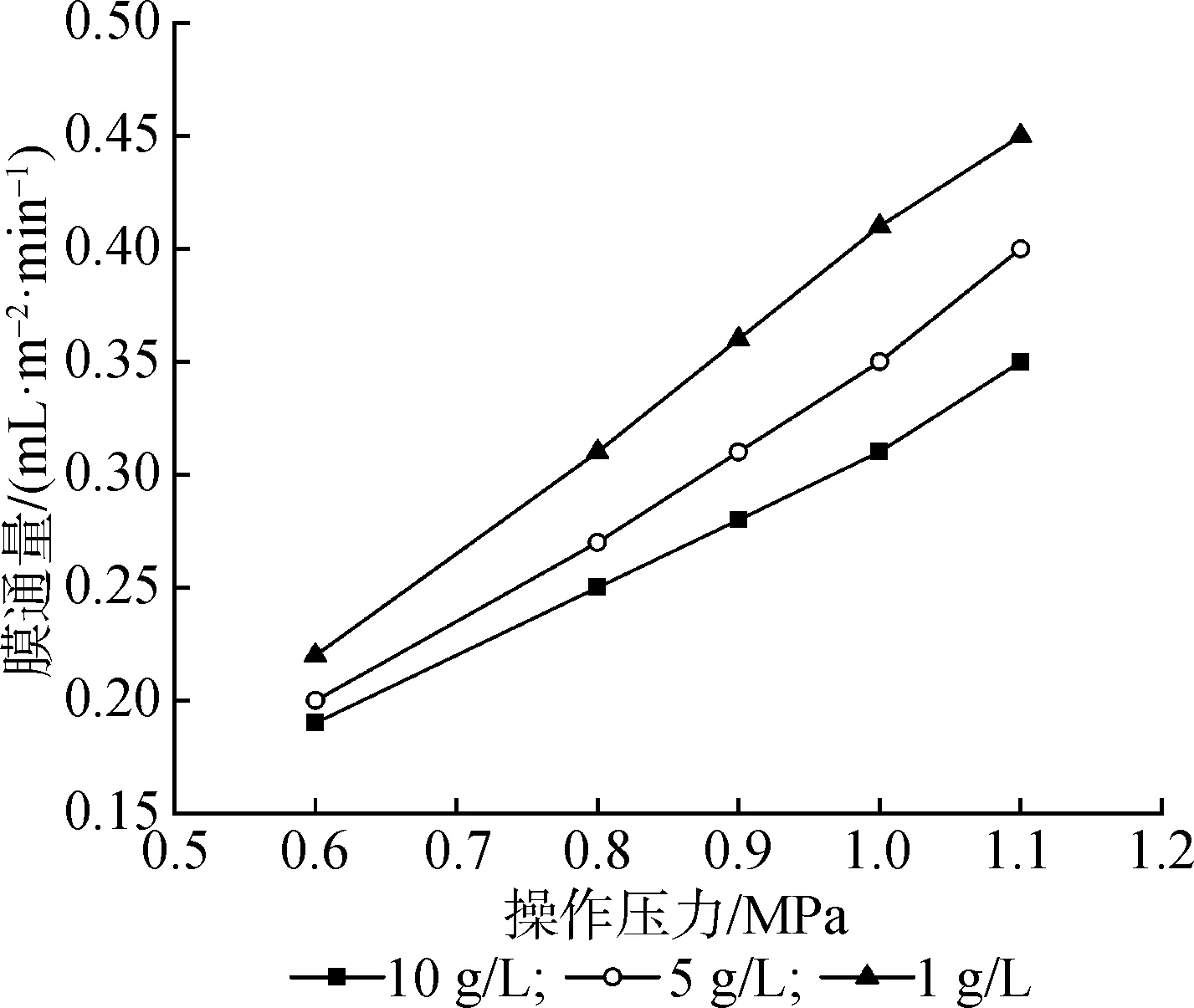
图4 不同浓度料液的膜通量随压力变化曲线Fig.4 Variation of membrane flux with pressure in different concentration solutions
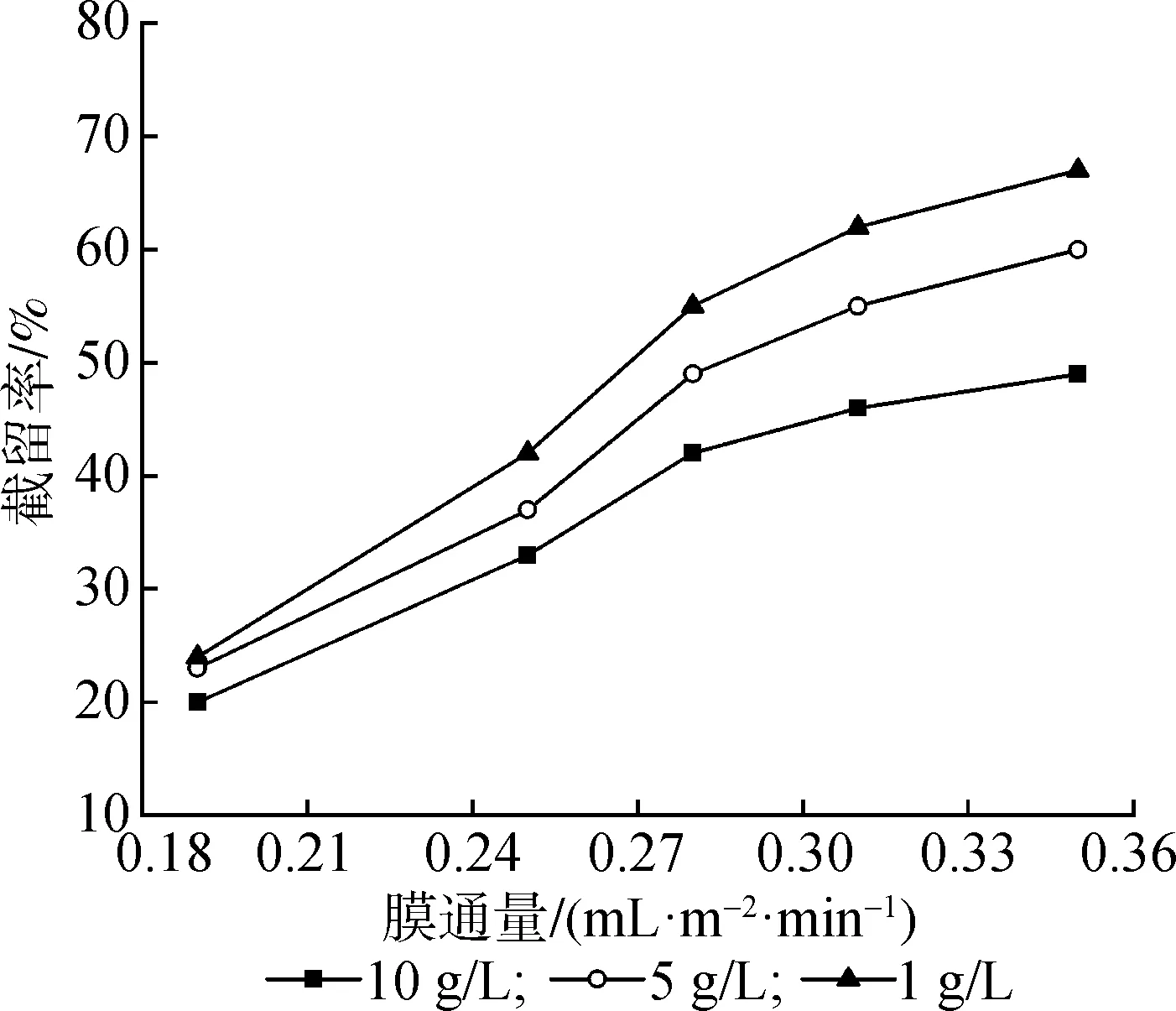
图5 低聚果糖溶液截留率随膜通量变化曲线Fig.5 Oligofructose retention rate with the flux curve-Figure
2.2.4纯化倍数 用非连续间歇恒容脱盐实验来测定料液的纯化倍数。从纯化倍数与料液浓度的关系图(图6)中可以看出,进行4次恒容透析是比较合适的。除第一阶段外,各渗滤操作阶段料液浓度均逐步增加,这是因为水不被截留而不断地通过纳滤膜,料液中的盐分虽然也随之部分透过膜,但纳滤膜对盐、糖有一定的截留,随着渗滤的进行料液浓度会逐渐增加,随着水加入次数的增多,料液浓度又呈下降趋势。在每一个渗滤阶段,料液中盐浓度逐渐增大,溶液中的反离子浓度也随之增加,并在静电力的作用下中和了大量膜表面的电荷使其有效电荷密度降低,从而对同离子的排斥力减弱,导致盐截留率降低;反之亦然,在每一次渗滤溶剂加入后,原料液中盐浓度减小,溶液中的反离子浓度也随之减小,膜表面的有效电荷密度增加,对同离子的排斥力增强,因此,实际操作中随着纯化倍数的增加,盐截留率也随之增大。
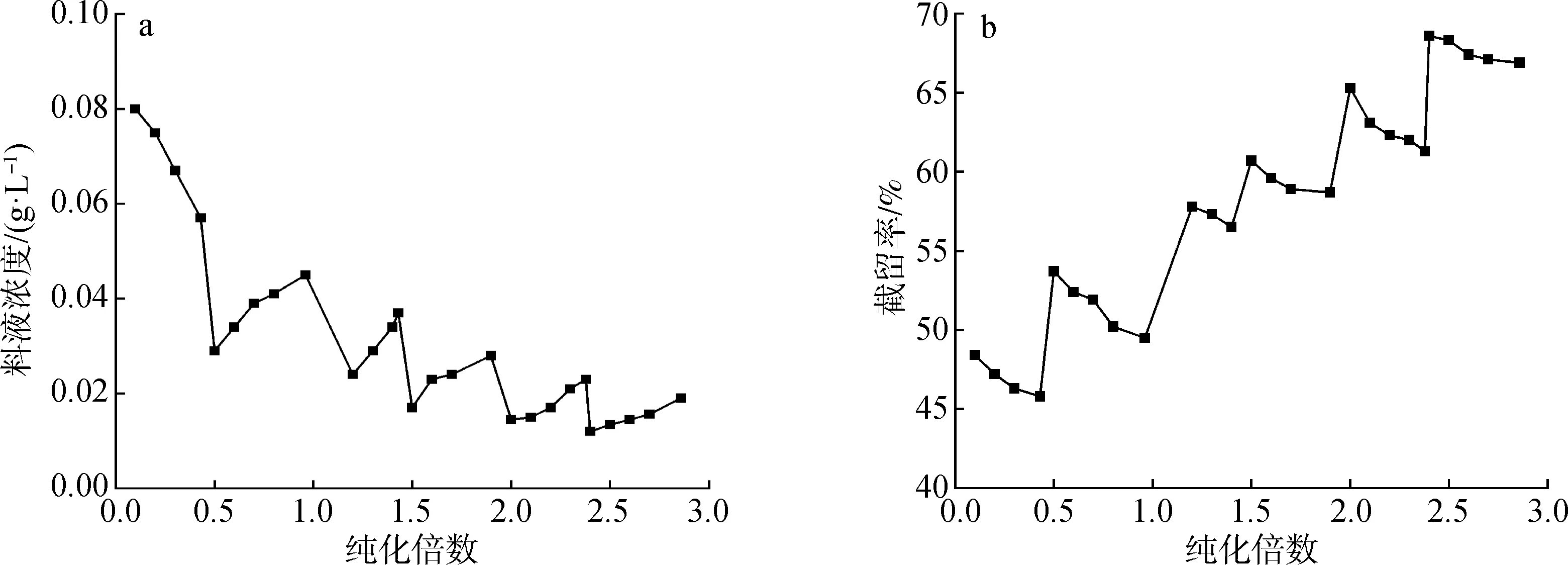
图6 纯化倍数与料液浓度(a)及截留率(b)关系图Fig.6 Relationship of purification fold and feed concentration(a) as well as rejection rate(b)
2.3 纳滤纯化低聚果糖的RSM分析
以低聚果糖纯度为响应值(Y),通过SAS 8.0软件的RSREG程序对试验结果进行响应面回归分析[22],响应面分析试验设计及结果见表1。
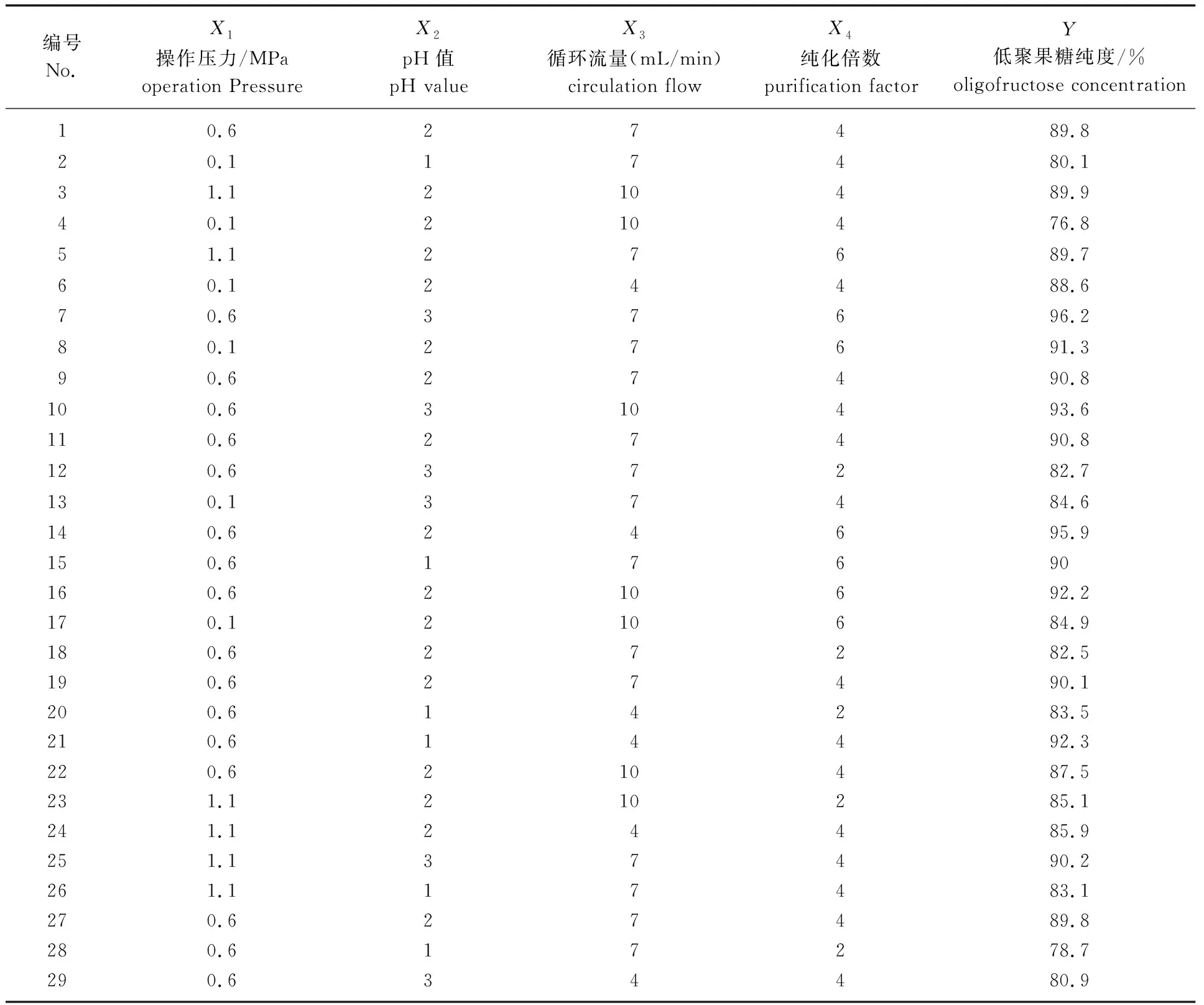
表1 纳滤纯化低聚果糖的响应面分析试验设计及结果Table 1 Experimental design and results of response of surface analysis of FOS by nanofiltration
通过RSREG程序对试验结果进行响应面回归分析,各因素经二次回归拟合后求得响应函数,即回归方程:
Y=90.384 5+2.291 724X1+2.519 85X2-1.434 25X3+6.309 47X4+0.65X1X2+3.820 6X1X3-3.017 39X1X4+7.410 58X2X3+0.350 512X2X4-0.555 934X3X4-3.569 9X12-2.573 24X22-1.886 84X32-1.436 54X42
由回归分析结果(见表2)可知,应用上述回归方程描述各因素和响应值之间的关系时,其因变量和全体自变量的线性关系显著(R2=0.98),表明该方程对实验结果的拟合情况良好,可以用该回归方程对实验真实值进行分析和预测。另外,从回归方程各项的方差分析结果可知,压力(X1)、pH值(X2)和纯化倍数(X4)对低聚果糖纯度的差异极显著(P<0.01),循环流量的差异也达到显著水平(P<0.01)。 影响顺序为纯化倍数>pH值>操作压力>循环流量。
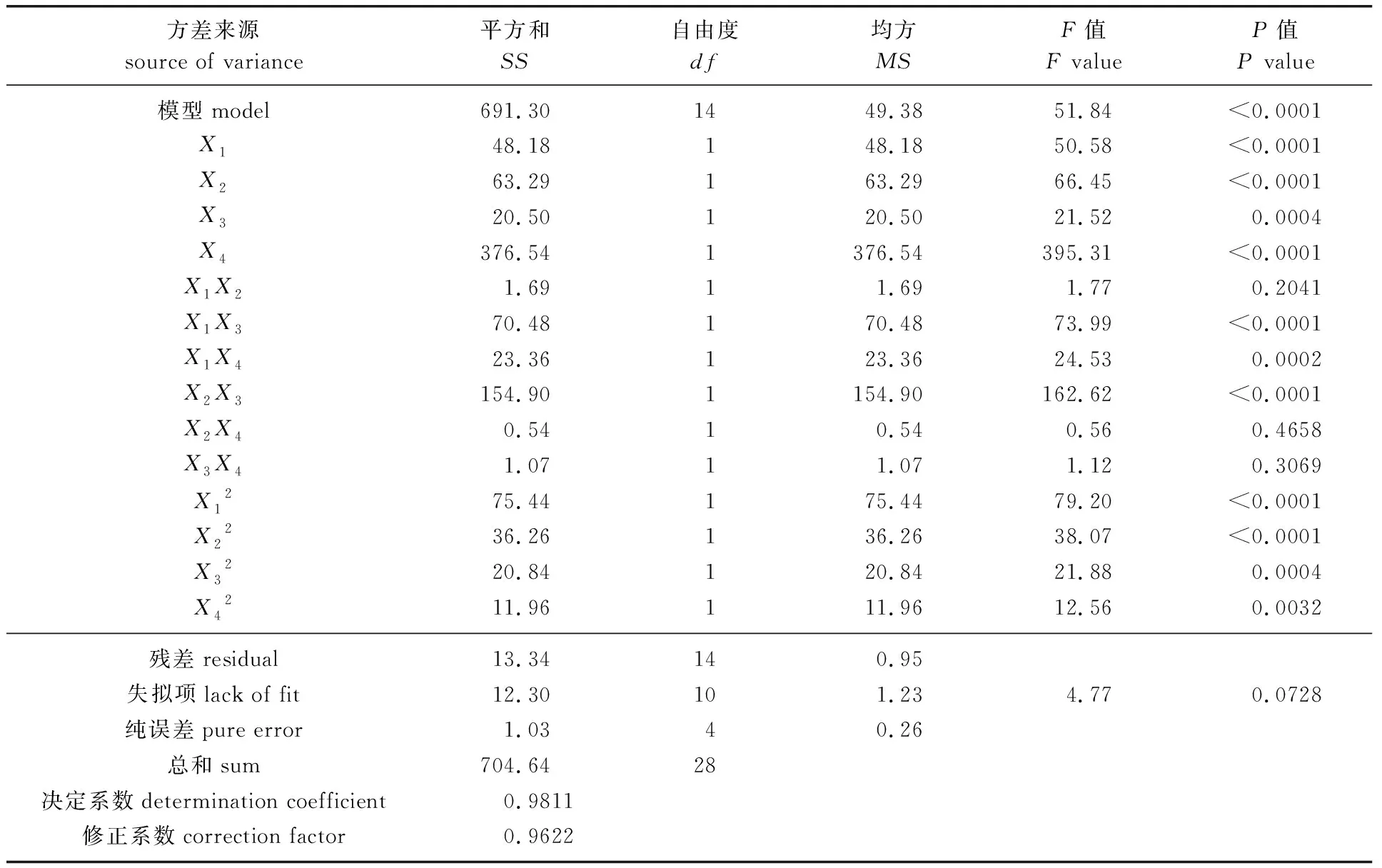
表2 纳滤纯化低聚果糖的响应面回归分析结果Table 2 Regression results of response of surface analysis of FOS by nonofiltration
由表2还可以看出,交互项X1X3、X1X4、X2X3以及所有二次项对低聚果糖纯度影响显著。pH值、纯化倍数的影响大于循环流量与操作压力的影响。
为进一步求得各因素的最优条件,对回归方程进行偏导求零,得出极值方程组,求解结果经实际条件修正,得出低聚果糖的最优分离纯化条件为:操作压力为0.15 MPa,循环流量5.3 mL/min,pH值为2.7,纯化倍数为5。在此条件下得到低聚果糖纯度理论值为94.75%。重复实验3次,测得低聚果糖纯度为95.2%、 94.7%和95.1%,与该条件下的理论预测值相差小于1%,采用RSM法优化得到的分离纯化工艺参数准确可靠,具有实用推广价值。低聚果糖样品经冷冻干燥得到白色粉末。
2.4 雪莲果低聚果糖结构表征
2.4.1定量测定 图7为分离纯化后的雪莲果低聚果糖样品的HPLC图谱,样品保留时间105~107 min,3种糖的分离度较好[23]。
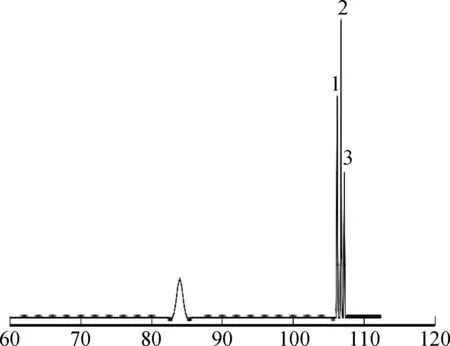
保留时间/min1.蔗果三糖kestose; 2.蔗果四糖nistose; 3.蔗果五糖sucrose图7 雪莲果低聚果糖HPLC图Fig.7 HPLC diagram of yacon oligofructose
得到蔗果三糖(GF2)线性回归方程y=152 570x-470 123,R=0.999 1,检出限为0.214 g/L;蔗果四糖(GF3)线性回归方程y=147 764x-912 8.90,R=0.998 6, 检出限为0.20 g/L;蔗果五糖(GF4):线性回归方程y=126 035x-453 87,R=0.998 9, 检出限为0.221 g/L。检出雪莲果低聚果糖样品中蔗果三糖、蔗果四糖、蔗果五糖的质量分数分别为20.6%、51.4%、23.1%,可以看出,经二次纳滤纯化的雪莲果低聚果糖样品中低聚果糖纯度为95.1%。
2.4.2质谱分析 雪莲果低聚果糖的质谱分析结果见图8。结果显示:样品中含有相对分子质量分别为180、342、504、666、828的5种组分,分别是单糖(葡萄糖和果糖)、蔗糖、蔗果三糖、蔗果四糖和蔗果五糖。
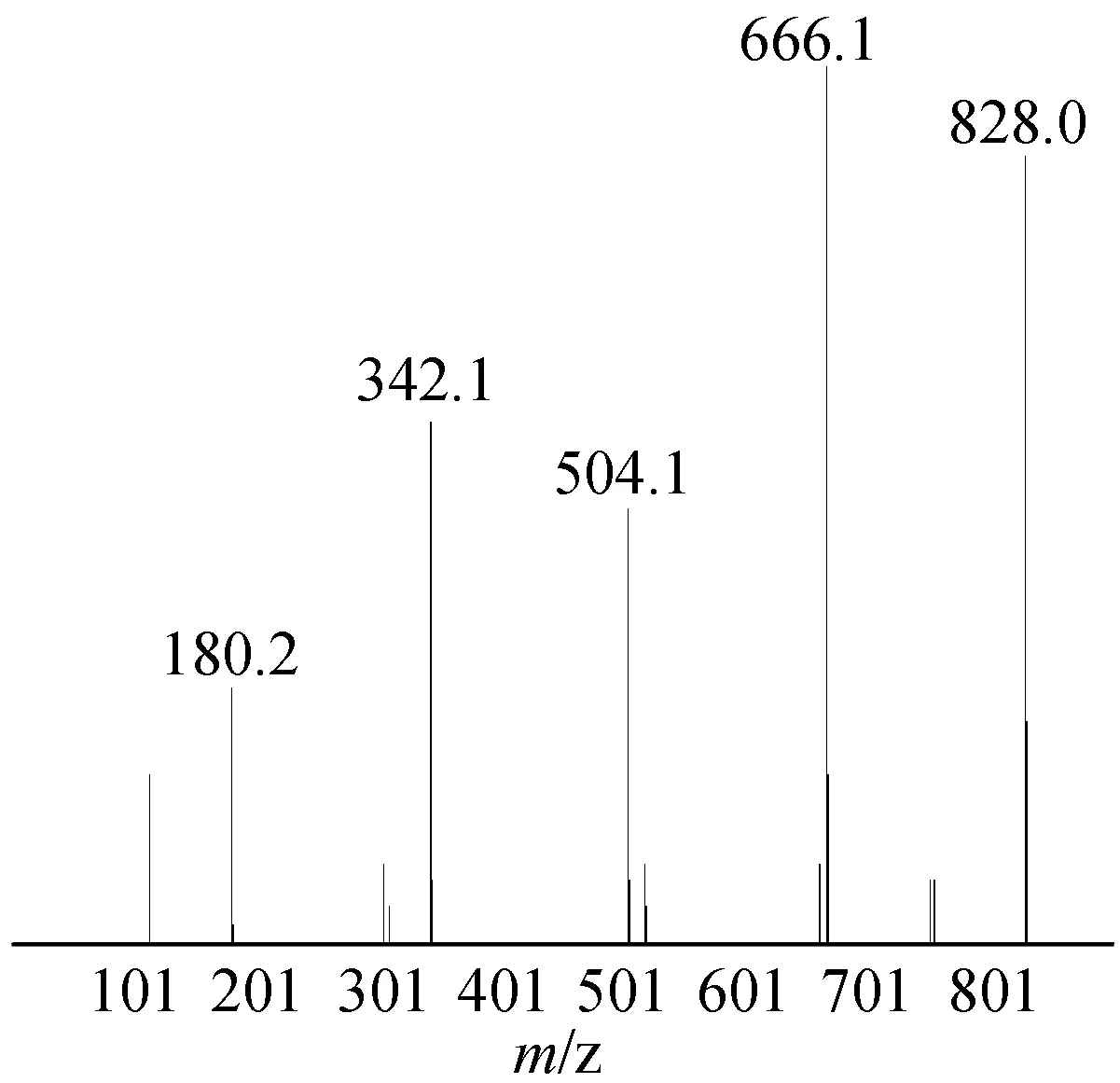
图8 雪莲果低聚果糖质谱图Fig.8 Mass diagram of yacon oligofructose
2.4.3IR分析 雪莲果低聚果糖IR分析结果见图9。雪莲果低聚果糖在500~4000 cm-1范围内具有呋喃糖类物质的特征吸收峰[24],3402 cm-1处的强吸收峰是糖分子中羟基(—OH)的伸缩振动吸收,2930 cm-1处峰是糖分子中C—H键的伸缩振动吸收,1431 cm-1处峰是糖分子中C—H键的变角振动吸收,由此可初步判断该物质是糖类化合物。1638 cm-1处的峰是糖分子中羰基(CO)的伸缩振动吸收;929 cm-1处的峰是呋喃糖环的对称伸缩振动吸收,1031 cm-1处的峰是糖分子中C—O键的变角振动,619 cm-1处的峰是糖分子中β型的C—H直立键的变角振动吸收;红外光谱分析结果表明:雪莲果低聚果糖主要是由β-呋喃构型的果糖组成的。
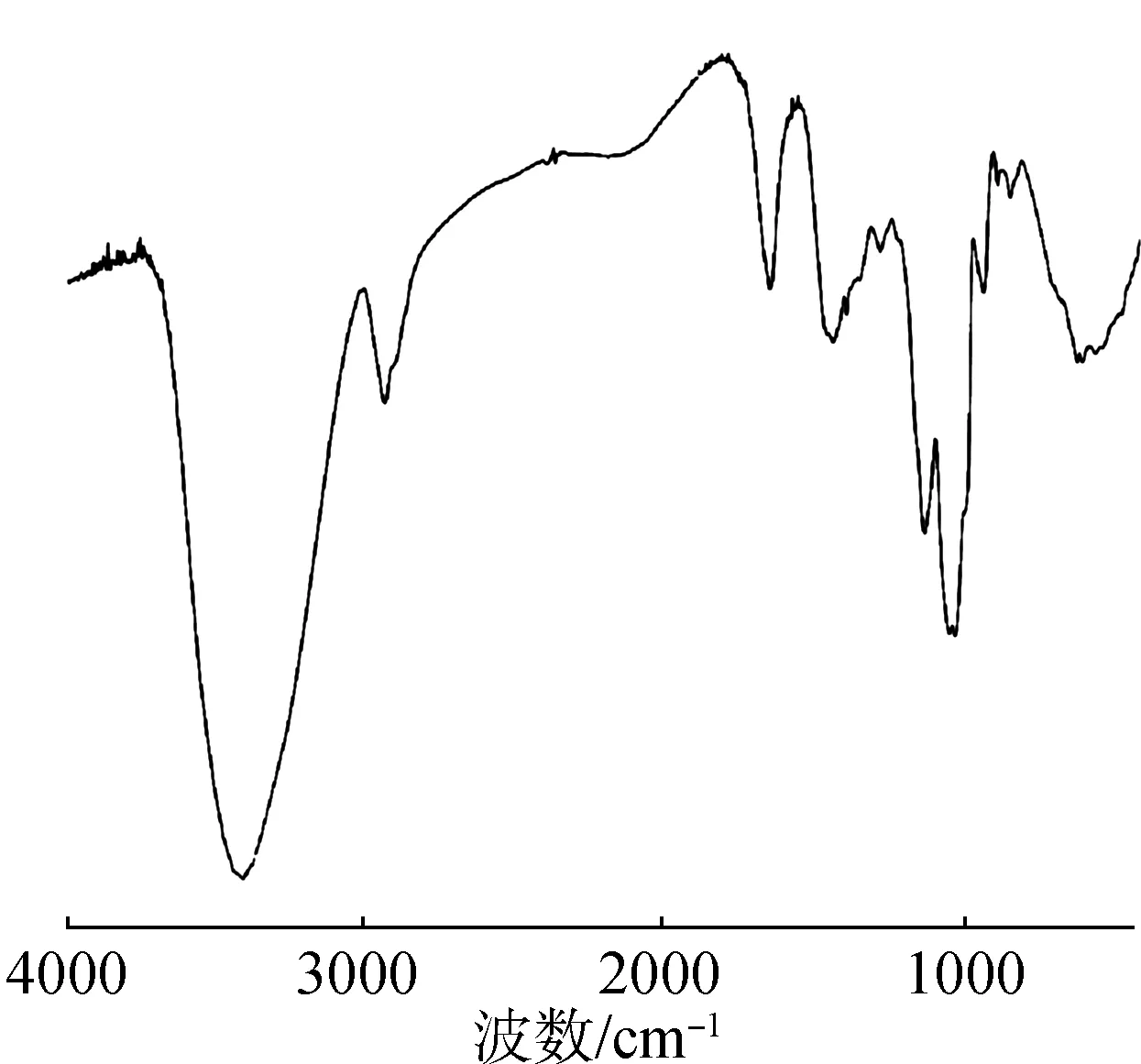
图9 雪莲果低聚果糖IR图Fig.9 IR diagram of yacon oligofructose
2.4.41H NMR及13C NMR 分析 雪莲果低聚果糖的氢谱、碳谱分析结果见图10。
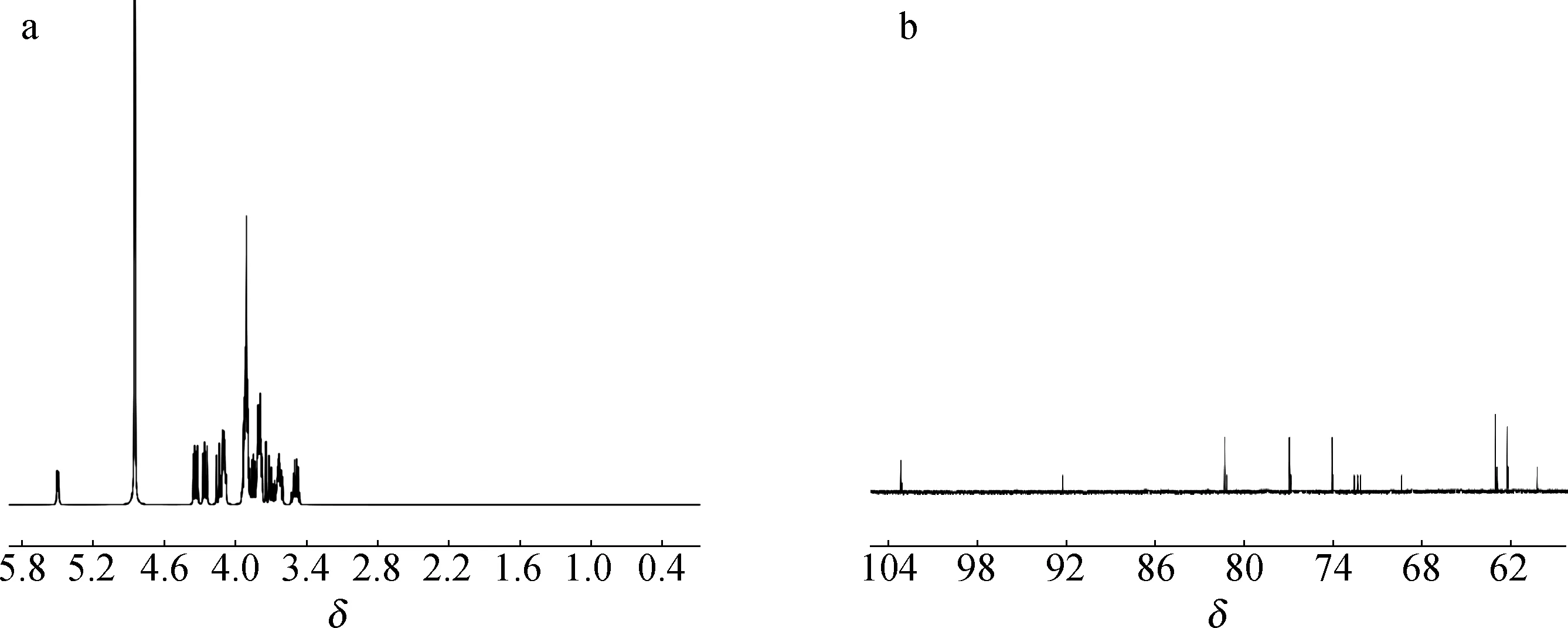
图10 雪莲果低聚果糖的1H NMR(a)和13C NMR(b)Fig.10 1H NMR(a) and 13C NMR(b) of yacon oligofructose
由图可以初步推断出雪莲果低聚果糖的氢谱和碳谱特征。1H NMR的特点是葡萄糖端基质子的1-H位于低场区,2-H和4-H 位于高场区,呈现特征的裂分信号[25],其余信号都在两组信号之间。δ4.2~4.5区域是果糖端基质子的3-H 和4-H的信号区,这一部分的峰面积积分值(4.637)与葡萄糖端基质子的5-H 信号区的峰面积积分值(1.000)的比值约为5 ∶1,因此可以初步判断该化合物上果糖片段的聚合度为5,即该化合物平均包含5个果糖单元。13C NMR的特点是果糖端基的C-2季碳信号在最低场,果糖和葡萄糖残基上的亚甲基(—CH2)碳信号在高场,而次甲基(—CH)碳信号均在δ103.17和δ63.03两组碳信号之间。
3 结 论
3.1选择操作压力、循环流速、pH值、纯化倍数4个因素,在单因素试验基础上,通过中心组合设计及响应面分析,建立了纳滤分离纯化制备高纯度低聚果糖的二次多项数学模型,该模型对实验真实值进行了很好地分析和预测。经优化的的工艺条件为:操作压力0.15 MPa,循环流量5.3 mL/min,pH值为2.7,纯化倍数为5,实际低聚果糖纯度为95.1%,采用RSM法优化得到的纳滤分离纯化工艺参数准确可靠,具有实用价值。
3.2通过HPLC-MS、IR、1H NMR及13C NMR等对雪莲果低聚果糖组分的纯度、组成、结构进行表征,结果表明:经纳滤技术分离纯化得到的雪莲果低聚果糖由蔗果三糖、蔗果四糖和蔗果五糖组成,其质量分数为95.1%,平均包含5个果糖单元,主要是由β-呋喃构型的果糖组成。
