人类白细胞抗原-E、人类白细胞抗原-G 蛋白在早期宫颈癌及癌前病变中的表达与人乳头瘤病毒感染的相关性研究
2020-09-15张莉占超
张莉,占超
1黄石市妇幼保健院妇女保健科,湖北 黄石 435000
2黄石市中医医院康复科,湖北 黄石 4350000
宫颈癌是一种妇科最常见的恶性肿瘤之一,中国家发病率仅次于乳腺癌,中国发病率位居世界前列且呈年轻化发展趋势[1],严重影响女性的生命健康。现已证实,人乳头瘤病毒(human papilloma virus,HPV)感染是多种宫颈疾病的主要危险因素,可能通过与宿主DNA结合而调节基因的转录水平,从而导致宫颈病变甚至诱发宫颈癌[2]。随着医疗科研水平的提高,研究证实,宫颈癌的发生发展与机体的免疫应答密切相关[3]。人类白细胞化抗原(human lekocyte antigen,HLA)可识别外来抗原,在机体启动免疫反应中发挥重要作用,其中HLA-E和HLA-G作为非经典的HLA-Ⅰ类分子,在多种肿瘤组织中表达上调[4]。研究发现,HLA-E和HLA-G可抑制多种免疫细胞的活性,使肿瘤逃避免疫监视,在肿瘤复发、转移中发挥重要作用[5]。本研究采用免疫组化法分别检测HLA-E、HLA-G在宫颈癌患者病理标本中的表达并检测HPV感染状态,探讨二者与宫颈癌患者临床特征的关系,并进一步分析其与HPV感染情况的相关性。
1 资料与方法
1.1 一般资料
选取2016年1月至2018年2月黄石市妇幼保健院及黄石市中医医院收治的宫颈癌患者。纳入标准:均经病理学检查确诊为宫颈癌;术前均未接受放化疗等抗肿瘤治疗;无其他肿瘤及免疫性疾病等病史;临床资料完整。排除标准:月经期、妊娠期及哺乳期妇女;既往3天内曾有性生活史、妇科检査、阴道冲洗或阴道内用药。依据纳入和排除标准,本研究共纳入150例早期宫颈癌患者,年龄39~79岁,平均(46.26±12.23)岁,<45岁60例,≥45岁90例;依据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期标准:Ⅰa期76例,Ⅰb期74例;分化程度:高分化52例,中分化58例,低分化40例;肿瘤直径:<1 cm 70例,≥1 cm 80例。同期选取上皮内瘤病变(cervical intraepithelial neoplasia,CIN)患者和慢性宫颈炎患者。纳入标准:筛查前无宫颈癌病史;受检时处于非月经期;近3个月内无性激素使用史。排除标准:合并急性生殖道炎症;既往存在宫颈锥切术或子宫切除术史;妊娠期女性。本研究共纳入120例CIN患者和154例慢性宫颈炎患者。CIN组患者年龄32~75岁,平均(46.98±11.96)岁;CIN分级:CINⅠ38例,CINⅡ40例,CINⅢ46例。慢性宫颈炎组患者年龄30~72岁,平均(48.68±10.76)岁。取150例早期宫颈癌患者的宫颈癌组织,120例CIN患者的CIN组织,154例慢性宫颈炎患者的正常宫颈组织。
1.2 实验方法
1.2.1 主要试剂 人宫颈癌细胞株HeLa(HPV16+)、C33a(HPV18+)、Cask(iHPV-)均购自海德创业(北京)生物科技有限公司,HPVl6 E6/E7特异性siRNA序列及阴性对照(negative control,NC)序列均由上海吉玛制药技术有限公司设计完成,E6及NC由上海吉码制药技术有限公司代为合成,鼠抗人HLA-E单克隆抗体、鼠抗人HLA-G单克隆抗体均购自北京奥维亚生物技术有限公司,HPV检测试剂盒、通用型二抗试剂盒均购自美国Abcam公司,免疫组化试剂盒、二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒均购自北京中杉金桥生物技术有限公司,反转录试剂盒、蛋白质印迹(Western blot)试剂盒均购自美国sigma公司。
1.2.2 免疫组化法检测HLA-E、HLA-G蛋白的表达情况 将收集的组织样本固定包埋并切片,二甲苯和梯度乙醇脱蜡,柠檬酸盐缓冲液修复,充分暴露抗原决定簇。3%的双氧水室温下浸泡10 min,封闭,分别加入稀释好的一抗4℃孵育过夜,次日冲洗干净,分别加入适量生物素标记的二抗室温孵育30 min,清洗。加入适量DAB作用2~5 min,去离子水终止反应,苏木素复染1.5~2.0 min,清洗后梯度乙醇脱水,二甲苯浸泡,干燥后用中性树胶封片,镜检观察并记录实验结果。结果判定:由两名经验丰富的病理医师对病理切片进行盲评,光学显微镜下观察制备好的切片,HLA-E、HLA-G蛋白主要定位于细胞质,细胞质呈棕黄色染色为阳性。每张切片随机选取5个高倍视野,每个视野随机计数200个细胞,根据染色强度和阳性细胞所占比例进行评分。染色强度评分:无着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。阳性细胞所占比例评分:无阳性细胞计0分,阳性细胞所占比例<25%计1分,阳性细胞所占比例25%~50%计2分,阳性细胞所占比例51%~75%计3分,阳性细胞所占比例>75%计4分。将染色强度评分和阳性细胞所占比例评分相加,≥3分为阳性,<3分为阴性。
1.2.3 HPV 检测及判定标准 采用一次性宫颈脱落细胞取样器,在宫颈外口黏膜处取样并置于无菌取样管中,30 min内使用HPV检测试剂盒对样品进行检测,以标本中HPV的表达值相对光单位/阳性标准品阈值(relative light units/cut off,RLU/CO)作为病毒负荷量,RLU/CO<1判定为阴性,RLU/CO≥1为阳性,且阳性分为 1~100、101~1000和>1000共3个病毒负荷量级别。
1.2.4 Western blot法检测HLA-E、HLA-G蛋白的相对表达量 将人宫颈癌细胞株HeLa、转染后48 h的HeLa-siE6和HeLa-NC细胞株,加入适量的放射免疫沉淀(radio-immunoprecipitation assay,RIPA)裂解液裂解30 min,4℃情况下12 000 r/min离心10 min,收集上清,采用二喹啉甲酸(bicinchoninic acid,BCA)试剂盒检测蛋白浓度,将蛋白样品与上样缓冲液(loading buffer)混合,100℃水域变性5 min,然后加入至制备好的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶(5%浓缩胶,10%分离胶)上样孔中,每孔25 μl,调整浓缩胶电压为60 V,分离胶电压为120 V,结束后取出凝胶,4℃转膜1.5 h,采用5%脱脂奶粉封闭聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜2 h,加入转化生长因子-β(transforming growth factor-β,TGF-β)、SMAD一抗,4℃过夜,TBST洗膜后加入辣根过氧化物标记的羊抗兔IgG二抗,37℃孕育2 h后加入电化学发光(electrochemiluminescence,ECL)显影,采用自动凝胶成像系统采集图像,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,计算目的蛋白的相对表达量。
1.2.5 细胞转染 调整人宫颈癌细胞株HeLa浓度至1×106/ml,取2 ml接种于6孔板中,培养过夜,采用Lipofectamine 2000将浓度均为100 nmol/L的siE6和NC转染至人宫颈癌细胞株HeLa,得到HeLa-siE6及HeLa-NC细胞株,以未处理的HeLa细胞作为空白对照。
1.2.6 定量逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测E6mRNA 的相对表达量 将人宫颈癌细胞株HeLa、转染后48 h的HeLa-siE6和HeLa-NC细胞株,加入1 ml Ezol裂解液,混匀。12 000 r/min离心10 min,去除上清液,加入Trizol与三氯甲烷震荡混匀,12 000 r/min离心10 min,加入异丙醇,用移液器吹打均匀,12 000 r/min离心后,弃去上层清液,留下层絮状沉淀,采用Trizol法提取各组细胞总RNA并进行反转录,按照PrimeScrip反转录试剂盒说明书反转录成cDNA,采用SYBR Premix ExTaq说明书配置PCR反应体系,反应条件:95℃预变性10 min,95 ℃ 10 s,60 ℃ 30 s,72 ℃ 10 s,40个循环;95℃ 5 s,60℃ 1 min,95℃ 30 s。以U6为内参,采用2-△△Ct计算E6mRNA的相对表达量。每个样本独立重复实验3次。U6上游引物:5'-CCTGAGCAGGAACAGCTTGA-3',下游引物:5'-CGTACGTAGTCGAACCGAGA-3';E6上游引物:5'-CCATATCGCTGGATGACGAT-3',下游引物:5'-GTG CAGGGTCCGAGGT-3'。
1.3 统计学方法
采用SPSS 16.0软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,多组间两两比较采用LDS-t检验,两组间比较采用两独立样本t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;相关性分析采用Spearman相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 HLA-E、HLA-G 蛋白阳性表达率的比较
随病变程度的加重,HLA-E、HLA-G蛋白的阳性表达率均逐渐升高,其中宫颈癌组织中HLA-E、HLA-G蛋白的阳性表达率均高于CIN组织和慢性宫颈炎组织,CIN组织中HLA-E、HLA-G蛋白的阳性表达率均高于慢性宫颈炎组织,差异均有统计学意义(P<0.05)。(表1)
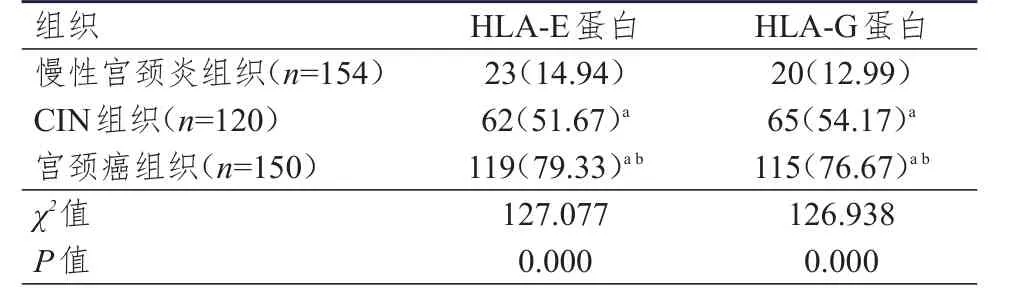
表1 不同组织中HLA-E、HLA-G蛋白阳性表达情况的比较[n(%)]
2.2 HPV感染和病毒负荷量的比较
随病变程度的加重HPV阳性率均逐渐升高,其中宫颈癌组织中HPV阳性率为89.33%(134/150),高于CIN组织和慢性宫颈炎组织的69.17%(83/120)和6.49%(10/154),CIN组织中HPV阳性率高于慢性宫颈炎组织,差异均有统计学意义(P<0.05)。不同HPV病毒负荷量随着病变程度的升高而增加(表2)。

表2 不同组织中HPV病毒负荷量
2.3 HLA-E、HLA-G 蛋白的表达与临床特征的相关性分析
相关性分析显示,HLA-E和HLA-G蛋白的表达与分化程度、CIN分级、TNM分期和HPV感染均呈正相关,与年龄、肿瘤直径、淋巴结转移情况无相关性,且HLA-E的表达与HLA-G呈正相关关系(r=0.745,P=0.021)。(表3)
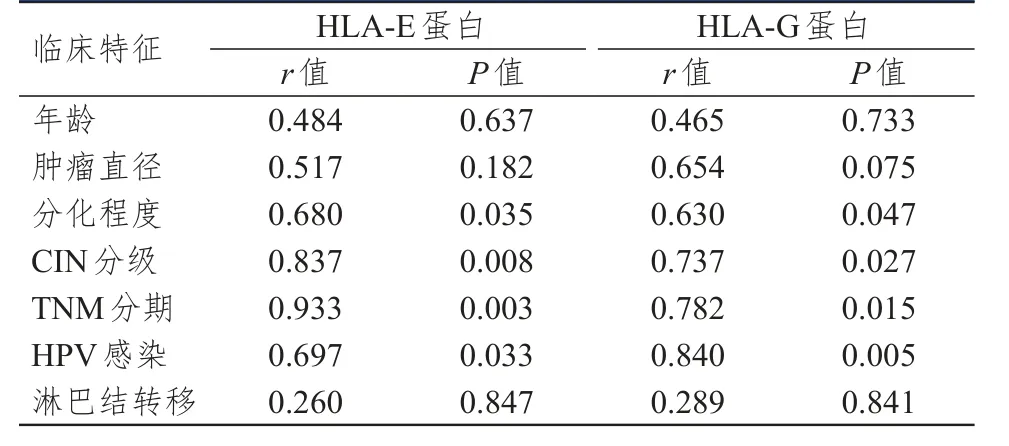
表3 HLA-E、HLA-G蛋白的表达与临床特征的相关性分析
2.4 不同HPV 感染状态宫颈癌细胞中HLA-E、HLA-G 蛋白相对表达量的比较
Western blott法检测不同HPV感染状态的宫颈癌细胞中HLA-E、HLA-G的相对表达量,结果显示,人宫颈癌Caski细胞中HLA-E、HLA-G的相对表达量均低于HeLa、C33a细胞,差异均有统计学意义(P<0.05);而人宫颈癌HeLa、C33a细胞中HLA-E、HLA-G的相对表达量的比较,差异均无统计学意义(P>0.05)。(表4)
表4 不同HPV感染状态宫颈癌细胞中HLA-E、HLA-G蛋白的相对表达量的比较(±s)
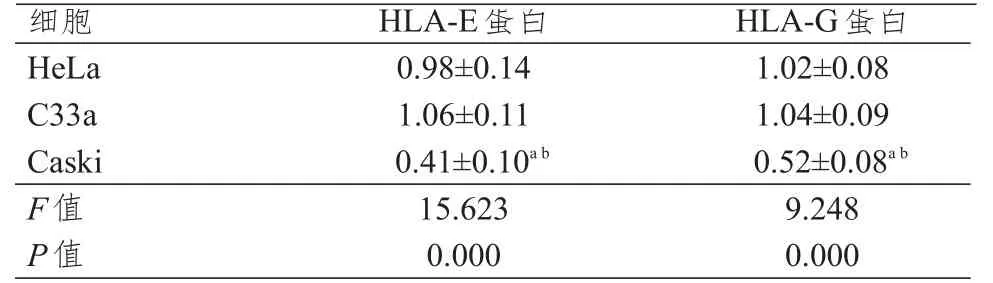
表4 不同HPV感染状态宫颈癌细胞中HLA-E、HLA-G蛋白的相对表达量的比较(±s)
注:a与人宫颈癌HeLa细胞比较,P<0.05;b与人宫颈癌C33a细胞比较,P<0.05
细胞H e L a C 3 3 a C a s k i F值P值0.9 8±0.1 4 1.0 6±0.1 1 0.4 1±0.1 0 a b 1 5.6 2 3 0.0 0 0 1.0 2±0.0 8 1.0 4±0.0 9 0.5 2±0.0 8 a b 9.2 4 8 0.0 0 0 H L A-E蛋白H L A-G蛋白
2.5 不同人宫颈癌HeLa细胞中E6mRNA相对表达量的比较
HeLa-siE6细胞中E6mRNA的相对表达量为(0.28±0.02),明显低于HeLa细胞的(0.95±0.09)和HeLa-NC细胞的(1.04±0.04),差异均有统计学意义(t=17.801、41.627,P<0.01)。
2.6 沉默E6基因表达后不同HeLa细胞中HLAE、HLA-G 蛋白相对表达量的比较
人宫颈癌HeLa-siE6细胞中HLA-E、HLA-G蛋白的相对表达量,均明显低于HeLa和HeLa-NC细胞,差异均有统计学意义(P<0.01),但人宫颈癌HeLa、HeLa-NC细胞中的HLA-E、HLA-G蛋白的相对表达量比较,差异均无统计学意义(P>0.05)。(表5)
表5 不同HeLa细胞中HLA-E、HLA-G蛋白相对表达量的比较(±s)
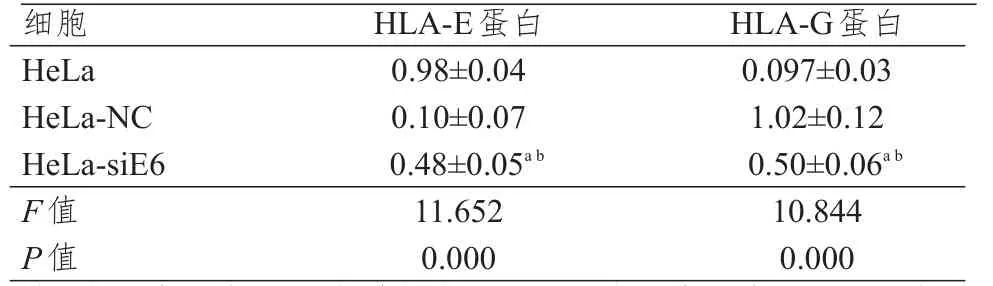
表5 不同HeLa细胞中HLA-E、HLA-G蛋白相对表达量的比较(±s)
注:a与人宫颈癌HeLa细胞相比,P<0.05;b与人宫颈癌HeLa-NC细胞相比,P<0.05
细胞H e L a H e L a-N C H e L a-s i E 6 F值P值0.9 8±0.0 4 0.1 0±0.0 7 0.4 8±0.0 5 a b 1 1.6 5 2 0.0 0 0 0.0 9 7±0.0 3 1.0 2±0.1 2 0.5 0±0.0 6 a b 1 0.8 4 4 0.0 0 0 H L A-E蛋白H L A-G蛋白
3 讨论
宫颈癌是导致女性病死的第二大恶性肿瘤,流行病学分析报告显示,近年来,宫颈癌呈现高发且年轻化趋势,宫颈癌的发展是从宫颈良性病变进展为宫颈上皮内瘤病变,再进展为恶性癌变,是一个动态并连续的过程[6]。因此,早期筛查并采取及时有效的控制措施进行干预是防止宫颈病变持续发展的关键。
近年来研究发现,机体的免疫功能与肿瘤的发生发展密切相关,HLA-G、HLA-E对免疫系统的影响已在多种肿瘤的得到证实,二者对树突状细胞、B细胞、自然杀伤细胞和T细胞具有相似的不良反应,可通过与细胞表面相应受体结合而发挥抑制作用;HLA-G、HLA-E还存在协同作用,可促进肿瘤细胞的免疫逃逸[7]。此外,HLA-G、HLA-E还可与某些细胞因子结合,使免疫细胞对肿瘤特异性抗原无应答反应。Cordeiro等[8]研究发现,HLA-G在宫颈病变CINⅢ组织中异常高表达,患者发生宫颈癌变的风险明显增加。Kirana等[9]的研究结果显示,HLA-G高表达宫颈癌患者的5年生存率明显降低。Castelli等[10]结果发现,晚期直肠癌患者的HLA-E表达水平明显高于早期患者。Gornalusse等[11]的研究显示,HLA-G、HLA-E可对宫颈癌进行诊断和预后评估。本研究中也得到相似的结果,HLA-G、HLA-E蛋白的阳性表达率随宫颈病变严重程度增加而升高,且相关性分析显示,二者呈正相关关系。
宫颈癌是一种由多基因诱导而发生的疾病,被人们广泛认知的是高危型HPV的持续感染,宫颈癌中E6和E7是HPV特异性癌蛋白,可通过干扰基因的表达,导致细胞周期紊乱、抑制凋亡,这种机制在原癌基因的激活中发挥了重要的作用,可导致机体免疫功能的失调[12]。多数女性在感染HPV后可诱发机体免疫反应,病毒被自然清除且病变消退,而少数感染不能及时清除的患者会导致疾病进展,甚至发生癌变。研究显示,不同病变程度,机体HPV的负荷量呈动态变化[13]。宁雪朋等[14]对140例宫颈病变的患者进行研究,结果发现,宫颈癌患者的HPV阳性率明显高于宫颈炎患者,且随着癌变恶性程度的增加,HPV的阳性率也随之增加。本研究中,宫颈癌组织中HPV阳性率为89.33%,高于慢性宫颈炎组织和CIN组织,且慢性宫颈炎组织中HPV阳性率低于CIN组组织,与既往研究结果相符。
在宫颈病变中,HLA-G、HLA-E和HPV均可导致机体免疫系统失调,相关性研究有利于理解宫颈癌的发生发展。有研究指出,多种细胞因子在HLA-G、HLA-E表达通路和HPV致癌通路中同时发挥作用[15]。Swets等[16]研究表明,HPV E6蛋白与p53相互结合后可抑制肿瘤细胞的凋亡,而p53可调节HLA-G的表达,参与肿瘤的进展。研究发现,HLA-E 可促进核因子-κB(nuclear factor-κB,NF-κB)靶基因cIAP1、cIAP2的表达,而HPV18 E6蛋白是介导NF-κB磷酸化的重要因子,发挥NF-κB的抗凋亡作用[17]。本研究结果显示,HLA-G、HLA-E的相对表达量与HPV阳性率均呈正相关。为进一步研究HLA-G、HLA-E与HPV感染的相关性,本研究分析了不同HPV感染状态的宫颈癌细胞中这两种抗原的相对表达量,结果显示,HLA-G、HLA-E在感染HPV的细胞中的相对表达量均明显升高,且与病毒感染类型无关。在HeLa(HPV16+)细胞中,沉默E6基因表达后,HLA-E、HLA-G蛋白的相对表达量均明显下降,再次证明HLA-G、HLA-E的表达与HPV感染的相关性,同时也说明HPV感染导致的HLA-G、HLA-E表达水平上升可能是肿瘤发生的重要途径,且E6蛋白在此过程中起到重要的作用,但具体机制有待进一步研究。
综上所述,HLA-G、HLA-E的表达水平与HPV感染均随着宫颈病变程度的增加而升高,且相互之间存在正相关关系,这3种指标有望作为宫颈癌早期筛查的重要标志物,为疾病的预防和治疗提供新的思路。
