乳腺癌治疗相关肺损伤诊治共识
2020-09-15邵彬王东吴宏勖刘毅强铁剑齐丽萍史蕤冉然张嘉扬王环李凤芝陈祎霏张霖惠李惠平张波
邵彬,王东,吴宏勖,刘毅强,铁剑,齐丽萍,史蕤,冉然,张嘉扬,王环,李凤芝,陈祎霏,张霖惠,李惠平#,张波#
北京大学肿瘤医院暨北京市肿瘤防治研究所/恶性肿瘤发病机制及转化研究教育部重点实验室,1乳腺内科,3病理科,4放疗科,5医学影像科,6药剂科,北京 100142
2空军特色医学中心呼吸与危重症医学科,北京 100142
目前,乳腺癌是女性最常见的恶性肿瘤之一[1],乳腺癌的治疗方法主要包括手术、化疗、放疗及靶向治疗等,但在治疗的同时,不可避免地会产生各种相关的不良反应,肺损伤是放化疗及靶向治疗非常重要的不良反应之一。乳腺癌治疗相关肺损伤主要包括放疗相关肺损伤及药物治疗相关肺损伤,放疗导致的肺损伤发生率为5%~15%[2-3],而药物治疗导致的肺损伤发生率为10%~20%[4]。
1 常见药物及放疗相关肺损伤
1.1 化疗药物导致的肺损伤
从世界卫生组织(WHO)全球不良反应数据库提取的数据表明,乳腺癌药物治疗相关肺损伤的药物主要以化疗和靶向治疗药物为主,内分泌治疗药物较少。药物相关肺损伤发生率较高的药物包括依维莫司(20.79%)、紫杉醇(17.06%)、曲妥珠单抗(15.80%)、卡 铂(14.33%)、长春瑞滨(12.98%)、吉西他滨(12.74%)、多柔比星(10.00%)和环磷酰胺(8.88%)[5-6]。
1.1.1 环磷酰胺
与其他药物或放疗联用的情况下,环磷酰胺导致肺损伤的发生率仍较低(<1%)[7]。环磷酰胺导致肺损伤发生时间多在用药3周~3年后,主要表现为单核细胞肺泡炎,多数患者在停药和激素治疗后恢复[8-9],常见肺损伤类型包括以下两种:①急性间质性肺炎,这种情况下的损伤是可逆的,停药并激素治疗可逆转;②慢性进行性纤维化肺病,这种类型通常见于环磷酰胺低剂量长期应用(数月至数年)的患者,损伤可能不可逆,停药并激素治疗效果不佳,可能出现进行性呼吸衰竭,病死率较高(约60%)[10-11]。
1.1.2 蒽环类
蒽环类药物导致的肺损伤与治疗方案(单次、累积剂量)相关,最常见的影像学表现为机化性肺炎,通常激素对症治疗效果良好[12]。表柔比星是临床常用的蒽环类药物,剂量>60 mg/m2,或与氟尿嘧啶联用,且为剂量密集方案时,表柔比星相关肺炎的发生风险明显提高[6]。
1.1.3 长春瑞滨
长春瑞滨导致的肺损伤较为少见,主要发生于非小细胞肺癌治疗中长春瑞滨与其他抗肿瘤药物联用的情况下[13]。在乳腺癌中,也有长春瑞滨联合曲妥珠单抗导致间质性肺炎的报道[14]。
1.1.4 吉西他滨
吉西他滨一种胞嘧啶核酸类似物,10%左右的患者会在输注后数小时内发生呼吸困难,支气管痉挛发生率为0.6%。大规模临床资料的综合分析表明,吉西他滨相关肺损伤的发生率为0.02%~0.27%。合并肺部基础疾病、胸部放疗及联合化疗是吉西他滨相关肺损伤的危险因素,病理改变主要包括毛细血管渗漏综合征伴肺水肿、弥漫性肺泡出血和局灶性肺泡出血;此外,肺功能检查可存在限制性通气障碍及弥散功能减低[15-17]。
1.1.5 紫杉类
紫杉类的代表药物——紫杉醇和多西他赛导致肺炎的发生率分别为0.73%~12.00%和7.00%~26.00%[16],呼吸困难、咳嗽、低氧血症及肺浸润通常于治疗后的1周~3个月内出现。紫杉醇相关肺损伤的常见类型包括以下四种:①急性输液反应导致的肺损伤,早期临床研究时,其发生率高达30%,常规进行激素预处理后,发生率下降至1%左右[18];②间质性肺炎;③弥漫性肺泡损伤;④肺纤维化[12]。
1.1.5.1 紫杉醇 紫杉醇相关肺损伤的可能危险因素包括以下两种:①每周方案的发生风险高于3周方案[19];②同时联用吉西他滨及伊立替康可增加肺损伤的危险。目前,临床有部分严重肺炎及肺纤维化致死的病历报道,但具体原因不能明确,轻度患者可自行缓解或小剂量激素治疗有效。紫杉醇相关肺损伤的胸部影像表现为双肺网状或网状结节状不透光区、灶状病变、双侧灶状密度减淡区,多以双上叶明显。紫杉醇相关肺损伤的机制可能与过敏反应有关,严重可导致支气管痉挛及低血压[20-21]。
1.1.5.2 多西他赛 多西他赛相关肺损伤的常见类型包括:①急性、亚急性间质性肺炎,极少数情况还可伴随周围嗜酸性粒细胞增多;②胸腔积液,主要是由毛细血管渗漏综合征导致;③肺纤维化。此外,多西他赛导致的肺损伤呈剂量依赖性;在与其他化疗药物联用或同时接受胸壁放疗时,多西他赛导致的肺损伤肺毒性风险增加[6,22]。
1.2 靶向治疗药物导致的肺损伤
1.2.1 依维莫司
依维莫司是哺乳动物雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)抑制剂[23]。间质性肺炎是依维莫司较为常见不良反应之一,发生率为3%~23%,大部分可控制,无需停药,部分患者需减量,部分治疗不及时的患者可发生死亡。间质性肺炎一般发生在给药后3.4~36.7周,多数情况下,依维莫司诱导的间质性肺炎症状较轻,但也存在症状较严重的情况,甚至发生死亡。
1.2.2 抗人表皮生长因子受体2(human epidermal growth factor receptor2,HER2)治疗药物
表皮生长因子受体(epidermal growth factor receptor,EGFR)表达于Ⅱ型肺泡上皮细胞,参与肺泡壁修复;靶向EGFR的药物可损害肺泡修复机制[24]。
1.2.2.1 曲妥珠单抗 曲妥珠单抗是一种人源化单克隆抗体,约0.3%的患者可出现全身性过敏反应和部分肺部不良反应,如支气管痉挛、低血压、血管性水肿,会作为输液反应报道[25-26]。接受乳腺癌辅助治疗的女性患者,曲妥珠单抗联合化疗的肺部不良反应发生率高于单独化疗的患者,NSABP B31研究中,美国国家癌症研究所常规毒性判定标准(National Cancer Institute-common toxicity criteria,NCI-CTC),2~5级肺部不良反应发生率为(14%vs5%),NCCTG N9831研究中,3~5级肺部不良反应和2级呼吸困难发生率分别为3.4%和1.0%[27]。曲妥珠单抗联合化疗与单独化疗患者最常见的肺部反应为呼吸困难,NSABP B31研究(NCI-CTC 2~5级:12%vs4%)和NCCTG N9831研究(NCI-CTC 2~5级:2.5%vs0.1%)也进行了报道。接受曲妥珠单抗治疗的转移性乳腺癌女性患者肺部不良发生率也有增加。导致间质性肺病的风险因素包括既往或联合使用已知可引起间质性肺病的其他抗肿瘤治疗,如紫杉类、吉西他滨、长春瑞滨和放疗。既往也有曲妥珠单抗治疗中急性呼吸窘迫综合征、亚急性间质性肺炎和机化性肺炎的病例报告[28-31],在停用曲妥珠单抗并使用糖皮质激素治疗后症状多能缓解。
1.2.2.2 TDM1 TDM1是曲妥珠单抗和细胞毒性微管抑制剂DM1相结合的抗体-药物偶联物。在Ⅲ期临床试验中,肺部并发症总发生率较低,EMILIA研究中为1.2%[32],MARIANNE与TH3REA研究中也罕有肺毒性报道,TH3RESA研究报道,TDM1用药组因TDM1相关肺部炎症和肺部感染性炎症各死亡1例[33-34]。也有关于TDM1治疗后发生肺动脉高压的病例报告[35]。在TDM1使用后出现间质性肺炎的病例报告中,患者在使用TDM1治疗2个周期后出现呼吸困难和干咳,激素联合沙丁胺醇治疗后呼吸系统症状得到改善[36]。此外,少数报道显示,接受TDM1治疗的患者也出现了急性肺炎(包括严重的、危及生命的病例),其中GATSBY研究纳入了HER2阳性的胃癌患者,其中3%的TDM1组患者有肺炎,其中2%因为肺炎停药,1%的患者因此死亡[37]。
1.2.2.3 拉帕替尼 拉帕替尼是酪氨酸激酶抑制剂,是EGFR1和HER2双重抑制剂,肺毒性较少见(<1%)[32,38]。帕妥珠单抗靶向作用于HER2细胞外二聚化结构域,其可能引起的呼吸系统不良反应包括呼吸困难、胸腔积液等。
1.2.2.4 帕妥珠单抗 帕妥珠单抗可引起的3~4级不良反应较罕见,在CLEOPATRA等研究中也并未对呼吸系统不良反应进一步探讨[39]。
1.2.3 抗血管治疗
贝伐珠单抗是血管内皮生长因子(vascular endothelial growth factor,VEGF)单抗,目前临床可见非小细胞肺癌肺出血、气管食管瘘的报道,但未见乳腺癌相关报道[40-41]。此外,一项Meta分析结果显示,约0.7%的使用贝伐珠单抗治疗的乳腺癌患者可能出现动脉血栓性栓塞[42]。阿帕替尼和重组人血管内皮抑制素均未见肺损伤报道。
1.2.4 免疫治疗导致的肺损伤
主要包括程序性死亡受体1(programmed cell death1,PDCD1,也称PD-1)单抗及程序性死亡受体配 体 1(programmed celldeath 1 ligand 1,PDCD1LG1,也称PD-L1)单抗。免疫检查点抑制剂可以减少肿瘤细胞免疫逃逸,但也可能因为过度激活免疫系统导致免疫相关性不良反应,免疫相关性肺损伤就是其中之一。临床研究显示,免疫相关性肺炎发病率为2%~20%[43-45],3级以上肺炎的发病率为0.4%~9.0%,与单药治疗相比,PD-1单抗/PD-L1单抗联合细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4)抑制剂可使免疫相关肺炎的发生风险增加近2倍[46]。此外,联合靶向药物或化疗药物,基础肺疾病及胸部放疗史也会增加免疫性肺损伤发生风险。
免疫相关性肺损伤的临床与影像学表现缺乏特异性,可出现干咳、呼吸困难、心动过速、胸痛、紫绀等临床表现,CT可表现为间质性肺炎、结节病等,需要与肺部感染、肿瘤淋巴管扩散、肺部病变进展等相鉴别。
1.3 放疗相关肺损伤
放射性肺损伤(radiation induced lung injury,RILI)是胸部肿瘤放疗患者常见不良反应,不同肿瘤放疗后放射性肺损伤的发生率差异较大。由于乳腺为胸廓外器官,放疗多采用切线野照射,因此,RILI发生率较低,为5%~15%[47],而现代治疗模式下有症状的放射性肺损伤发生率不超过5%[48]。
乳腺癌患者RILI发生的危险因素包括区域淋巴结照射、化疗、肺受照射体积及年龄。在放射治疗计划评估中,超过20 Gy照射的肺体积占全肺体积的百分比(V20)是评估放射性肺炎发生风险的重要参数,当V20≤20%时,放射性肺炎发生率为12.5%,当V20>20%时,放射性肺炎发生率可达28.4%[49]。区域淋巴结照射会明显增加患侧肺受照射体积,特别是锁骨上区放疗,增加放射性肺炎风险达5倍[50]。同步放化疗在乳腺癌辅助治疗中并不明显提高疗效,而胸部放疗同时使用紫杉类、吉西他滨化疗可明显增加放射性肺炎发生率,因此,放疗期间应避免同步化疗。此外,高龄患者放射性肺炎风险可能增加。
乳腺癌患者的RILI可以表现为两种形式,即急性放射性肺炎或晚期放射性肺纤维化。典型的急性放射性肺炎多发生在放疗结束后1~3个月,主要表现为气短、咳嗽、低热,极少有患者出现呼吸困难或低氧血症。急性放射性肺炎还有另外两种相对少见的形式,即机化性肺炎和放疗记忆性肺炎。机化性肺炎可以发生在放疗结束后的1年内,发生率为1.8%~2.9%[51-53],表现为放疗照射野外的渗出病变,经激素治疗后可完全缓解而不残留纤维化,但部分患者会在停用激素治疗后反复。目前认为,机化性肺炎不是放疗的直接损伤造成,而是放疗与机体免疫系统的相互作用导致。放疗记忆性肺炎见于放疗结束较长时间后,接受抗肿瘤药物治疗患者出现的既往照射野的肺部渗出性炎症,这种放射性肺炎的发生机制还不十分清楚,可能是放疗造成的肺泡细胞损伤,进一步的药物治疗可加重照射区损伤,超出肺组织的修复能力,从而出现临床肺炎表现。目前研究发现,容易引起放疗记忆性肺炎的药物包括蒽环类药物、吉西他滨、紫杉醇、曲妥珠单抗和依维莫司[54-57]。晚期放射性肺纤维化通常发生在放疗后6~24个月,多在2年时达到稳定状态[58]。研究显示,乳腺癌患者放疗后≥2级的放射性肺纤维化发生率仅为3%,在使用阿那曲唑和接受紫杉类药物化疗的患者中这一比例可达到29%,但这种晚期纤维化并不会影响患者的生活质量[59]。
2 放化疗相关性肺炎的病理改变
2.1 化疗药物
化疗药物诱导肺损伤的病理学变化有共同特点,主要表现为内皮细胞和上皮细胞变性,同时伴有多种多样的炎性反应及间质的改变。肺泡毛细血管损害表现为内皮细胞肿胀、液体渗入间质和肺泡间隔;Ⅰ型肺泡上皮细胞破坏脱落和Ⅱ型肺泡上皮细胞增生;淋巴细胞及粒细胞等多种炎性细胞的浸润,纤维母细胞及肌纤维母细胞增生,纤维素沉着。同时,化疗药物诱导肺损伤的病理学表现也有多样性,通常可以分为弥漫性肺泡损伤、非特异性间质性肺炎、细支气管闭塞性炎症合并机化性肺炎、肺出血、肺泡蛋白质沉积症及包括支气管痉挛的过敏性反应等[60]。
2.2 RILI
2.2.1 急性渗出期
RILⅠ的早期又称急性渗出期,超微结构研究表明,Ⅱ型肺泡上皮细胞和血管内皮细胞是受胸部照射影响的初始细胞,接受照射后1小时,Ⅱ型肺泡上皮细胞开始释放表面活性物质;2小时内,肺泡毛细血管内皮细胞遭破坏,毛细血管渗透性增加,随后肺泡毛细血管内皮细胞分离,并阻塞毛细血管腔,由于水肿和毛细血管充血,局部肺实质增厚。I型肺泡上皮细胞损坏脱落,裸露肺泡基底膜,肺泡内充满蛋白水肿液及脱落的肺泡上皮细胞、中性粒细胞、巨噬细胞和浆细胞。Ⅱ型肺泡上皮细胞受损导致肺泡表面活性物质释放减少及肺泡水肿,从而增加肺泡表面张力,在肺泡及远端小气道形成肺透明膜。因此,弥漫性肺泡损伤是由放射线照射所引起的急性组织病理学改变[61]。
2.2.2 中间期
中间期出现在放疗后2~9个月。研究表明,此时毛细血管被血小板、纤维蛋白、胶原蛋白阻塞,基底膜水肿,单核细胞数目增多,浆细胞、中性粒细胞广泛存在于毛细血管腔内;肺间质内淋巴细胞、巨噬细胞、浆细胞明显浸润;Ⅱ型肺泡上皮细胞增生。此外,还存在间质纤维细胞增生,胶原蛋白和弹性蛋白充斥肺间质。通常存在急性损伤的肺泡被修复,以便恢复肺实质的结构和功能。损伤中间期蛋白酶可降解细胞外基质,并使组织重构,肺泡上皮再生。残存的透明膜和细胞碎屑被肺泡巨噬细胞吞噬。放射性肺炎的中间期后期,可形成新的毛细血管网。此期,尽管炎性细胞浸润减少,但胶原蛋白产生增加,依据辐射损伤的严重程度不同,有可能会发展为放射性肺纤维化[62]。
2.2.3 纤维化期
大多数情况下,晚期放射性肺炎表现为肺纤维化,纤维化程度与RILI呈正比。肺纤维化的发病机制目前尚不清楚,但至少在某种程度上与局部释放的细胞因子和生长因子或对这些因子的受体进行调节有关。RILI纤维化期大约出现于放疗后6个月,通常有2年的稳定期。此期间肺间质内胶原蛋白产生增多,炎性细胞浸润减少;基底膜增厚,毛细血管通透性降低;新的毛细血管继续形成,但很少再通,整体来说,毛细血管数目减少。在肺纤维化阶段,肺泡严重变形,气体交换面积明显减少,Ⅰ型肺泡上皮细胞继续减少,而Ⅱ型肺泡上皮细胞可恢复正常大小和数目。最后,肺实质被紊乱的纤维化间隔替换[63]。
3 诊断
乳腺癌治疗相关肺损伤临床症状多样、不典型,辅助检查、临床影像学及病理表现无特异性,诊断困难。病史采集至关重要,包括肿瘤诊断治疗的经过,具体的用药史,用药前后症状、影像学的动态变化等。乳腺癌治疗相关肺损伤需明确以下五部分内容:①肿瘤治疗药物种类、疗程及剂量(包括累计剂量),放射治疗的类型、部位及剂量;②药物治疗或放射治疗至发病的时间;③停用可疑药物后临床症状是否缓解,再次应用是否加重;④影像学特征包括新发或原有病变部位、范围、类型的变化是否与可疑药物治疗周期或放射治疗的部位相符;⑤是否合并其他原发或继发性肺部疾病。
3.1 药物相关肺损伤
药物相关肺损伤多在治疗后4~12周内发病,临床症状可出现干咳、呼吸困难、胸痛、发热、乏力等。听诊可闻及双下肺爆裂音,偶尔也可闻及哮鸣音或湿性啰音,但多数患者缺乏肺部阳性体征。疑似出现药物相关肺损伤时,肺功能检查非常重要,弥散功能下降甚至可能在有症状前出现,肺功能通常表现为混合性通气功能障碍和弥散障碍,重症患者可出现低氧血症。
目前仍缺乏特异性血清标志物诊断肺损伤,外周血肺纤维化的生物标志物水平可升高,包括涎液化糖链抗原-6(krebs von den lungen-6,KL-6)、肺表面活性蛋白A(surfactant protein-A,SP-A)和肺表面活性蛋白D(surfactant protein-D,SP-D)。疑似肺损伤的患者应行支气管镜检查及支气管肺泡灌洗,有助于诊断及鉴别诊断,最常见的特征是支气管肺泡灌洗液(broncho alveolar larage fluid,BALF)中淋巴细胞增高,尤其是CD8+淋巴细胞增多,伴或不伴中性粒细胞和(或)嗜酸粒细胞增高[64]。
药物性肺损伤影像学可表现为“同药异像、同像异药”,根据肺损伤的病理类型,常见影像学特征符合以下五种类型:非特异性间质性肺炎、弥漫性肺泡损伤、机化性肺炎、过敏性肺泡炎及嗜酸细胞性肺炎,此外,还可见到弥漫性肺泡出血、非心源性肺水肿、肺动脉高压、胸腔病变、小气道病变、肺静脉闭塞性疾病、肺纤维化等征象[65-66]。
3.2 放疗相关肺损伤
国内对于症状性放射性肺炎的诊断标准共识包括以下两个方面:①必须同时具备的条件,既往肺受照射病史,多发生于从放疗开始后6个月内;CT影像学改变主要为局限在照射区域内的斑片影、通气支气管征、条索影、肺实变影或蜂窝样改变,少数患者除存在照射区域内改变外,同时还伴有放射区域外的相应影像学改变;至少有咳嗽、气短、发热等临床症状之一,且上述症状为放疗后新出现、或较前加重、或经放疗减轻、或消失后重新出现或加重,咳嗽最为常见,其次为气短,轻者为活动后气短,重者平静呼吸时亦觉气短,约半数患者伴有发热;排除上述症状由下列因素所致:肿瘤进展、肺部感染(细菌、真菌或病毒)、慢性阻塞性肺疾病急性加重、心源性疾病、肺梗死、贫血、药物性肺炎等。②其他具有一定价值的诊断参考信息,患者的肺部体征多无明显特异性,最常见表现为呼吸音粗糙,其他包括干啰音、湿啰音、呼吸音减低;血象多表现为中性粒细胞百分比高于正常值,白细胞总数多无明显升高;C反应蛋白、血清乳酸脱氢酶(lactic dehydrogenase,LDH)、血沉等可能升高;轻者仅在剧烈活动时测得动脉血氧分压下降,症状严重者静息时即可能测得血氧分压下降;与治疗前基线水平相比,肺功能异常主要表现为弥散功能减低,也可伴有肺容量降低,肺通气功能降低,呼吸频率增加。此外,在通气动力学方面,可见肺顺应性降低,小气道阻力增加[67]。
3.3 鉴别诊断
3.3.1 心源性肺水肿
常见于高血压性心脏病、冠状动脉粥样硬化性心脏病、瓣膜病、心肌病等引起的左心衰竭。可表现为呼吸气促、端坐呼吸、咳嗽、咳白色或粉红色泡沫痰,双肺可闻及广泛水泡音,X线显示两肺透亮度下降、Kerley线及双肺门蝶形阴影。部分化疗药物可导致心肌损害,化疗期间液体负荷增加等均可诱发急性左心衰竭,需结合病史、脑钠肽检测、心电图、心脏超声及影像学检查进行鉴别[68-69]。
3.3.2 急性肺栓塞
肿瘤患者属于肺栓塞高危人群,发生呼吸困难时应注意与肺栓塞鉴别,D-二聚体具有排除诊断意义,特征性影像学表现为区域性肺纹理减少、马赛克征、出现肺梗死时可见尖端指向肺门的楔形阴影,必要时应行CT肺动脉造影、放射性核素肺通气/灌注扫描和肺动脉造影检查[70]。
3.3.3 肺部感染
肿瘤患者放化疗期间,机体免疫功能下降,常继发肺部感染,包括细菌性肺炎、病毒性肺炎、真菌感染及结核分枝杆菌感染,一般有发热、咳嗽、咳痰等呼吸道症状,重症患者可出现呼吸困难、低氧血症。胸部影像学表现有时难以与肺损伤鉴别,除完善血液炎性指标(如血常规、C反应蛋白、降钙素原、血沉)及特异性病原学检测(如痰/血培养、血清抗原、抗体检测、γ-干扰素释放试验、G试验、GM试验、聚合酶链反应)外,必要时行支气管肺泡灌洗行病原学检测,对鉴别诊断至关重要[71]。
3.3.4 其他间质性肺疾病
弥漫性肺间质改变是常见的肺损伤,临床上需与其他间质性肺疾病进行鉴别,如特发性间质性肺炎、胶原血管病相关肺病、肉芽肿性疾病、肺泡出血综合征等,应详细询问患者的职业接触史、其他用药史,是否合并其他系统(如皮肤、关节、肌肉、肾脏、神经系统等)受累的表现,完善相关血清学自身抗体检测,鉴别困难时需进行组织活检以明确诊断[72]。
3.3.5 肺恶性肿瘤
胸部影像学出现新发病变,如磨玻璃样渗出、间质改变、多发斑片状或实变影、肿块或结节影、胸腔积液、心包积液等,应警惕原发肿瘤进展出现肺、胸膜转移或原发性肺癌的发生,若同时伴有肿瘤标志物水平升高,正电子发射计算机断层显像(position emission tomography,PET)-CT提示高代谢病灶,必要时组织活检进行鉴别[73]。
3.4 诊疗流程
乳腺癌相关肺损伤具体的诊疗流程见图1。
4 治疗
4.1 药物相关肺损伤的治疗
首先停用引起肺损伤的药物;症状轻微、影像学及肺功能轻度异常的患者,给予甲强龙口服治疗10.0~20.0 mg/d或0.2~0.3 mg(/kg·d),病情缓解后逐渐减量,疗程2~4周;呼吸困难明显或影像学表现较重的患者,给予甲强龙40~80 mg/d或0.5~1.0 mg(/kg·d),症状缓解后每2周减量10 mg,从20 mg开始,每周减少5 mg直至停止;激素治疗同时应预防性应用抗肺孢子菌肺炎及真菌感染的药物。免疫抑制药物(如硫唑嘌呤)可作为糖皮质激素不耐受或治疗效果不佳的备选药物[74]。病情较轻、经治疗症状完全缓解、影像学吸收后需再次应用化疗药物时,可考虑同时服用小剂量皮质激素(如泼尼松10~20 mg/d);肺损伤较重,应避免再次应用引起肺损失的化疗药物。药物性肺损伤患者的预后差异较大,大部分患者可完全恢复;出现呼吸衰竭、肿瘤进展或糖皮质激素治疗的不良作用(如机会感染)可引起患者死亡。
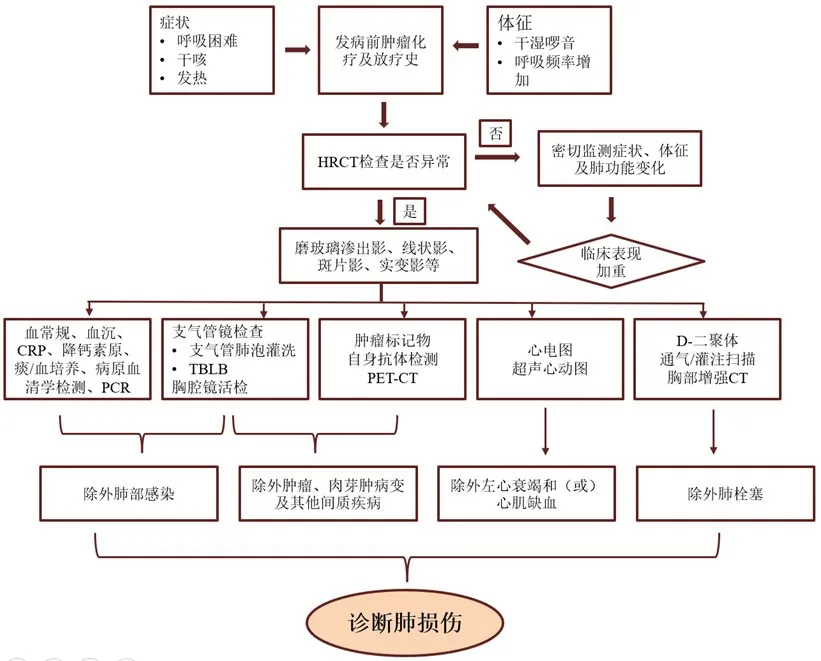
图1 乳腺癌相关肺损伤的诊疗流程
4.2 放射性肺损伤的治疗
放射性肺炎症状轻微时,建议临床观察,也可以考虑给予吸入糖皮质激素。症状明显的放射性肺炎可应用全身糖皮质激素治疗[75]。推荐用法:起始2~4周给予泼尼松40~60 mg或0.5~1.0 mg/(kg·d);然后逐渐减量,疗程8~12周[76]。糖皮质激素不耐受或难治性患者,可以考虑应用免疫抑制药物,如硫唑嘌呤和环孢菌素[77-78]。氨磷汀等放射保护药物可降低放射性肺炎的发生率,但不良反应较明显[79]。放射性肺纤维化糖皮质激素无效,应避免使用。吡非尼酮、尼达尼布等药物治疗放射性肺纤维化的疗效仍需大型随机临床试验证实[80-81]。经治疗的放射性肺炎患者总体预后较好,症状可完全缓解,肺功能可逐渐恢复,但部分患者可进展至肺纤维化,晚期出现肺动脉高压、肺源性心脏病。放射性肺损伤的预防:严格掌握放疗适应证,避免不必要的区域淋巴结照射;避免放疗期间同时使用增加肺损伤的药物;运用静态调强技术(intensity modulated radiotherapy,IMRT)、容积旋转调强技术(volumetric modulated arc therapy,VMAT)等精确放疗技术及俯卧位、深吸气末屏气等治疗形式,尽量减少肺受照射体积。
