水杨酸长期注射对老年性耳聋的防护作用
2020-08-26李胜利武坤毅姬媛媛任晓勇
李胜利武坤毅姬媛媛任晓勇
1西安交通大学第二附属医院科研中心实验室,710004
2西安交通大学第二附属医院耳鼻咽喉头颈外科,710004
临床和实验研究证明,阿司匹林在听力学方面的影响具有矛盾性,大剂量的阿司匹林使用具有耳毒性,导致不可逆性耳聋和耳鸣发生[1],同样也发现大剂量的阿司匹林具有衰减人类庆大霉素造成的耳毒性[2,3]。大样本的临床观察发现阿司匹林应用于62261例女性后,不增加听力损失率[4],而在26917例男性应用中则证明有听觉损害的发生[5]。在噪声性聋研究方面,已证明阿司匹林可减少耳蜗自由基的产生[6],可以抵抗噪声导致的耳蜗毛细胞损失[7];而目前的临床追踪研究表明低剂量的阿司匹林可以延缓老年性耳聋的发展进程[8]。而有些实验研究表明无论是低剂量还是大剂量的水杨酸,均可导致耳鸣产生,已证明水杨酸通过耳蜗和中枢途径来影响听觉系统[9]。水杨酸在耳蜗途径的初期是下调外毛细胞膜的Prestin蛋白活性而导致听力损失,长期应用则上调Prestin蛋白活性,增加其表达而导致耳鸣发生[10]。更为重要的是,水杨酸具有靶向性调控耳蜗外毛细胞prestin蛋白表达的作用[11],故成为耳聋耳鸣研究中的热点领域。我们拟通过应用不同剂量的水杨酸给年龄相关听力损失DBA/2J小鼠腹腔长期注射,观察对耳蜗外毛细胞马达蛋白---prestin的表达水平的影响,同时观察注射前后对听功能的改变,以及对耳蜗毛细胞存活的影响,并探讨不同剂量水杨酸对耳蜗抗凋亡基因Bcl-2和促凋亡基因Caspase-3表达的影响,明确对老年性聋治疗的最佳剂量,为临床应用提供依据。
1 材料与方法
1.1 实验动物
实验动物DBA/2J近交系小鼠,购买于南京模式动物研究所,动物品系编号为J000671,选用动物4周龄(W)DBA/2J小鼠,每组10~15只,雌雄各半,共使用60余只小鼠。
1.2 听功能测定方法
小鼠称重后用0.75%戊巴比妥钠(0.1mg/kg)麻醉,听觉诱发电位仪测定听觉诱发点位(ABR)用美国Inteligent Hearing Smart仪器测定。把针电极插入颅顶为记录电极,两侧耳垂皮下插入参考电极,鼻尖逆向插入接地电极。Click为刺激声,刺激率19.1/ms,高通300,低通3000,平均叠加250~500次,具体方法参照Li等[12]的方法。
1.3 水杨酸治疗方法
4周龄的DBA/2J近交系小鼠50只,随机分成5组,每组10只,依次为水杨酸100mg,150mg,200mg和250mg/kg注射组,对照组为同容量生理盐水注射。水杨酸(Sodium salicylat,Lot#SLBQ9170V,SIGMA)用生理盐水配制,动物按每公斤体重毫克的(mg/kg)上述的剂量每天腹腔注射一次,对照组注射生理盐水,连续注射30天。实验前后测定动物的ABR阈值[11,12]。
1.4 耳蜗铺片及毛细胞计数方法
耳蜗铺片及毛细胞计数按发表文献[13]进行。
1.5 扫描电镜观察
按上我们以前的方法制备耳蜗电镜样品[13],在德国FEI Verios 460 L XHR SEM超高分辨率扫描电子显微镜系统上观察拍照。
1.6 全耳蜗铺片prestin抗体染色
基本方法参照已发表文献[11,12]。
1.7 耳蜗基底膜全蛋白提取和蛋白印迹实验(Western blotting)
基本方法参照已发表文献[11,12]。
1.8 荧光定量PCR
耳蜗组织总RNA抽提用无RNA酶的枪头和离心管。把匀浆管标记好后,加入1ml的Trizol Reagent,并置于冰上预冷。在冰上分离出整体耳蜗基底膜组织,去除多余的粘附的血管纹或螺旋韧带组织,加入到标记好的匀浆管中。用匀浆机充分研磨直至无可见组织块,因耳蜗组织有骨螺旋板骨质,更要充分研磨。在4℃离心机上12000rpm离心10分钟后,取上清液加入标记好的离心管中,并参照文献进行定量PCR检测[11,12]结果处理采用ΔΔCT法:
A=CT(目的基因,待测样本)-CT(内标基因,待测样本)
B=CT(目的基因,对照样本)-CT(内标基因,对照样本)
K=A-B
表达倍数=2-K
引物名称及序列如:M-GAPDH-S:CCTCGTCCCGTAGACAAAATG,M-GAPDH-A:TGAGGTCAATGAAGGGGTCGT;M-BCL2-S:TGACTTCTCTCGTCGCTACCGT,M-BCL2-A:CCTGAAGAGTTCCTCCACCACC;M-CASP3-S:GTCTGACTGGAAAGCCGAAAC,M-CASP3-A:GACTGGATGAACCACGACCC。退火温度均为60℃。
1.9 统计分析
采用GraphPad Prism软件,比较组与组之间单个点的差别采用t检验或Mann-Whitney检验,比较两个实验组在一个或一个以上变量下多个点(不同时间)之间的差别使用ANOVA。各实验均重复3次或以上,非变量数据使用Mann-Whitney检验分析,多变量使用方差(ANOVA)分析,应用Graph-Pad prism软件进行统计分析。以P<0.05为差异有统计学意义
2 实验结果
2.1 ABR反应阈值的改变
水杨酸长期慢性注射治疗30天后,200mg治疗组的效果最好,ABR反应阈值较治疗前没有差异,而其它各组的ABR反应阈值较治疗前均有上升,各组动物实验前和不同剂量水杨酸注射30天后ABR阈值改变情况。可见200mg/kg水杨酸注射组ABR阈移实验前后没有明显改变,而100mg/kg,150mg/kg和250mg/kg水杨酸注射组及生理盐水注射组的ABR阈移改变明显,具有统计学显著差异(P<0.01)其ABR反应阈值治疗前与治疗后的阈移差值依次分别为:200mg治疗组-0.37dBSPL,100mg治疗组 11.15dBSPL,250mg治疗组 12.68dBSPL,150mg治疗组16.72dBSPL(图1)。
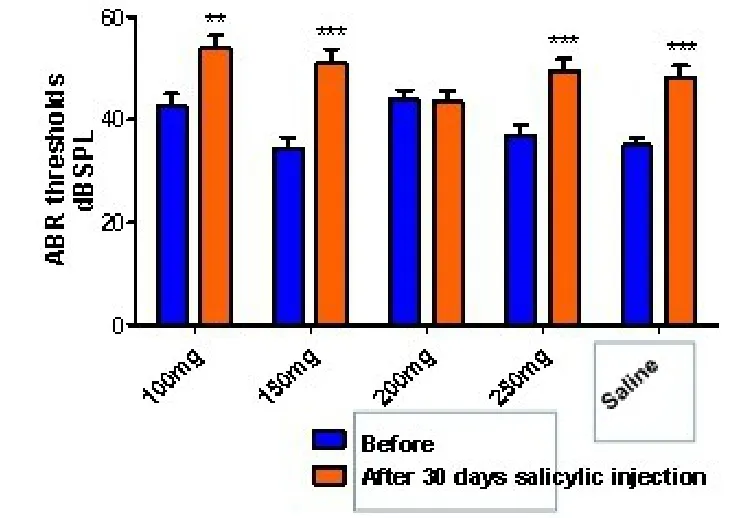
图1 各组动物实验前和不同剂量水杨酸注射30天后ABR阈值改变情况。200mg/kg水杨酸注射组ABR阈移实验前后无明显改变,而100mg/kg,150mg/kg和250mg/kg水杨酸注射组及生理盐水注射组的ABR阈移改变明显,具有统计学显著差异(*P<0.01)。Fig.1 Changes of ABR threshold before and 30 days after salicylic acid injection in each group.There was no significant change in ABR threshold shift before and after the 200mg/kg salicylic acid injection group,while there were significant changes in ABR threshold shift in the 100mg/kg,150mg/kg,250mg/kg salicylic acid injection group and normal saline injection group(*P<0.01)
2.2 全耳蜗毛细胞观察计数结果
耳蜗铺片观察可见200mg治疗组的毛细胞存活百分率最好,表现为耳蜗顶回OHCs,IHCs基本存活,基底膜上的毛细胞基本完好,无散在性缺失;中回OHCs大部分存活,仅有少部分消失;基底部仍有30%外毛细胞存活,IHC有50%的存活。其次为100mg治疗组,耳蜗顶回OHCs,IHCs基本存活,基底膜上的毛细胞基本完好,无大量缺失;中回约50%OHCs存活;基底部仍有20%外毛细胞存活,IHC有40%的存活。而150mg组,耳蜗顶回OHCs,IHCs基本存活,基底膜上的毛细胞基本完好,无大量缺失;中回约50%OHCs存活;基底部无毛细胞存活,IHC已基本消失。250mg治疗组较差,耳蜗顶回OHCs,IHCs有散在消失;中回约70%OHCs,IHC存活;基底部无毛细胞存活,IHC已基本消失。盐水对照组毛细胞损失较250mg/kg水杨酸注射组为轻,耳蜗顶回OHCs,IHCs有散在消失;中回上部约50%OHCs,IHC存活,下部已基本消失;基底部无毛细胞存活,IHC已基本消失,说明250mg/kg水杨酸注射更严重影响毛细胞的存活。比较100mg/kg,200mg/kg剂量水杨酸注射30天组和生理盐水组的耳蜗内外毛细胞存活百分率统计分析,可见从耳蜗顶部到基底部OHC1存活率明显降低,在顶到中部200mg/kg组的OHC1存活率较其它两组明显高,而到基底部三组的OHC1存活率均非常低(图2B,C);100mg/kg和200mg/kg组OHC2存活率在耳蜗顶到中上回较高,虽在基底回上部存活较少,但比盐水对照组高;OHC3的表现基本与OHC2相似;最大差别是IHC,在耳蜗顶上端三组基本没有差别,而在中回100mg/kg和200mg/kg组的IHC存活率显著的高于盐水对照组,基底回亦如此。全耳蜗铺片三排外毛细胞记数用存活的总平均值从顶端到基底端分点制图(图4)。
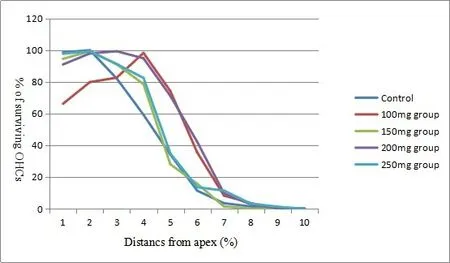
图2 全耳蜗铺片三排外毛细胞记数用存活的总平均值从顶端到基底端分点制图。水杨酸注射组有100mg/kg,150mg/kg,200mg/kg和250mg/kg四组及盐水对照组。可见顶端部位OHC存活最少的是100mg/kg组,其他四组均较好;而中回区的OHC存活有显著差别出现在100mg/kg和200mg/kg组,其它三组的OHC存活率均较前两组明显低;基底部五组之间基本没有太大差别。Fig.2 The cochlear hair cells count results shown that 200mg/kg group was a better protective effect for apex turn no hair cells loss,middle turn was less loss and basal turn have a moderate loss.150mg/kg and 250mg/kg groups was showed significant differences of hair cells loss.However,the animals with receiving normal saline group hair cells became significantly deteriorated to the terminal point of the experimental time course.
2.3 扫描电镜观察
扫描电镜观察1月龄DBA/2J小鼠耳蜗中回外毛细胞(OHC),可见静纤毛束(stereocilia,S)排列整齐、完整,无散乱、倒伏和融合消失,表皮板完整(P)。3月龄的DBA/2J小鼠耳蜗中回和顶回(外毛细胞(OHC),可见静纤毛束(S)呈退行性改变,静纤毛倒伏和融合消失,表皮板不够完整或萎缩(P)。扫描电镜观察100mg/kg和150mg/kg水杨酸注射组耳蜗毛细胞存活和损害消失情况。100mg/kg组耳蜗顶回内外毛细胞无损害消失(图3A),中回OHC有散在消失(图3B),而底回内外毛细胞损害消失教多(图3C);150mg/kg组耳蜗顶回有散在的OHC消失(图3D),中回内外毛细胞损害消失很少(图3E),而基底回外毛细胞损害消失主要在第3排(图3F);盐水对照组耳蜗顶回OHC存留较少,大量的OHC消失(图3G),而中回和基底回的OHC基本消失,IHC亦有散在消失。星号和箭头指向OHC和IHC消失部位。扫描电镜观察观察200mg/kg和250mg/kg水杨酸注射组及生理盐水注射组耳蜗毛细胞存活和损害消失情况。200mg/kg组耳蜗顶回基本无内外毛细胞损害消失(图4A),中回内外毛细胞约损害消失仅为散在性(图4B),基底回损害OHC约占30%(图4C),整体耳蜗静纤毛束排列整齐、完整;250mg/kg组耳蜗顶回有散在的外毛细胞(OHC)消失(图4D),中回OHC损害消失约70%,静纤毛有散乱和融合现象(图4E),而基底回内外毛细胞损害严重,仅有个别内外毛细胞存活,静纤毛有散乱和融合现象更严重(图4F);生理盐水对照组的耳蜗各回内外毛细胞损害消失的情况较250mg/kg组更严重(图4G-I)。
2.4 耳蜗全基底膜行免疫组化prestin表达标记
耳蜗全基底膜行免疫组化prestin表达标记可见,150mg治疗组和200mg治疗组的prestin表达荧光最强,其次是100mg治疗组prestin表达较弱,而250mg治疗组和盐水组prestin表达更弱。耳蜗各回的prestin表达荧光强度差别不大。毛细胞消失情况基本与prestin表达的的强弱有关(图5,6)。
2.5 Western Blotting蛋白印痕测定和全耳蜗RNA提取RT-PCR测定
Western Blotting蛋白印痕测定耳蜗prestin蛋白表达量,可见随水杨酸注射剂量的增加,耳蜗OHC中prestin表达的量逐步升高,而盐水对照组prestin表达量与各剂量的水杨酸组相比均较低(图6)。全耳蜗RNA提取RT-PCR测定抗凋亡基因Bcl-2和促凋亡基因Caspase-3,总体上水杨酸注射的各剂量组均较盐水对照组,显示150mg组的Bcl-2水平最高,其次是100mg组和250mg组,200mg组较其它三个水杨酸组水平较低(图7);促凋亡基因Caspase-3水平盐水对照组最高,而随着水杨酸注射剂量的升高各组呈现出逐步下降趋势,表现为Caspase-3水平随杨酸注射剂量的升高而出现明显的负向相关性(图8)。

图3 扫描电镜观察100mg/kg和150mg/kg水杨酸注射组3个月后,耳蜗毛细胞存活和损害消失情况。两组实验动物耳蜗毛细胞顶回和中回内外毛细胞损害消失很少,底回有散在消失(A-F,白色星号),而饮水对照组耳蜗整体有大量的内外毛细胞消失(G-I,白色星号)。Fig.3 Scanning electron micrographs were observed on 100mg/kg and 150mg/kg groups of were use long-term salicylate injection after three mouth.The apical cochlear region,the stereociliary bundles are already well formed on both the row of inner hair cells(IHC)and outer hair cells(OHC)then control groups,the middle cochlear region of the organs of Corti have a normal appearance and show less miss of OHC(white stars),but the basal cochlear region both types of hair cell are ni throughout the cochlea(white stars)than control groups(G-I).
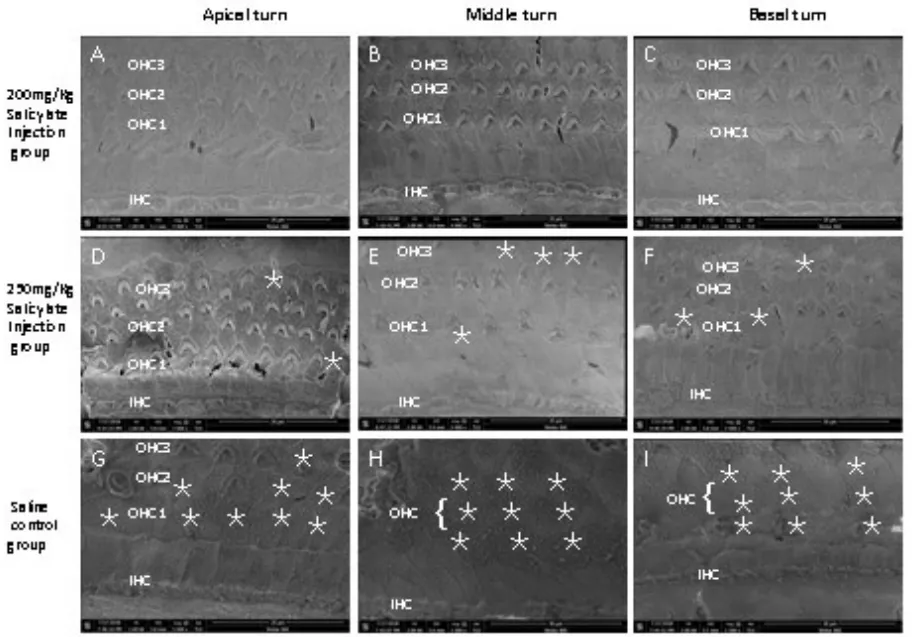
图4 扫描电镜观察观察200mg/kg和250mg/kg水杨酸注射组及生理盐水注射组耳蜗毛细胞存活和损害消失情况。200mg/kg水杨酸长期注射组3个月后,耳蜗三排外毛细胞(OHC1,OHC2,OHC3)和内毛细胞(IHC)基本存在(A-C),250mg/kg注射组耳蜗整体有较多的OHC消失(D-F,白色星号),而而饮水对照组耳蜗整体有大量的内外毛细胞消失(G-I,白色星号)。Fig.4 Scanning electron micrographs were observed on 200mg/kg and 250mg/kg groups of were use long-term salicylate injection after three mouth.The apical cochlear region,the stereociliary bundles are already well formed on both the row of inner hair cells(IHC)and outer hair cells(OHC)then control groups,the middle cochlear region of the organs of Corti have a normal appearance and show less miss of OHC(white stars),but the basal cochlear region both types of hair cell are loss in tow groups is less(white stars)than control groups(G-I).
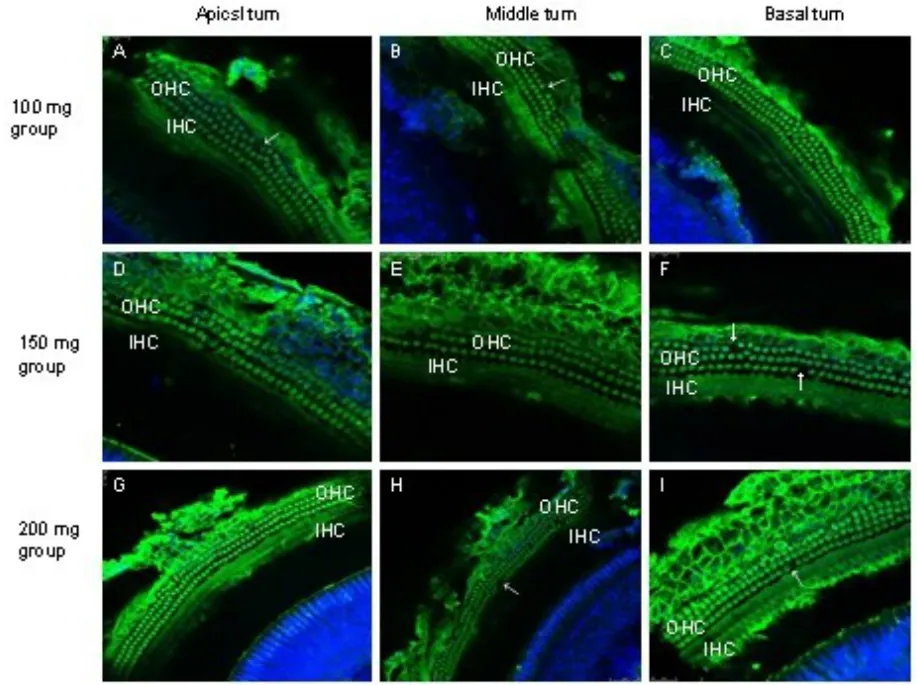
图5 耳蜗全基底膜行免疫组化prestin表达标记,可见100mg(A-C),150mg(D-F)和 200mg(G-I)水杨酸治疗组的OHC prestin荧光表达强度随水杨酸用药量的增加而增强,100mg水杨酸治疗组OHC prestin表达较后两组弱。箭头所指为OHC消失。Fig.5 Immunofluorescent staining of DBA/2J mice OHCs for prestin in situ whole-mount preparation,salicylate application for 30 day after 200mg/kg group OHC shown strong staining of prestin,100mg/kg and 150mg/kg groups OHC was more weaken of prestin staining,250mg/kg group OHC was showed sighificantly lower of prestin staining then saline control group.
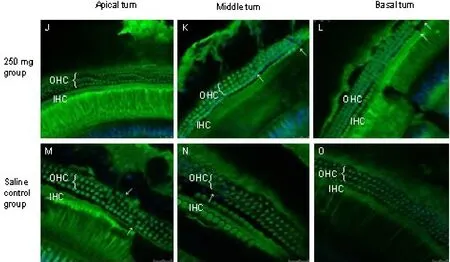
图6 耳蜗全基底膜行免疫组化prestin表达标记,250mg水杨酸治疗组(A-C)和盐水对照组(D-F)OHC prestin表达叫前三组更弱。耳蜗各回的prestin表达荧光强度差别不大。毛细胞消失情况基本与prestin表达的的强弱有关。Fig.6 Immunofluorescent staining of DBA/2J mice OHCs for prestin in situ whole-mount preparation,salicylate application for 30 day after 250mg/kg group OHC shown OHC was more weaken of prestin staining(A-C),250mg/kg group OHC was showed sighificantly lower of prestin staining then saline control group(D-F).
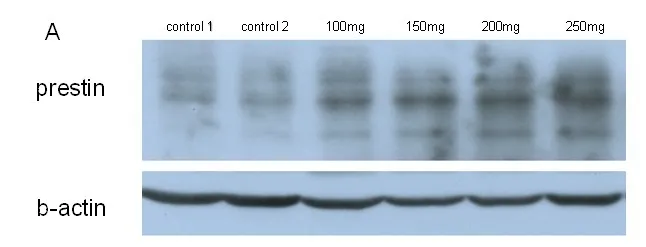
图7 Western Blotting蛋白印痕测定耳蜗prestin蛋白表达量,可见随水杨酸注射剂量的增加,耳蜗OHC中prestin表达的量逐步升高,而盐水对照组prestin表达量与各剂量的水杨酸组相比均较低。Fig.7 Western blot of the cochlea for prestin.Low-dose to high-dose salicylate have bee showe to selectively increase the OHCs prestin expression then control group.
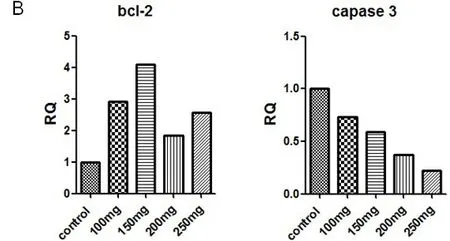
图8 全耳蜗RNA提取RT-PCR测定抗凋亡基因Bcl-2和促凋亡基因Caspase-3,总体上水杨酸注射的各剂量组均较盐水对照组,显示150mg组的Bcl-2水平最高,其次是100mg组和250mg组,200mg组较150mg组水杨酸水平较低(A);促凋亡基因Caspase-3水平盐水对照组最高,而随着水杨酸注射剂量的升高各组呈现出逐步下降趋势,表现为Caspase-3水平随杨酸注射剂量的升高而出现明显的负向相关性(B)。Fig.8 RT-PCR data showed that 150mg/kg aspirin group used DBA/2J mice cochlear appeared significantly higher expression of mRNA expression of Bcl-2,an ant-apoptotic gene,compared to the other groups mice,while it had sigificantly lower pro-apoptotic gene caspase-3 in the 250mg/kg,showen salicylate dose-selective effect.
3 讨论
3.1 水杨酸的剂量选择性
本实验观察发现,在给DBA/2J小鼠腹腔注射水杨酸在100至250mg/kg的不同剂量组中,耳蜗生理和病理表现具有明显的差异。最显著的变化是耳蜗听觉功能的差异和毛细胞形态及Prestin蛋白表达,实验结果表明,无论是耳蜗听觉功能的改善,还是耳蜗毛细胞存活率,以及Prestin蛋白表达,200mg组是最好的,其次是150mg组,而250mg组的效果最差(图1-4)。这些实验结果表明,应用水杨酸注射在耳蜗生理及病理中存在剂量依赖性改变。以前的研究亦证明大剂量的水杨酸可导致耳聋和耳鸣的发生,水杨酸的注射剂量基本在200mg是一个分界线,超过200mg剂量被认为是大剂量的应用,而低于200mg时被认为是低剂量的应用。许多以前的实验也基本证明了这种分类。大剂量的水杨酸可造成耳蜗及听觉中枢病理性损伤,而低剂量的水杨酸对耳蜗及听觉中枢具有保护性功能。以往在耳鸣的研究中发现,系统使用200mg/kg水杨酸不会导致听神经纤维的SFR改变[14],而使用400mg/kg水杨酸则可以使其发生改变[15]。Lecain等(2007)发现10或100mg/kg/day阿司匹林抵抗早期的阿米卡星耳毒性而保护毛细胞和螺旋神经元,证明对毛细胞没有毒性[16]。已经证明阿司匹林在耳蜗外淋巴液中的浓度是血清的30%,产生了永久性和不可逆的听觉阈移[17],这种改变已报道是220mg/kg的大剂量阿司匹林静脉注射或300mg/kg的水杨酸腹腔注射造成的[18,19]。已知水杨酸具有剂量依赖的耳毒性,在研究庆大霉素耳毒性中证明100 mg/kg的水杨酸钠皮下注射,可以减少80%庆大霉素造成的耳蜗外毛细胞损伤[8]。在研究给大鼠皮下注射水杨酸钠开始两天之前给予3天的顺铂,剂量为16 mg/kg/day,同样皮下注射,耳保护作用可观察到基本的电生理BAEP测量,与对照组相比,有显著的外毛细胞减少[20]。然而,这些改变也没有在100 mg/kg/day水杨酸治疗的3天组观察到,如文献报道的同样水杨酸剂量[8,20,21]。水杨酸钠显示耳保护作用指征为抵抗顺铂造成的耳蜗解剖上的外毛细胞损害,这种保护是有限的,而对这些细胞的功能状态无保护指征[22]。Jiang等证明300 mg/kg的水杨酸腹腔注射,产生20-30dB的CAP阈移[23]。我们的实验结果亦证明水杨酸对老年性聋的预防和治疗作用是有限的,仅能部分保护听觉功能和耳蜗毛细胞存活。要完全阻止老年性聋的听功能下降和毛细胞退变,尚需结合其它方法联合预防和治疗。通过上述文献的分析比较,结合本实验结果,基本可以认同200mg/kg水杨酸是听力学研究中损害或保护的剂量分界线。
3.2 水杨酸钠剂量选择性对耳蜗毛细胞Prestin蛋白表达的影响
国内于宁等察到prestin分布于外毛细胞膜中最外的质膜层上,基底膜亦有表达[24]。赵宁等[25]实验发现氨基糖甙类耳毒性药物持续暴露导致prestin过表达,可能参与致聋过程。黄治物等[26]研究发现慢性水杨酸钠注射后通过上调prestin基因mRNA及其蛋白的表达使外毛细胞能动性增加可能是其引起耳鸣的机制之一。张博等[27]发现水杨酸钠影响prestin在毛细胞底部分布的变化是导致听力下降的原因。而陈秉等[28]的实验证明强噪声暴露导致prestin蛋白表达上调,与耳蜗毛细胞损失程度有关。这些研究亦同样证明感音神经性聋和耳鸣均与prestin的表达改变有密切关系。罗璇等[29]综述了耳蜗OHC的Prestin蛋白调控机制的研究现状,认为Prestin蛋白不仅在感音性聋的发生机制中具有重要作用,而且对感音性聋的修复具有一定的潜在价值。
我们前期的研究发现,老年性聋小鼠的耳蜗外毛细胞prestin的表达下降,推测prestin蛋白改变可能是导致老年性聋的机制之一[11],设想在上调耳蜗外毛细胞prestin的表达后,可否能够阻止或延缓老年性聋发展,而在选择上调耳蜗外毛细胞prestin的表达靶向药物方面,我们查阅大量文献发现水杨酸具有这种功能。前期的许多研究者推测水杨酸对外毛细胞影响产生的永久性听力损失,许多实验研究证明大剂量的水杨酸明显上调耳蜗外毛细胞的prestin表达,被认为是产生耳鸣的主要机制之一。Yu等[34]发现长期应用水杨酸可以增加Prestin mRNA和蛋白表达水平,上调Prestin的表达并增加OHC的电致运动,促进了耳蜗的主动机制,增加DPOAE幅度,反转Prestin的作用并促进其表达[10]。在本研究中,我们观察到200毫克水杨酸长期注射,可以明显提高耳蜗外毛细胞prestin的表达,其次是100 mg的水杨酸注射,而250mg的水杨酸注射在上调耳蜗外毛细胞prestin的表达同时,对耳蜗毛细胞和听功能的损伤也明显存在(图5-7)。这也和以前的许多实验发现相同。
通过本实验研究,我们认为这主要是要选择合适的水杨酸使用剂量,大剂量的水杨酸在提高耳蜗毛细胞prestin的表达量的同时,对耳蜗毛细胞和听功能亦造成损害,而低剂量的水杨酸在提高耳蜗毛细胞prestin的表达量的同时,对耳蜗毛细胞和听觉功能具有保护作用。基本明确200毫克的水杨酸剂量是耳蜗损伤或保护作用的分水岭。
3.3 水杨酸钠剂量选择性对老年性聋的治疗效果及机制
在水杨酸应用方面,以前的研究者主要是按传统的水杨酸治疗血管疾病和抗炎症的功效来使用,有些研究亦证明水杨酸的抗氧化自由基作用[8]。Tavanai和 Mohammadkhani过对年龄相关性聋(ARHL)的文献综述,认为靶向性作用于细胞死亡通路较靶向性仅抗氧化应激途径更好[30]。Lowthian等过大样本的阿司匹林对老年性聋的预防追踪观察,认为低剂量阿司匹林对ARHL的作用机制是抗炎症和微血管的有效影响[8]。而老年性耳聋的病理机制中,这些因素也是重要的方面。通过本研究,似乎更明确了水杨酸的作用靶向分子是耳蜗外毛细胞特异表达的prestin蛋白。通过我们的系列研究可以初步认为prestin蛋白表达下调使毛细胞的细胞膜结构的构象发生改变,破坏了毛细胞膜的完整性,首先使外毛细胞的主动运动功能减退或丧失,从而导致耳蜗放大器功能和听觉频率分辨率下降或丧失;其次是外毛细胞膜的完整性破坏导致的凋亡过程发生,外毛细胞膜结构的构象发生改变后,细胞膜上的凋亡受体被激活,启动了毛细胞的凋亡程序,促进Caspase途径的级联反应,通过反馈环路抑制了抗凋亡基因的表达,最终使毛细胞大量凋亡,使听觉功能丧失,而发展为老年性耳聋。我们的实验发现老年性聋小鼠的耳蜗Caspase-3基因上调和Bcl-2基因下调,而应用水杨酸后可以明显逆转这种过程的发生(图8),但Bcl-2基因表达水平与水杨酸注射剂量间的关系可能更为复杂。上述结果为我们的理论假设提供了初步的依据。进一步的研究需要明确prestin蛋白表达下调,使毛细胞的细胞膜结构的构象发生改变超微结构形态证据,以及Caspase-3基因上调和Bcl-2基因下调与prestin蛋白表达确切关系和信号途径,更为重要的是找到能够逆转这种过程的靶向分子,从而为老年性聋的治疗提供技术路线和有效方法。
