强化发酵对诺丽果成分的影响及抗氧化活性研究
2020-08-17赵文谨谢云飞姚卫蓉郭亚辉成玉梁
王 越,赵文谨,谢云飞,姚卫蓉,郭亚辉,成玉梁,钱 和
(江南大学食品学院,江苏无锡 214000)
在夏威夷和波利尼西亚地区,传统医学从业者用诺丽果(MorindacitrifoliaL. Noni)治疗或预防各种疾病已经有两千多年的历史[1]。诺丽果实含有200多种植物化学物质,其中多酚类、蒽醌类和黄酮类等活性物质在诺丽果的生物活性方面起着关键作用,但在不同品种中其含量差异显著[2-3]。如今,诺丽果越来越多的药用价值和保健功能被证实,例如抗菌、抗肿瘤、抗寄生虫、镇痛、降压、抗炎和增强免疫力等[4-6]。因此,诺丽果也迅速成为世界药用植物和保健类产品的新宠。成熟的诺丽鲜果具有强烈的刺激性气味,不适宜直接食用,所以出现多种多样的诺丽果加工形式,如诺丽冻干粉、诺丽果干、诺丽发酵果汁等,其中发酵果汁逐渐成为其主要应用形式[1,7]。
目前,诺丽果的发酵生产大多沿用波利尼西亚传承下的古老方式,即将洗净的诺丽果放在密封的发酵容器中,利用诺丽果自身所带微生物在室温下进行自然发酵,静置发酵三个月到一年甚至更长时间[2,4]。近些年也出现一些其他诺丽果汁发酵方式,如Wang等[8]利用不同乳酸菌发酵诺丽果,通过检测发酵期间的理化指标、微生物数量及抗氧化性的变化情况,发现最适宜发酵诺丽果的乳酸菌是植物乳杆菌和双歧杆菌。此外,还有利用纤维素酶将诺丽果酶解后再进行发酵[9]、酵母菌发酵[10]和加糖发酵[11]等发酵方式。由于缺少统一的质量标准和科学的评价体系,现在市场上充斥着各式各样、五花八门的诺丽发酵果汁产品,品质良莠不齐[8]。
植物乳杆菌因其保健功能和产细菌素特性是工业发酵最常用的乳酸菌[8],本文在诺丽果前期自然发酵基础上接种植物乳杆菌发酵剂,对诺丽果进行强化发酵研究。通过监测和分析诺丽果强化发酵过程中关键理化指标(pH、总酸、可溶性固形物、总糖)、有机酸、活性成分(总酚、总黄酮、芦丁、槲皮素、东莨菪素)含量以及发酵产品抗氧化能力的变化规律,科学、系统地评价诺丽果发酵产品的品质,为进一步深入开展诺丽果发酵过程及功能成分研究建立理论基础,同时也为诺丽果工业化发酵生产提供重要的工艺和技术参考。
1 材料与方法
1.1 材料与仪器
诺丽果 无锡诺园生物科技有限公司;植物乳杆菌(Lactobacillusplantarum,CICC22703)中国工业微生物菌种保藏管理中心;总抗氧化能力(T-AOC)试剂盒 南京建成生物工程研究所;MRS培养基 北京陆桥技术股份有限公司;乙腈、甲醇 均为色谱纯,美国Tedia公司;芦丁(纯度≥99%)、东莨菪素(纯度≥99%)、三氟乙酸(光谱纯)、槲皮素(生化试剂,纯度≥99%) 美国Sigma试剂有限公司;氢氧化钠、硫酸亚铁、水杨酸、浓硫酸、福林酚和碳酸钠等试剂 国药集团化学试剂有限公司。
AX224ZH/E电子天平 奥豪斯仪器有限公司;KQ-600KDB型高功率数控超声波清洗器 昆山市超声仪器有限公司;SW-CJ-2D型单面垂直送风净化工作台 上海鼎科科学仪器有限公司;T9双光束紫外可见分光光度计 北京普析通用仪器有限公司;RJ-TDL-50A低速台式大容量离心机 无锡市瑞江分析仪器有限公司;DH4000BII电热恒温培养箱 杭州赛普科学仪器有限公司;1100型高效液相色谱仪 美国安捷伦科技有限公司;SCION SQ 456-GC气质联用仪 美国布鲁克公司;Millipore超纯水系统 美国Millipore公司。
1.2 实验方法
1.2.1 诺丽果发酵工艺设计 参考陆雨[12]的发酵方式,有所改动。取新鲜、无破损的诺丽果,洗净表面,晾干后立即放入密封无菌玻璃罐中。25 ℃放置7 d后,待果实完全成熟,将其装入无菌袋中拍打、8 h/s匀质1 min,所得诺丽果泥密封在无菌玻璃罐待用。将以上诺丽果泥均匀分为2份(每份1 kg),其中:强化发酵组(IF):接种植物乳杆菌(通过前期实验确定最佳接种量2.5%(w/w),活化至两代);对照组(NF):自然发酵。两组样品均置于25 ℃[13]条件下继续发酵30 d,总发酵时长37 d。分别于0、7、9、16、23、37 d取样,并立即置于-80 ℃保存。工艺流程图如下:
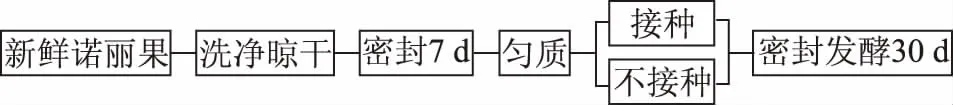
图1 诺丽果发酵工艺流程图Fig.1 Process flow chart of noni fruit fermentation
1.2.2 发酵过程中pH、总酸、可溶性蛋白和总糖的测定 pH和总滴定酸度的检测方法参考国标《GBT 15038-2006 葡萄酒、果酒通用分析方法》。可溶性蛋白的测定采用考马斯亮蓝法[13]。总糖含量的测定采用蒽酮比色法[14]。
1.2.3 植物乳杆菌的测定 采用《GB 4789.35-2016 食品微生物学检验乳酸菌检验》。
1.2.4 发酵过程中有机酸含量的测定 用高效液相色谱(HPLC)法测定诺丽果汁中有机酸的含量[15],包括甲酸、乙酸、丙酸、丁酸、戊酸、己酸、乳酸、柠檬酸、苹果酸和富马酸。将诺丽果汁4000 r/min离心10 min取上清,稀释5倍后微滤(0.45 μm)过膜,HPLC分析。采用 Ecosil C18色谱柱,流动相为甲醇-水-H3PO4溶液(A体积比80∶15∶5;B体积比5∶90∶5),柱温30 ℃,流速0.5 mL/min,进样量为5 μL,UV检测(210 nm)。流动相梯度洗脱条件如下:

表1 有机酸测定流动相梯度洗脱条件Table 1 Gradients elution conditions of mobilephase for determination of organic acids
1.2.5 发酵过程中总酚和总黄酮含量的测定
1.2.5.1 发酵诺丽果汁总酚含量测定 Folin-Ciocalteu比色法[16]。以没食子酸的浓度(x)为横坐标,波长760 nm处的吸光度值(y)为纵坐标,绘制没食子酸标准曲线。没食子酸标准曲线线性回归方程为y=0.0047x+0.0597,决定系数R2=0.9993。根据没食子酸标准曲线线性回归方程计算样品中总酚含量。
1.2.5.2 发酵诺丽果汁总黄铜含量测定 NaNO2-Al(NO3)3比色法[17]。以芦丁的浓度(x)为横坐标,波长510 nm处的吸光度值(y)为纵坐标,绘制芦丁标准曲线。芦丁标准线性回归方程为:y=0.0033x+0.0484,决定系数为R2=0.999。根据芦丁标准曲线回归方程计算样品中总黄酮含量。
1.2.6 发酵过程中三种主要单体植物素成分含量的测定 测定发酵过程中芦丁、槲皮素和东莨菪素的含量变化。称取诺丽果泥2.0 g加入8.0 mL甲醇,以频率为50 kHz,温度为25 ℃超声提取30 min后,得到溶液离心5 min(3000 r/min),取上清液过0.45 μm微孔滤膜后进样分析[18]。每份样品平行测定3次。检测条件参考罗宇展[19]的检测方法,采用Ecosil C18色谱柱,流动相A:1 mL/L乙腈+1 mL/L磷酸,流动相B:100%乙腈,柱温40 ℃,流速1 mL/min,进样量为5 μL,在345 nm进行检测[20]。流动相梯度洗脱条件如下:
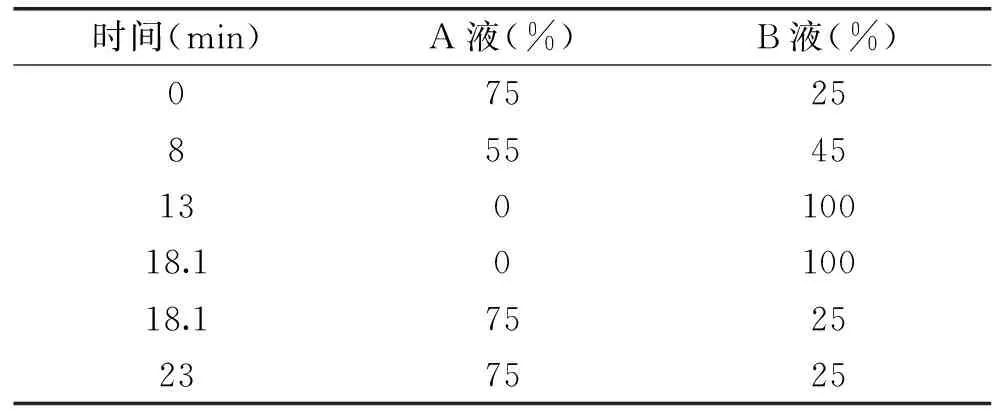
表2 三种主要单体植物素测定流动相梯度洗脱条件Table 2 Gradients elution conditions of mobilephase for determination of three compounds
1.2.7 发酵过程中体外抗氧化能力的测定
1.2.7.1 总抗氧化能力(T-AOC)的测定 使用总抗氧化能力(T-AOC)检测试剂盒(比色法)进行测定。
1.2.7.2 清除二苯基苦基苯肼自由基(DPPH)能力的检测 参考文献[21]方法。将1 mL诺丽发酵果汁用磷酸缓冲液(0.2 mol/L,pH6.6)稀释10倍混匀,作为待测液。分为以下3组:
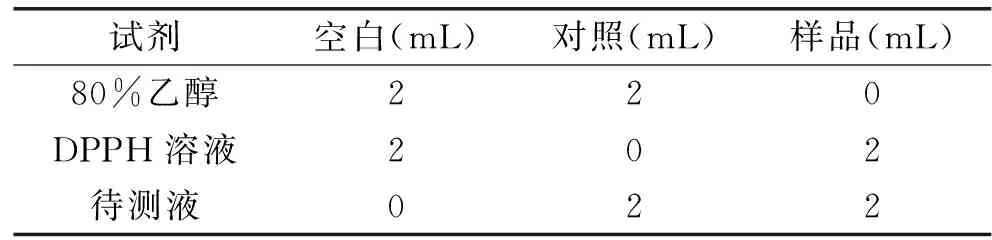
表3 DPPH自由基清除能力测定操作表Table 3 DPPH free radical scavengingcapacity determination operation table
分别充分混匀后室温避光反应30 min,517 nm波长下测定吸光度值,每个试样重复3次。DPPH自由清除率计算公式如下:
DPPH自由基清除能力(I,%)=[1-(A1-A2)/A0]×100
式中,A0、A1和A2分别为空白、样品和对照的吸光度值。
1.2.7.3 清除羟自由基能力的检测 参考文献[22]方法。将1 mL诺丽发酵果汁用磷酸缓冲液(0.2 mol/L,pH6.6)稀释5倍混匀,作为待测液。分为以下3组:
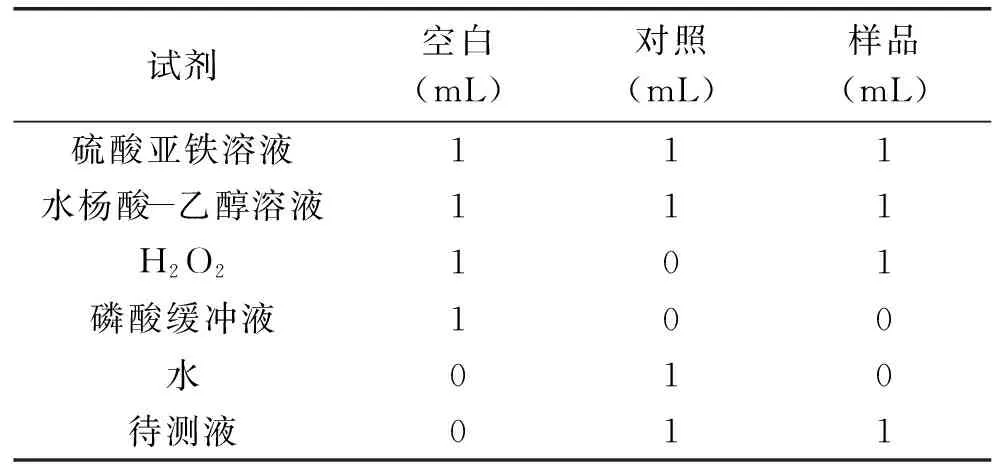
表4 羟自由基清除能力的测定操作表Table 4 Hydroxyl free radical scavengingcapacity determination openation table
分别充分混匀后于37 ℃水浴中反应30 min,510 nm波长下测定吸光度值,每个试样重复3次。羟基自由基清除率计算公式如下:
OH自由基清除能力(I,%)=[1-(A1-A2)/A0]×100
式中,A0、A1和A2分别为空白、样品和对照的吸光度值。
1.3 数据分析
2 结果与讨论
2.1 发酵过程中pH、总酸、可溶性蛋白和总糖的变化

图2 诺丽果发酵过程中pH、总酸、可溶性蛋白和总糖的变化Fig.2 Changes in the pH,total acidity,soluble protein content and total carbohydrate content during noni fermentation注:图中字母不同表示差异显著(P<0.05),小写字母代表NF组,大写字母代表IF组,图3~图5、图7同。
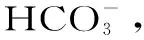
2.2 发酵过程中有植物乳杆菌数量的变化
由图3可知,诺丽果发酵过程中植物乳杆菌数量大体呈现先增加后降低的趋势,与Chan-Blanco等[24]得出的结论一致。其中,IF组在9 d植物乳杆菌数量迅速增加至7.80×106CFU/mL,这是由于初始发酵阶段营养物质充足,环境适宜,植物乳杆菌大量增殖,在16 d数量达到1.62×107CFU/mL,随后开始下降,这是因为随着发酵时间的延长,发酵基质酸度的升高(图2)、营养物质的消耗以及微生物代谢废物的产生抑制了植物乳杆菌的生长繁殖[25]。NF组植物乳杆菌数量在16 d也有明显增加,随后缓慢减少,在IF组植物乳杆菌数量达到峰值(16 d)时,两组植物乳杆菌数量相差两个数量级以上,此时IF组以植物乳杆菌为主要发酵微生物。
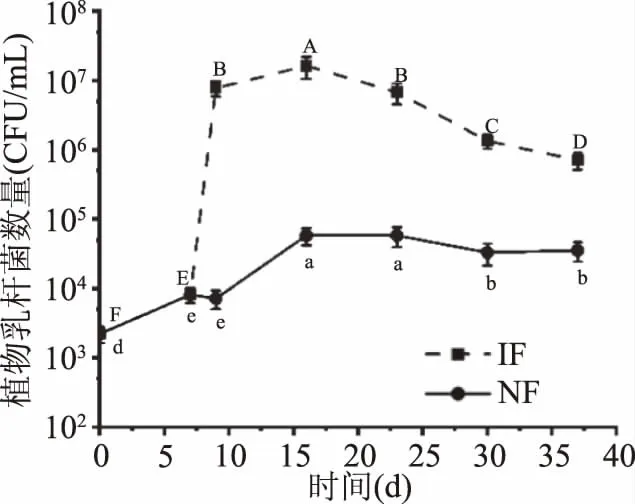
图3 诺丽果发酵过程中植物乳杆菌的变化Fig.3 Changes in the Lactobacillus plantarumpopulations during noni fermentation
2.3 发酵过程中有机酸含量的变化
有研究表明,某些有机酸为诺丽发酵果汁提供独特的刺激性酸味,其中辛酸和己酸为特征性有机酸[26]。为探究具体有机酸的变化情况,针对甲酸、乙酸、丙酸、丁酸、戊酸、己酸、乳酸、柠檬酸、苹果酸和富马酸这十种常见的有机酸进行检测[27-28]。其中甲酸和富马酸在两组发酵过程中的含量均始终低于0.01 mg/mL,未在表5中展示。从表5可以看出,经过23 d强化发酵,IF组乙酸、丙酸、丁酸、己酸的含量均低于NF组,其中IF组丁酸(脂肪臭、不愉快的味道[29])含量较NF组显著降低(P<0.05),与郝玉洁等[28]研究结果一致。在整个发酵过程中,己酸的含量最高,其中NF组30 d最高达到(16.028±0.217) mg/mL,IF组37 d最高达到(9.834±0.375) mg/mL,是诺丽果发酵果汁中的主要挥发性有机酸[30]。
2.4 发酵过程中总酚和总黄酮含量的变化
酚类物质的含量决定着发酵诺丽果汁的颜色、味道等感官特性[31]。如图4A所示,在强化发酵过程中总酚含量先上升后下降,其中总酚含量从开始的(7.800±0.271) mg/mL在发酵23 d上升到(15.538±1.213) mg/mL,后下降到(9.157±0.174) mg/mL。这主要是因为随着诺丽果软化成熟,汁液渗出,果实大部分浸渍到发酵液中,有利于果肉中的多酚类化合物溶出。同时随着发酵过程中单体酚化合物的生物合成,多酚含量也会增加,随后总酚含量开始显著下降(P<0.05)。
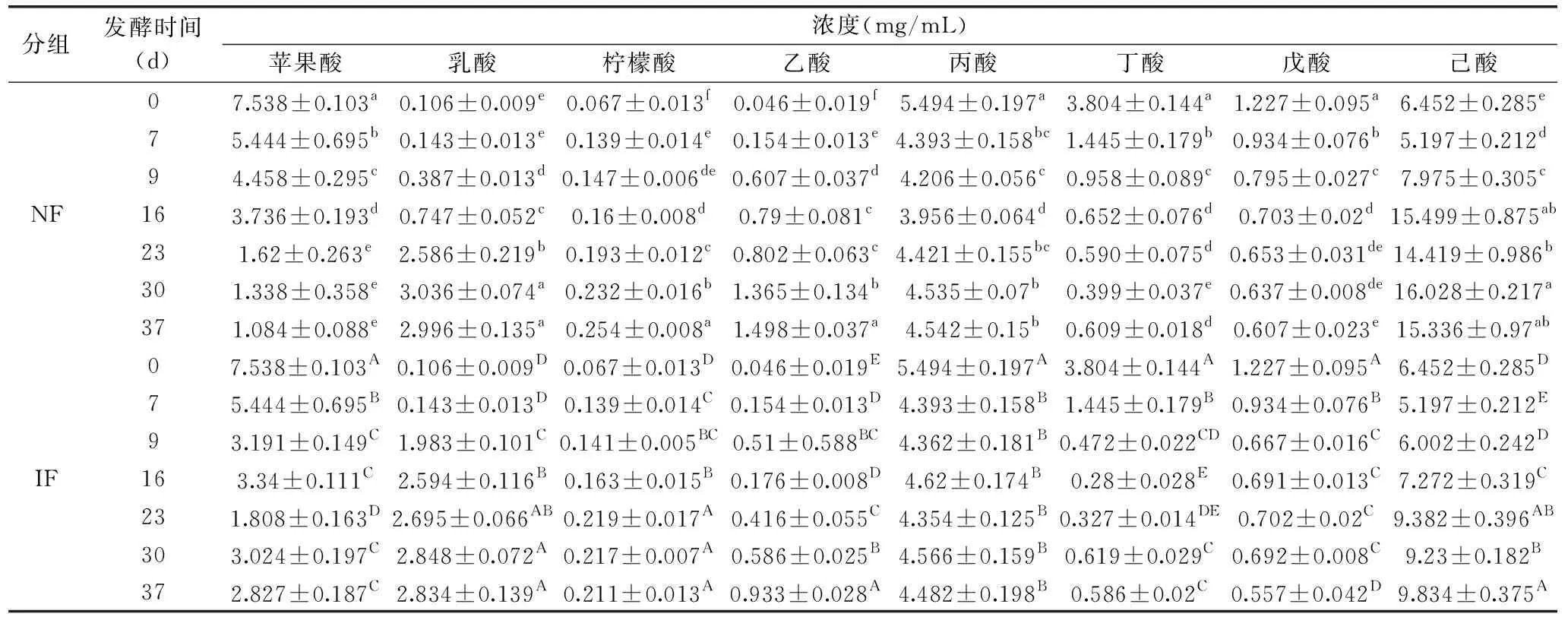
表5 诺丽果发酵过程中有机酸含量的变化Table 5 Changes in the organic acids during noni fermentation
酚类物质在诺丽鲜果中多以结合态的形式存在,而在发酵过程中,其在微生物及各种酶的多重作用下,将大分子转化成小分子并释放进入诺丽发酵果汁中[32]。酚类物质的氧化与溶出也是同时进行的,到了发酵后期,溶出的速率降低,而氧化过程仍在继续,导致酚类呈现缓慢的下降趋势[33]。
总黄酮含量的变化趋势(图4B)与总酚含量的变化相似,在IF组中其含量也是在23 d达到0.542 mg/mL,略高于晏永球[13]检测到诺丽果自然发酵过程的总黄酮含量峰值0.49 mg/mL。但是在后续的发酵过程中总黄酮含量下降不明显,NF组仍保持整体呈上升趋势。这可能是由于随着果肉浸渍,黄酮类化合物从果中渗出导致总黄酮含量上升。

图4 诺丽果发酵过程中总酚和总黄酮含量的变化Fig.4 Changes in total polyphenol contentsand total flavonoids contents during noni fermentation
2.5 发酵过程中主要单体植物素成分含量的变化
芦丁、槲皮素和东莨菪素是诺丽果中被关注较多的功能性植物素[34]。现代研究认为芦丁具有降低毛细血管的异常通透性和脆性的作用,是心血管疾病制剂的主要成分[35];槲皮素具有抗炎、抗氧化、抗过敏、抗菌、抗病毒等作用[36];东莨菪素是香豆素类衍生物,具有良好的抗氧化和抗真菌作用[18],有研究表明这三种植物素的含量与品种密切相关,不同品种的诺丽果发酵液含量差异明显[34]。由图5可知,新鲜诺丽果中芦丁的含量为(112.123±4.903) μg/g,经37 d发酵IF组降低到(47.434±3.574) μg/g,NF组降低到(52.826±2.873) μg/g,这可能是由于随着发酵的进行芦丁转化为其他小分子物质[37];槲皮素的含量从(2.462±4.903) μg/g上升到(15.534±3.574) μg/g,虽然低于NF组(19.009±2.873) μg/g,但与新鲜诺丽果相比,仍显著上升(P<0.05)。经过相关性分析,发酵过程中芦丁含量与槲皮素含量呈极显著相关(相关系数r=0.99),由图6可知,芦丁和槲皮素的结构仅差一个侧链上的鼠李糖基,槲皮素含量的增加可能是因为芦丁在发酵过程中水解,这与目前关于利用微生物转化制备槲皮素的研究情况相符[38]。东莨菪素的含量在发酵过程中整体呈下降趋势,在发酵23 d时,IF组东莨菪素的含量更高,经分析IF组东莨菪素含量与槲皮素含量显著相关(r=0.977),NF组东莨菪素含量与槲皮素(r=0.975)和芦丁(r=0.974)含量均显著相关。
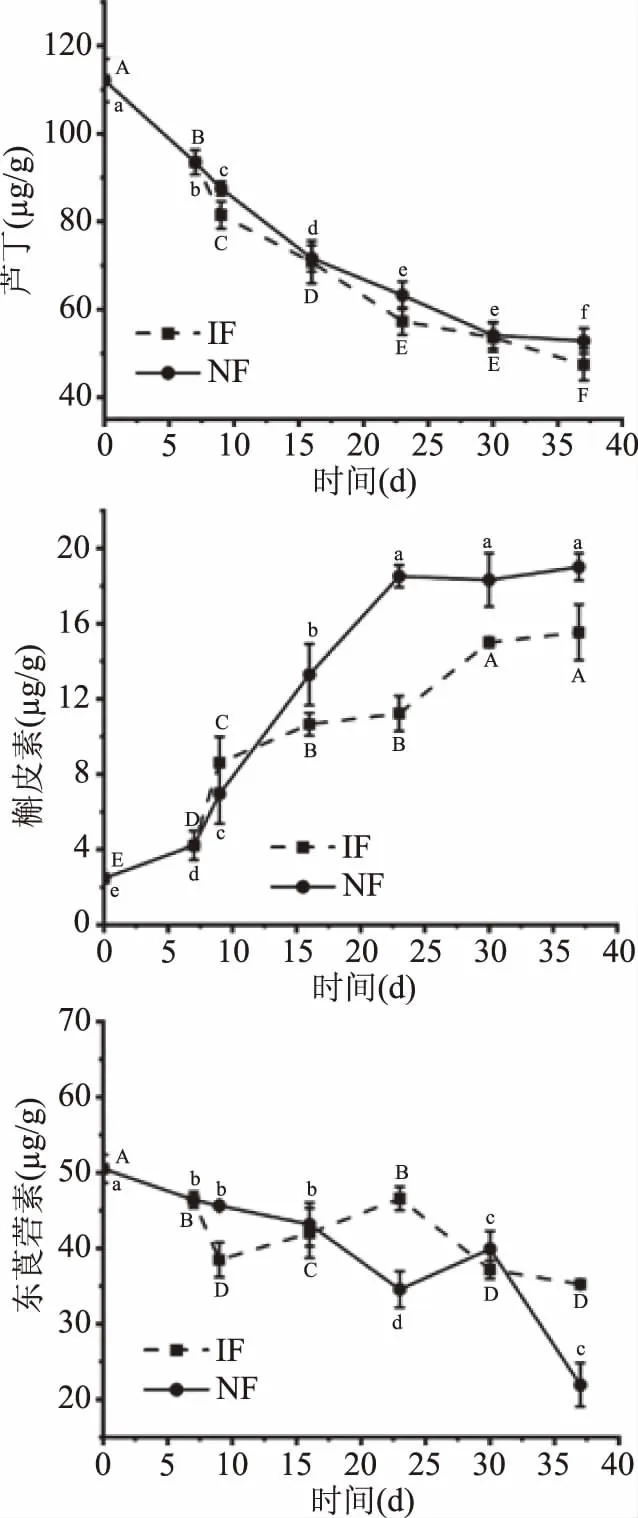
图5 诺丽果发酵过程中主要单体植物素成分含量的变化Fig.5 Changes in the content of major monomerphytochemicals during noni fermentation
图6 主要单体植物素的化学结构Fig.6 Structural formula of major monomer phytochemicals
2.6 发酵过程中体外抗氧化能力的变化
如图7所示发酵过程中的总抗氧化能力、DPPH自由基清除率和羟自由基清除率均大体呈现先上升再下降的趋势。强化发酵过程中,总抗氧化能力、对DPPH自由基、羟自由基的清除率均在23 d达到最高,其中总抗氧化能力由初始的(1.23±0.08) mmol/L达到(1.82±0.13) mmol/L,DPPH自由基清除率由61.69%±1.20%最高达到84.76%±3.43%,羟自由基清除率由79.12%±2.02%最高达到94.41%±1.07%,较诺丽鲜果汁均有显著提高(P<0.05),且抗氧化能力最高值均高于NF组。这可能与诺丽果发酵过程中活性物质的变化情况与乳酸菌代谢产物作用有关[23,39]。综上,诺丽果经23 d强化发酵,果汁的抗氧化能力有了明显改善。
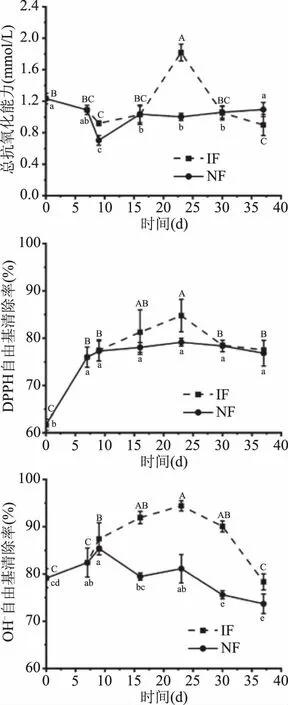
图7 诺丽果发酵过程中体外抗氧化能力的变化Fig.7 Changes in antioxidant activity during noni fermentation
2.7 发酵过程中抗氧化活性与总酚、总黄酮及三种植物素含量的相关性分析
诺丽果强化发酵23 d时,总酚、总黄酮含量及体外抗氧化能力最高,因此选择此时作为强化发酵的发酵终点。由表6可知,在NF组中,对DPPH自由基的清除能力与其芦丁含量呈显著相关(P<0.05),与总黄酮含量呈极显著相关(P<0.01);在IF组中,对DPPH自由基的清除能力与其所含总酚和芦丁含量呈显著相关(P<0.05),与总黄酮呈极显著相关(P<0.01)。综合看来,发酵过程中NF、IF组的总抗氧化能力和羟自由基清除率与总酚、总黄酮及三种植物素含量均无显著相关性,NF与IF组总抗氧化能力的差距可能是其他活性物质或植物乳杆菌代谢产物作用的结果;DPPH自由基清除率与总黄酮含量相关极显著(P<0.01),与芦丁含量显著相关(P<0.05),由于强化发酵23 d时总黄酮含量更高,得到的果汁对DPPH自由基的清除能力更强,此外,由图5(A)可知芦丁的含量随发酵时间延长逐渐减少,因此为了得到清除DPPH自由基能力强的诺丽发酵果汁,不宜发酵过长时间。综上,通过23 d强化发酵可以得到抗氧化能力更高的诺丽果汁。
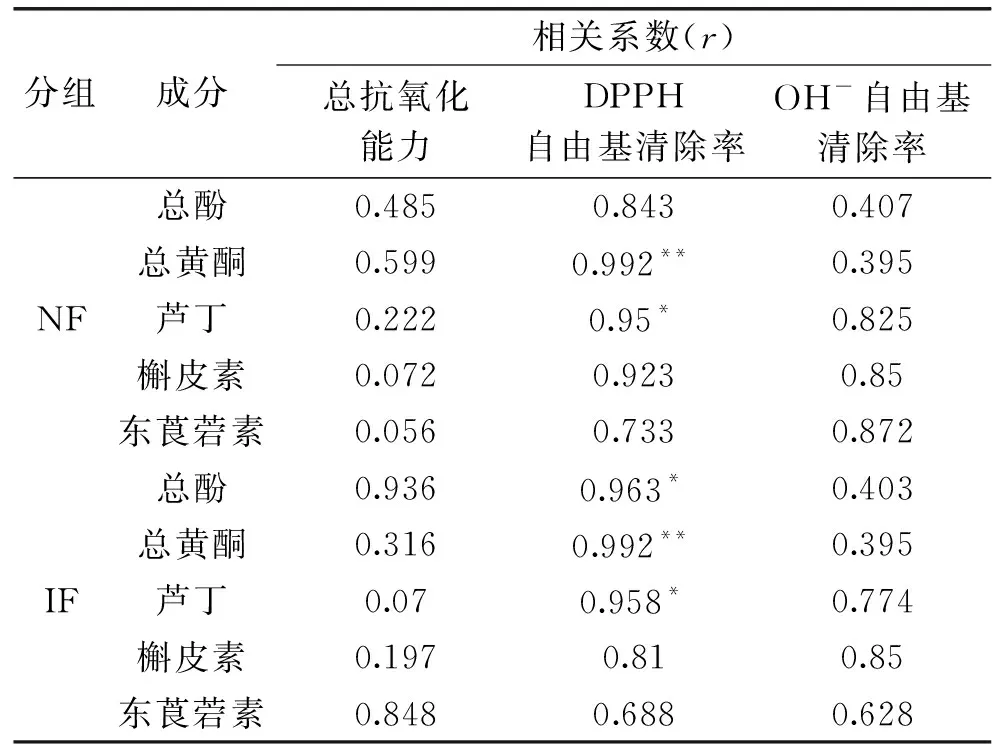
表6 诺丽果发酵过程中抗氧化活性与总酚、总黄酮及主要单体植物素含量变化间的相关性Table 6 Correlation between antioxidant activity and thecontent of total phenols,total flavonoids and majormonomer phytochemicals during noni fermentation
3 结论
实验通过自然发酵与强化发酵诺丽果的对比,研究诺丽果汁发酵过程中关键理化性质、有机酸、活性成分以及体外抗氧化活性等的变化规律,结果表明通过23 d强化发酵的诺丽果汁总酚、总黄酮、槲皮素含量均有显著增加(P<0.05),给诺丽果汁带来强烈刺激性酸味的丁酸含量显著降低(P<0.05),从而减轻了果汁的强烈刺激性。与新鲜诺丽果汁相比,经23 d强化发酵,果汁的抗氧化能力也有显著提升(P<0.05)。本文以诺丽果为发酵基质,首次采用植物乳杆菌进行强化发酵,得到了活性成分较高、风味较为柔和且抗氧化能力强的诺丽果发酵汁。
