水翁花蕾提取物DMC对胰脂肪酶的抑制作用研究
2020-08-17向灿辉王文君
李 婷,向灿辉,王文君
(遵义医科大学珠海校区,生物工程系,广东珠海 519041)
肥胖和超重是指体内脂肪异常或过多的堆积[1],据世界卫生组织(World Health Organization,WHO)统计显示[2],自1975年来,肥胖人数已增长近三倍,超过6.5亿人肥胖,成年人中有39%超重,其中13%肥胖。肥胖不仅会影响生活质量[3],还是许多疾病的主要危险因素[4],包括糖尿病[5]、心血管疾病[6-7]和癌症[8-9],如何有效预防和治疗肥胖是当今研究的热点。胰脂肪酶(Pancreatic Lipase,PL)[10]是消化食物脂肪的主要消化酶,可以将膳食中的脂肪水解为单酰甘油和脂肪酸,单酰甘油和脂肪酸再被机体吸收合成脂肪,造成脂肪堆积,抑制PL活性可减少机体对膳食中脂肪的水解和吸收,从而预防或治疗肥胖。奥利司他是唯一临床批准上市的胰脂肪酶抑制剂药物,来源于微生物,除具有令人不愉快的胃肠道反应(油性粪便、油性斑点及胃胀气等[11])外,FDA在2015年的报告中指出长期服用奥利司他会增加肝损伤、胰腺炎、胆结石和肾结石的风险[12],因此,寻找更安全有效的抗肥胖药物具有十分重要的意义。
植物来源的天然化合物是高效低毒药物的一个重要来源,研究显示植物中的黄酮类化合物可抑制PL活性[13]。Jo等[14]从拓木中分离出14种黄酮类化合物,有6种黄酮类化合物对PL抑制率大于50%;Zeng等[15]研究显示陈皮提取物对PL有抑制作用,采集时间不同,黄酮类化合物含量也有所区别,且陈皮提取物对PL的抑制作用与总黄酮含量呈正相关关系。水翁花是“清热凉茶”中成药主要成分之一,主要来源于广东、广西等省,民间常将其熬煮做凉茶。2′,4′-二羟基-6′-甲氧基-3′,5′-二甲基查耳酮(2′,4′-dihydroxy-6′-methoxy-3′,5′-dimethylchalcone,DMC)是中药材水翁花蕾中黄酮类的主要成分之一[16],Zhang等[17]研究发现水翁花不同极性提取部位及提取物DMC对PL有抑制作用,但未深入研究其抑制机理。因此,本文进一步研究DMC对PL的抑制作用,并探索DMC与PL的相互作用及作用机理,为开发DMC作为PL抑制剂提供参考。
1 材料与方法
1.1 材料与仪器
DMC 本课题组从水翁花蕾中分离得到[18],经超高效液相色谱仪检测纯度为98.56%;奥利司他和4-硝基苯丁酸酯(4-nitrophenyl butyrate,pNPB) 上海阿拉丁生化科技股份有限公司;胰脂肪酶(来自猪胰,30000 U/g) 上海源叶生物科技有限公司;对硝基苯酚(p-nitrophenol,pNP) 上海麦克林生化科技有限公司;二甲基亚砜 天津市大茂化学试剂厂;其他化学试剂 均为国产分析纯。
F-4600荧光分光光度计 日本日立公司;Cary 8454 UV-Vis 安捷伦科技有限公司;JB-3恒温定时搅拌器 上海雷磁仪器厂;PB-10 pH计 赛多利斯科学仪器(北京)有限公司;SepctraMan M5酶标仪 美谷分子仪器(上海)有限公司;XS205 DualRange电子天平 梅特勒-托利多集团。
1.2 实验方法
1.2.1 DMC对胰脂肪酶的抑制作用
1.2.1.1 溶液配制 Tris缓冲液(0.25 mol/L,含0.25 mol/L NaCl和0.7 mmol/L CaCl2,pH=7.4):称取7.57 g Tris,3.65 g NaCl和19.4 mg CaCl2加适量水溶解,用盐酸调pH至7.4,室温冷却,转移至250 mL容量瓶中,加水定容至刻度,摇匀,4 ℃保存。
PL工作液:取50 mg PL加10 mL Tris缓冲液配制得5 mg/mL酶溶液,振摇15 min,18 ℃下4000 r/min离心10 min,分离上清,上清即为PL工作液,置于冰盒中待用,现配现用。
底物pNPB溶液(10 mmol/L):量取17.5 μL pNPB用乙腈溶解并定容至10 mL容量瓶。
DMC用二甲基亚砜(Dimethyl sulfoxide,DMSO)溶解,使DMC在体系中最终浓度为2、8、16、32、64 μmol/L,奥利司他作为阳性对照。
1.2.1.2 抑制率测定 采用对硝基苯酚法测定抑制率[19],在48孔板中加入875 μL Tris缓冲液、100 μL PL工作液、20 μL DMC(DMC终浓度为2、8、16、32、64 μmol/L),37 ℃中孵育5 min,然后加入5 μL pNPB溶液,2.5 min后使用酶标仪测定405 nm处的OD值。平行三次。奥利司他(奥利司他终浓度为0.2、1、4、8 μmol/L)代替DMC作为阳性对照,DMSO代替DMC作为不加抑制剂组。运用SPSS 20计算IC50。
抑制率(%)=(AE-AT)/AE×100,式中AE为不加抑制剂组的OD值;AT为加抑制剂组的OD值。
1.2.2 DMC抑制胰脂肪酶的酶动力学特征 精密称取139.28 mg pNP,用DMSO溶解并定容至10 mL得储备液,从储备液中取适量用DMSO稀释得0.05、0.5、1、1.5、2 mmol/L pNP的DMSO溶液,分别取20 μL pNP的DMSO溶液加975 μL Tris和5 μL乙腈得 0.001、0.01、0.02、0.03、0.04 mmol/L pNP的标准系列溶液,用酶标仪测定其405 nm处的吸光度,以DMSO替代pNP扣除空白,以pNP的标准系列溶液浓度(c)为横坐标,吸光度(A)为纵坐标绘制标准曲线,得到线性方程为A=9.008c+0.0009,决定系数R2=0.9999。
对硝基苯酚法测酶活的原理为底物pNPB在PL的催化下加速分解为pNP。在48孔板中加入875 μL Tris缓冲液、100 μL PL工作液、20 μL 不同浓度的DMC溶液(DMC终浓度为0、10、50 μmol/L),37 ℃中孵育5 min,然后分别加入5 μL 不同浓度的pNPB溶液(pNPB终浓度为0.05、0.1、0.2、0.25 mmol/L),每隔0.5 min测一次OD值,根据pNP标准曲线计算pNP生成量,以时间为横坐标,pNP生成量为纵坐标作图,斜率即为不同浓度pNPB在PL作用下的反应速率。以底物浓度[S]的倒数为横坐标,反应速率(V)的倒数为纵坐标,绘制Lineweaver-Burk双倒数图,根据对照组(不加DMC)和实验组(加DMC)直线相交位置推断DMC对PL的抑制类型。
1.2.3 DMC与PL相互作用的研究
1.2.3.1 DMC对PL荧光光谱的影响 称取5 mg PL溶解在适量Tris中,振摇15 min,18 ℃下4000 r/min离心5 min,取上清定容至100 mL得1.25×10-6mol/L的PL溶液,取25 mL PL于烧杯中,逐次加入50 μL浓度为1.5 mmol/L的DMC溶液,共滴加7次,DMC终浓度为0、3、6、9、12、15、18、21 μmol/L。以λex=278 nm为激发波长,激发狭缝和发射狭缝分别为5、10 nm,扫描PL以及每滴加一次DMC后PL溶液的荧光光谱,每次测量后将溶液合并至原溶液。
1.2.3.2 DMC对PL的荧光猝灭特性 溶液浓度及配制方法同1.2.3.1,PL浓度为1.25×10-6mol/L,DMC终浓度为3、6、9、12、15、18、21 μmol/L,分别于298和310 K测定DMC对PL荧光强度的影响,根据Stern-Volmer方程[20]判断猝灭类型:
F0/F=1+Kqτ0[Q]=1+KSV[Q]
式(1)
式中,F0为PL荧光强度,F为加入DMC后PL的荧光强度,KSV为猝灭常数,Kq为双分子猝灭常数,τ0为没有猝灭剂时荧光分子的平均寿命,大约为1.59 ns[21],[Q]为抑制剂的浓度。动态猝灭时猝灭剂和荧光物质的激发态分子之间发生碰撞导致荧光强度减弱,温度升高,碰撞加剧,进而扩散系数增大,KSV增大;静态猝灭时猝灭剂和荧光物质分子在基态时生成不发光的配合物,温度升高使配合物稳定性下降,猝灭常数减小。因此,根据不同温度的KSV的变化判断DMC对PL的猝灭类型。
为进一步确定猝灭类型,测定1.25×10-5mol/L PL溶液、1.25×10-5mol/L的DMC溶液的紫外吸收光谱及PL与DMC等摩尔混合溶液的紫外吸收光谱。由于动态猝灭不改变基态物质,只对荧光分子的激发态产生影响,因此其吸收光谱并不发生改变;而静态猝灭中,猝灭剂和荧光物质会形成配合物,从而引起荧光物质的吸收光谱发生改变[22],因此,根据DMC对PL紫外吸收光谱的影响进一步确定DMC对PL的猝灭类型。
1.2.3.3 DMC与PL的相互作用类型 溶液浓度及配制方法同1.2.3.1,PL浓度为1.25×10-6mol/L,DMC终浓度为3、6、9、12、15、18、21 μmol/L,分别于298和310 K测定DMC对PL荧光强度的影响,根据热力学公式可计算出不同温度下的热力学参数ΔH、ΔG、ΔS[23]:
ΔG=-RTlnK
式(2)
ln(K2/K1)=ΔH(1/T1-1/T2)/R
式(3)
ΔS=(ΔH-ΔG)/T
式(4)
式中R为理想气体常数。根据ΔH、ΔS、ΔG可以判断DMC与PL的作用力类型,当ΔH>0且ΔS>0时,作用力为疏水作用力;当ΔH<0且ΔS<0时,作用力为氢键和范德华力;当ΔH<0且ΔS>0时,作用力为静电作用力;ΔG<0,表明相互作用是自发进行的。
1.2.3.4 DMC对PL构象的影响 PL分子中因含酪氨酸及色氨酸等残基而具有较强的荧光,荧光光谱测定的是氨基酸残基叠加在一起的荧光强度,而同步荧光[24]可以测定特定氨基酸残基的荧光特征峰从而知道DMC对PL中氨基酸构象及其所处环境的影响情况。当Δλ=15 nm时,PL的同步荧光光谱显示的是酪氨酸残基的特征荧光光谱,当Δλ=60 nm时,PL的同步荧光光谱显示的为色氨酸残基的特征荧光光谱,根据DMC对PL同步荧光光谱的最大发射波长变化判断DMC对PL构象的影响情况。溶液浓度及配制方法同1.2.3.1,PL浓度为1.25×10-6mol/L,DMC终浓度为0、3、6、9、12、15、18、21 μmol/L,激发狭缝和发射狭缝分别为5、10 nm,在Δλ=15 nm和Δλ=60 nm下测定PL以及每滴加一次DMC后PL溶液的同步荧光光谱。
三维荧光是另一类近几年新兴的常用的荧光分析技术,可以为蛋白大分子构象提供更详细的信息[25],因此,为了进一步确定DMC对PL构象的影响,测定DMC对PL三维荧光光谱的影响。设置激发波长为240~500 nm,发射波长为240~500 nm,波长间隔5 nm,激发狭缝和发射狭缝分别为5、10 nm,测定1.25×10-6mol/L PL及滴加12 μmol/L DMC的PL溶液的三维荧光光谱。
1.2.4 分子对接 MOE是由加拿大CCG公司开发的分子模拟及药物设计综合软件,实验采用MOE 2019软件进行分子对接。选择DMC作为药物配体分子,结构在MOE软件绘制,保存为.moe格式;选择猪胰脂肪酶(PDI:1ETH)[26]为蛋白受体分子,由蛋白质晶体结构数据库(http://www.rcsb.org/)提供,经去水,加氢,能量最优等处理,采用MOE-Dock程序对两者进行对接,模拟分子间的相互作用。
1.3 数据处理
每组实验均重复三次,结果用平均值M±标准差SD表示。利用SPSS 22.0软件计算IC50。利用Sigmaplot 12.5软件作图。
2 结果与分析
2.1 DMC对PL的抑制作用及酶动力学研究
2.1.1 DMC对PL的抑制作用结果 由图1可知,DMC对PL有抑制作用,在实验浓度范围内(2~64 μmol/L),DMC浓度越高,对PL抑制作用越强,最大抑制率为54.7%,IC50为50.01±3.56 μmol/L,阳性药物奥利司他IC50为2.65±0.10 μmol/L。
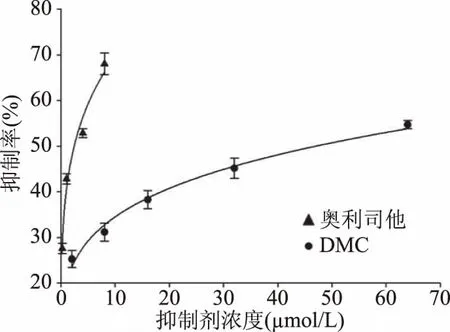
图1 DMC对PL活性的影响Fig.1 Effects of DMC on panreatic lipase activity
2.1.2 抑制动力学结果 通过Lineweaver-Burk双倒数图直线的相交位置判断抑制类型,直线交于纵轴为竞争型抑制,直线交于横轴为非竞争型抑制,直线交于象限内为混合型抑制。实验结果见图2,直线交于纵轴,表明DMC对PL的抑制类型属于竞争型抑制,DMC与底物竞争与PL活性中心结合从而抑制PL活性,DMC浓度增大,PL与底物的亲和程度下降,米氏常数(Km)增大,分别为0.0671、0.0785、0.1089 mol/L,最大反应速率(Vmax)不变,为0.0106 mmol/min。
2.2 DMC与PL相互作用的研究
2.2.1 DMC对PL荧光光谱的影响 如图3所示,DMC的加入使PL荧光强度降低,荧光强度随DMC浓度增加呈现有规律下降,表明DMC与PL发生相互作用,DMC能使PL发生荧光猝灭。

表1 DMC对胰脂肪酶荧光猝灭Stern-Volmer方程和猝灭常数Table 1 Stern-Volmer equation and constant of fluorescence disappearance of DMC on PL
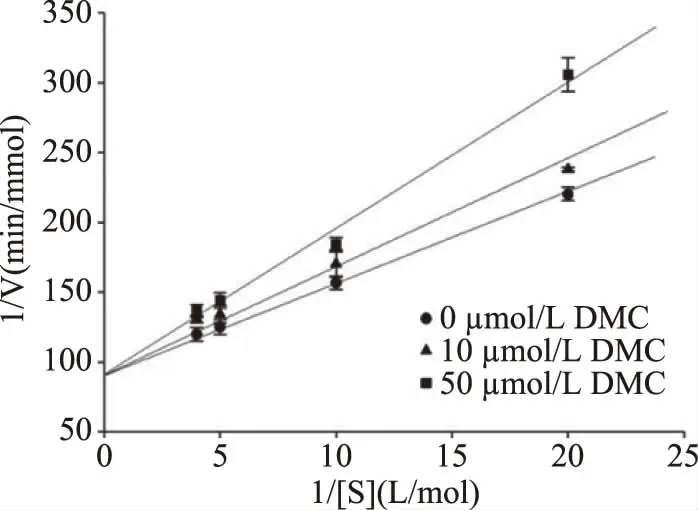
图2 DMC的双倒数Lineweaver-Burk图Fig.2 Double reciprocal Lineweaver-Burk plot of DMC
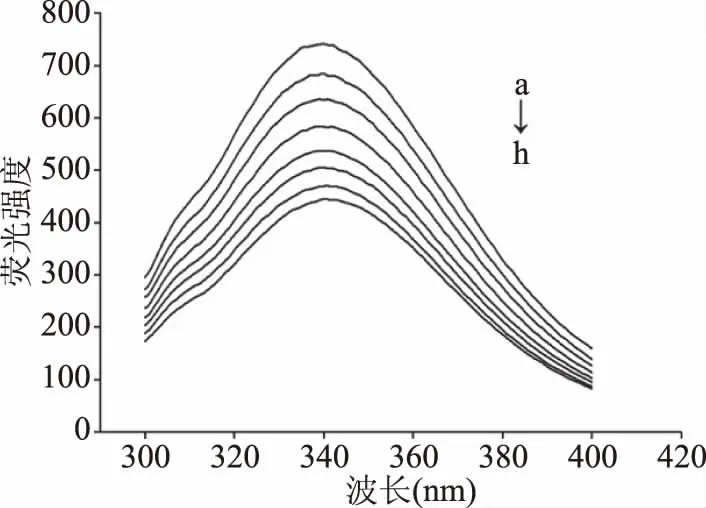
图3 DMC对PL荧光光谱的影响Fig.3 Effect of DMC on PL’s fluorescence spectra注:cPL=1.25×10-6mol/L;a→h表示DMC含量为0、3、6、9、12、15、18、21×10-6 mol/L。
2.2.2 DMC对PL的荧光猝灭特性 荧光猝灭分为动态猝灭和静态猝灭,可通过不同温度下的KSV来判断猝灭类型,结果见表1。结果显示,温度升高,KSV增大,表明DMC对PL的猝灭属于动态猝灭。

图4 DMC对PL紫外吸收光谱的影响Fig.4 Effect of DMC on UV absorption of PL注:a:DMC与PL 1∶1混合(cDMC=cPL=1.25×10-5 mol/L);b:cPL=1.25×10-5 mol/L。
为进一步确定猝灭类型为动态猝灭,测定了PL及DMC与PL等摩尔混合的紫外吸收光谱,结果见图4。结果显示,PL与DMC等摩尔混合后的吸收光谱与PL吸收光谱基本重合,DMC的加入不会改变PL的紫外光谱,进一步说明DMC对PL的猝灭属于动态猝灭。
2.2.3 DMC与PL的相互作用类型 小分子猝灭剂与蛋白质大分子相互作用力有疏水作用、氢键、范德华力、静电作用力等,根据热力学公式可计算出不同温度下的热力学参数ΔH、ΔG、ΔS,结果如表2。结果显示ΔH<0,ΔS<0,表明DMC与PL的相互作用力主要为氢键和范德华力,ΔG<0,表明两者之间的相互作用是自发进行的。

表2 不同温度下DMC与PL相互作用的热力学参数Table 2 Thermodynamic parameters ofDMC and PL at different temperatures
2.2.4 DMC对PL构象的影响 同步荧光可以测定特定氨基酸残基的荧光特征峰从而知道DMC对PL中氨基酸构象及其所处环境的影响情况,结果如图5所示。图5(a)和5(b)分别是Δλ=15 nm和Δλ=60 nm时DMC的加入对PL影响的同步荧光图,由图5可知,DMC的加入仅使荧光强度降低,最大发射波长基本无变化,表明DMC未使PL构象发生改变。
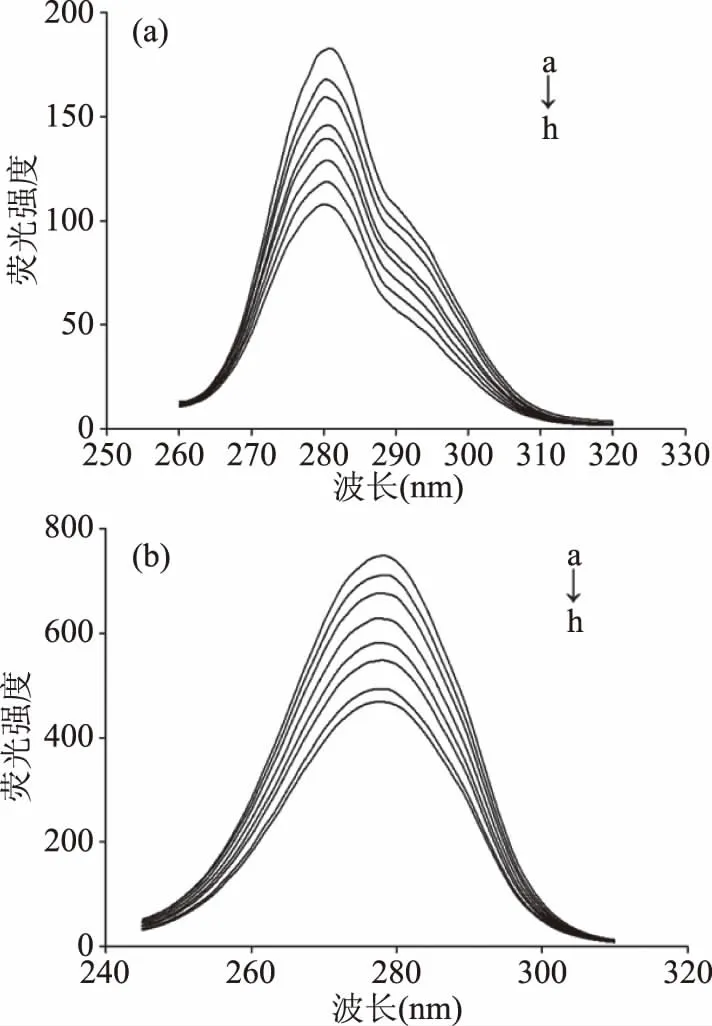
图5 DMC对PL同步荧光光谱的影响Fig.5 Effect of DMC on synchronous fluorescence spectra of PL注:(a)Δλ=15 nm;(b)Δλ=60 nm;cDMC(a→h):0、3、6、9、12、15、18、21×10-6 mol/L;cPL=1.25×10-6 mol/L。

表3 PL、PL-DMC体系的三维荧光光谱特征参数Table 3 Three-dimensional fluorescence spectra of DMC and PL-DMC
为了进一步确定DMC 对PL构象的影响,扫描了加入DMC对PL三维荧光光谱的影响。结果如图6所示,峰p1为PL的色氨酸和酪氨酸残基的峰,峰p2是瑞利散射峰(λex=λem),峰p3是二级散射峰(λex=2λem),DMC的加入没有使PL的三维荧光光谱图增加或减少峰,相关参数见表3,峰p1仅荧光强度下降,而对应的激发波长和发射波长均无变化,进一步表明DMC不会引起PL构象发生变化。
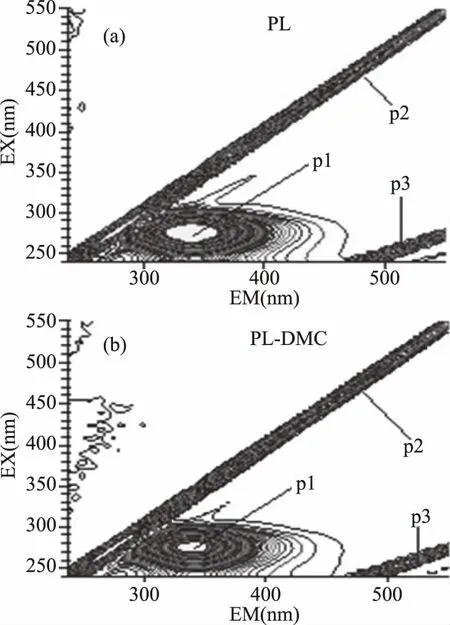
图6 PL、PL-DMC体系的三维荧光等高线光谱图Fig.6 Three-dimensional fluorescencespectra of PL and PL-DMC注:cPL=1.25×10-6 mol/L,cDMC=1.2×10-5 mol/L。
2.3 分子对接
分子对接结果如图7,图7(a)为对接3D图,绿色表示DMC分子,标红的为Ser 153,图7(b)为对接2D图,综合打分-6.3747。PL的活性中心由组氨酸(His)和丝氨酸(Ser)组成,与另一种氨基酸残基(Asp)一起构成PL催化中心三元组[27]。由图7可知,DMC与PL有相互作用,与催化位点Ser 153以氢键形式结合,因此可以推断,DMC可以与底物竞争结合酶的活性中心而抑制PL活性,从而抑制了底物的降解,有利于预防和治疗肥胖,属于PL的竞争性抑制剂。上述结果与酶抑制实验和荧光实验结果均相符。
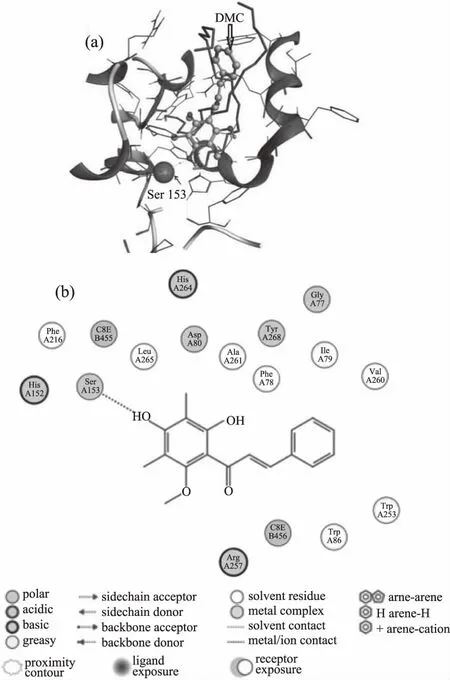
图7 DMC与PL分子对接图Fig.7 Molecular docking model of DMC and PL
3 结论
采用水翁花蕾中分离得到的黄酮单体DMC,研究了其对PL的抑制作用,IC50为50.01±3.56 μmol/L,酶动力学表明DMC是PL的竞争型抑制剂;光谱实验表明DMC通过与PL激发态发生碰撞的动态猝灭方式使PL发生荧光猝灭,二者作用力为氢键和范德华力且反应自发进行,DMC不会改变PL构象。分子对接进一步阐述DMC通过与PL的催化位点Ser 153氢键结合而抑制PL活性。此研究可为DMC作为PL抑制剂开发提供相关理论参考。
