天然和热变性乳铁蛋白与α乳白蛋白聚集体的超分子结构表征
2020-08-17NazarenkoYulia李波杨
Nazarenko Yulia李 波杨 伟*
(1.河南科技学院食品学院,河南新乡 453003;2.苏梅国立农业大学食品技术学院,乌克兰苏梅 40021)
蛋白质自组装是指蛋白质分子间,在热力学平衡条件下,通过建立特异性或非特异性相互作用,自发形成有序结构的过程[1]。它无需外部能量输入,仅通过改变介质环境就可以触发或“拆卸”组装[1]。在单一蛋白质体系中,溶液pH环境接近蛋白质等电点(pI)时,蛋白质分子之间可发生自组装[2-3];在含有两种蛋白质的体系中,蛋白质可以在两蛋白质pI之间的pH环境下发生自组装[4-5]。形成的超分子结构可以使蛋白质在相关领域中具有包埋、保护和传递生物活性物质的功能[6]。Anne等发现:带相反电荷的β-乳球蛋白(β-lactoglobulin,BLG)和乳铁蛋白(lactoferrin,LF)能够自组装,所形成的自组装体具有作为维生素B9生物载体的潜力,每克蛋白最高可包埋16 mg B9[7];Fatoumata等利用BLG和溶菌酶之间的静电相互作用组装形成微球状超分子结构组装体,并成功的将维生素D3包埋在BLG-溶菌酶微球中,包埋率高达90.8%±4.8%[8]。
LF是从牛奶初乳中分离出来的一种铁结合糖蛋白[9],分子量为88 kDa,具有抗菌、抗炎、抗病毒和免疫调节等多种生物功能[10-14]。LF具有8.9的等电点(pI),在低于其pI的pH环境下带正电荷,可以与具有负电荷的蛋白质形成各种超分子结构。Anema等利用这个特性研究了LF与BLG在pH5~7条件下(该溶液pH介于两蛋白质pI,8.9和4.6之间)形成的超分子结构[15]。深入研究基于LF为载体的传递体系,对于开发新型多功能食品添加剂和配料具有重要意义。
α-乳白蛋白(α-lactalbumin,ALA)是乳清蛋白中的优质蛋白质,约占乳清总蛋白的20%(w/w),与BLG一样,也具有较低的等电点(pI在4.2~4.5之间),但相比于BLG更易吸收[16]。推测LF和ALA也能够在两个蛋白质等电点之间的pH条件下自组装,形成不同的超分子结构,从而扩展LF-ALA复合物在食品领域中包埋、运载和传递生物活性物质的功能。但目前,尚无LF-ALA复合物结构和组装机制的相关报道,这限制了其作为活性物质载体的开发和应用。
双蛋白组装体的结构与功能与参与组装的单一蛋白质的结构密切相关[17]。目前,双蛋白自组装的研究多集中在天然蛋白质间的组装。LF具有两叶基团(N-叶和C-叶),当在90 ℃加热时,两叶完全展开[18]。Yang等研究了热变性前后LF和(-)-表没食子儿茶素-3-没食子酸酯((-)-epigallocatechin-3-gallate,EGCG)之间的相互作用,发现LF热变性前后与EGCG的结合能力不同[19]。因此,推测热变性LF与ALA自组装复合物具有与天然LF与ALA自组装复合物不同的结构。这些不同的结构对于扩展复合物的应用具有重要意义。但是目前尚无相关研究报道。
因此,本文在pH6.5环境下探究了热变性前后的LF与天然ALA的自组装行为。采用多重光谱法研究了LF-ALA复合物的结构特性及形成机制,为基于双蛋白复合物运载活性物质的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
LF 新西兰国际有限公司,纯度≥92%;ALA 美国Agropur公司,纯度≥95%;溴化钾 上海麦克林生化科技有限公司;磷酸二氢钾 天津市德恩化学试剂有限公司;磷酸氢二钾 天津市德恩化学试剂有限公司;其它所用化学药品 均为国产分析纯。
ALPHA1-2 LD plus真空冻干机 德国CHRIST冻干机有限公司;2100N浊度计 美国HACH公司;Zetasizer Nano-ZS90激光粒度仪 英国Malvern公司;Axio Vert.A1倒置生物显微镜 德国Zeiss公司;Cary-Eclipse荧光分光光度计 美国Agilent公司;SpectrumTensor27傅立叶变换红外光谱仪 德国Bruker公司。
1.2 实验方法
1.2.1 复合物的制备 母液配制:在pH=6.5、20 mmol/L磷酸盐缓冲溶液中,分别配制0.5 mmol/L LF溶液和5 mmol/L的ALA溶液,室温下搅拌2 h,使蛋白质充分水合。天然LF和天然ALA分别记为LF25 ℃和ALA25 ℃。室温为25 ℃。
热变性LF溶液的制备:首先,在超纯水中配制1.0 mmol/L LF溶液,室温下搅拌2 h,使蛋白质充分水合。然后,将上述溶液置于90 ℃恒温水浴下热处理30 min后,立即在冰水中冷却至室温,以防止进一步变性。之后,再添加等体积pH=6.5、40 mmol/L的磷酸盐缓冲溶液。此时得到了溶液环境为pH=6.5、20 mmol/L磷酸盐缓冲溶液、浓度为0.5 mmol/L的热变性LF溶液。热变性LF记为LF90 ℃。
LF-ALA复合物制备:取一定体积的0.5 mmol/L LF25 ℃溶液,分别与不同浓度的ALA25 ℃溶液等体积混合,得到LF25 ℃浓度为0.25 mmol/L,ALA25 ℃浓度分别为0.125、0.25、0.5、0.75、1.25、1.75和2.5 mmol/L的LF25 ℃和ALA25 ℃自组装复合物,记为LF25 ℃-ALA25 ℃复合物。采用相同方法,将0.5 mmol/L LF25 ℃溶液换成0.5 mmol/L LF90 ℃溶液,制备得到LF90 ℃和ALA25 ℃自组装复合物,记为LF90 ℃-ALA25 ℃复合物。
1.2.2 ζ-电位的测定 采用Zetasizer Nano-ZS90测定LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物的ζ-电位。测定温度25 ℃。
1.2.3 浊度的测定 采用HACH 2100N浊度计测定LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物的浊度。浊度仪采用90 °散射光原理,在入射光恒定条件下,散射光强度与溶液的浑浊度成正比。测定温度25 ℃。
1.2.4 粒径的测定 采用Zetasizer Nano-ZS90测定LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物的粒径大小,同时用多分散指数(PDI)表示粒径分布。测定温度25 ℃。
1.2.5 光学显微镜观察 采用Axio Vert.A1倒置生物显微镜观察LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物(其中ALA25 ℃的浓度为0.75 mmol/L)的形貌。放大倍数为1000倍。
1.2.6 荧光光谱测定 使用Cary-Eclipse荧光分光光度计进行荧光测量。激发波长设为292 nm,激发和发射狭缝宽度均为5 nm,记录发射波长300~500 nm范围的荧光光谱[20]。
1.2.7 红外光谱测定(FTIR) 将LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物(其中ALA25 ℃的浓度为0.75 mmol/L)置于-20 ℃下冷冻过夜后,使用真空冻干机将其冷冻干燥24 h,所得固体粉末按照1∶100的比例与溴化钾混合,制成透明薄片,进行FTIR分析。测定波数为500~4000 cm-1,扫描11次,分辨率为4 cm-1[21]。
1.3 数据分析
每组实验均重复两次,每个样品均检测三组数据,结果用平均值M±标准差SD表示。利用SPSS 18.0软件,采用Duncan法对数据进行单因素方差分析。利用Origin 9.0软件作图。
2 结果与分析
2.1 电位分析
ζ-电位是判断溶液中蛋白质电荷特性的重要指标,也是判断蛋白质与其它物质是否结合的重要依据。图1为不同ALA25 ℃浓度条件下,LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物的ζ-电位。LF25 ℃溶液和LF90 ℃溶液的ζ-电位分别为-3.36和-0.30 mV。这与Zhao等在相似pH环境下测得LF的ζ-电位为(+5.0±0.6) mV不同[22],推测LF上的阳离子基团吸附溶液中的阴离子磷酸盐所致[23]。这与Tokle等的报道一致[24]。
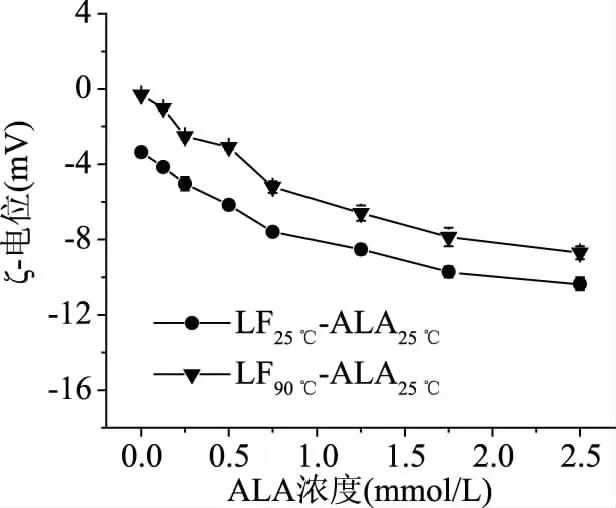
图1 ALA浓度对LF-ALA复合物电位的影响Fig.1 Influence of ALA concentration on theζ-potential of LF-ALA complexes
随着ALA浓度的增加,LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物ζ-电位始终呈现下降趋势。Tokle等指出:LF对磷酸盐离子的吸附行为并不影响LF与阴离子物质的静电吸引作用[24]。这表明ALA可能吸附在LF的表面[25]。通常,溶液中颗粒带电荷越多,斥力越大,颗粒间聚集的可能性越小,溶液越稳定。图中LF25 ℃-ALA25 ℃复合物的ζ-电位始终低于LF90 ℃-ALA25 ℃复合物,这说明LF25 ℃-ALA25 ℃复合物的稳定性较高。
2.2 浊度分析
浊度法是研究蛋白质聚集现象最直接、简便的方法,通过测量溶液中LF-ALA复合物的浊度能够直观评价溶液中LF和ALA的聚集行为[26]。图2为不同ALA25 ℃浓度条件下,LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物的浊度。
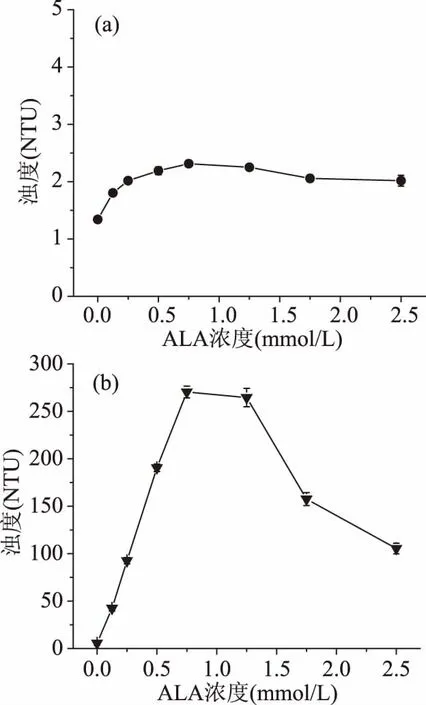
图2 ALA浓度对LF25 ℃-ALA25 ℃复合物(a)、LF90 ℃-ALA25 ℃复合物(b)浊度的影响Fig.2 Influence of ALA concentration on the turbidity ofLF25 ℃-ALA25 ℃ complexes(a)、LF90 ℃-ALA25 ℃ complexes(b)
对于LF25 ℃-ALA25 ℃复合物,随着ALA浓度的增加(0~0.75 mmol/L),LF25 ℃-ALA25 ℃复合物的浊度增加(尽管增加程度很小),这表明LF25 ℃与ALA25 ℃发生了相互作用,导致其浊度增加[27]。ALA浓度为0.75 mmol/L时,LF25 ℃-ALA25 ℃复合物的浊度达到最大值2.3 NTU;随着ALA浓度继续增加(0.75~2.5 mmol/L),浊度开始下降。这表明,此时溶液中的ALA过量,导致溶液中没有足够的LF与之结合;同时,由于越来越多的ALA吸附到LF表面,使得复合物表面负电荷增加(见图1),静电斥力增强,进而使溶液浊度降低[28]。
对于LF90 ℃-ALA25 ℃复合物,其浊度变化趋势与LF25 ℃-ALA25 ℃复合物一致,均随着ALA25 ℃浓度的增加,呈现先增加后下降的变化规律。不同的是,当ALA25 ℃浓度为0.75 mmol/L时,LF90 ℃-ALA25 ℃复合物的浊度高达270.4 NUT。这可能是由于热处理引起LF结构变化,LF90 ℃分子间较之LF25 ℃分子间更易于聚集[29];当与ALA25 ℃结合后,LF90 ℃分子间的聚集倾向更加明显,进而导致形成了超分子结构,使光散射强度增强,溶液浊度迅速增加。在LF与BLG[15]、溶菌酶和BLG[8]组装过程中,均观察到相似的浊度变化规律。
基于上述分析,推测LF90 ℃与ALA25 ℃可能通过以下机制进行结合。即:当ALA25 ℃物质的量比较低时,ALA25 ℃可作为多齿配体将两个LF90 ℃分子桥联,形成-(LF90 ℃-ALA25 ℃-LF90 ℃-ALA25 ℃)n-结构的蛋白质聚集体。但是,由于ALA25 ℃浓度较低,此时所形成的网状结构较小。所以,尽管溶液浊度增加,但不至于引起沉淀。随着ALA25 ℃物质的量进一步增加,溶液中有足够多的ALA25 ℃参与桥联作用,使得网状结构进一步增加,进而形成了颗粒较大的聚集体,溶液浊度增加,甚至产生沉淀。当ALA25 ℃物质的量继续增加,过量的ALA25 ℃占据了LF90 ℃表面的结合位点,导致桥联作用减弱,复合物出现复溶现象,浊度降低。Siebert等指出,蛋白质和多酚相互作用过程中,随着多酚浓度的增加,也存在浊度先增加后减小的现象,同时,将浊度减小归因于复溶现象[30]。这两种机制之间的关系需要进一步深入研究。
2.3 粒径分析
粒径的测量是一种光散射方法,它依赖于散射粒子的浓度、大小、折射率和入射波长,通过测量溶液中LF-ALA复合物的粒径大小及多分散性(PDI)变化,可以更深入地了解LF与ALA形成的超分子结构。图3为LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物的粒径、PDI随ALA25℃浓度的变化曲线。

图3 ALA浓度对LF25 ℃-ALA25 ℃复合物(a)、LF90 ℃-ALA25 ℃复合物(b)粒径与PDI的影响Fig.3 Influence of ALA concentration on theparticle size and PDI of LF25 ℃-ALA25 ℃complexes(a),LF90 ℃-ALA25 ℃ complexes(b)
由图3可知,与LF25 ℃(16.33±0.52 nm)相比,LF90 ℃(215.8±20.64 nm)的粒径较大,表明在磷酸盐缓冲溶液中,LF90 ℃较之LF25 ℃具有更强的自聚集能力。这也解释了LF90 ℃-ALA25 ℃复合物浊度较高的原因。随着ALA25 ℃浓度的增加,LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物的粒径与浊度变化趋势一致,均先增加后减小。LF25 ℃与ALA25 ℃形成的复合物为纳米颗粒。当ALA25 ℃浓度为0.75 mmol/L时,LF25 ℃-ALA25 ℃复合物粒径最大,为(35.24±0.82) nm。LF90 ℃-ALA25 ℃复合物多为微米颗粒。当ALA25 ℃浓度为0.75 mmol/L时,LF90 ℃-ALA25 ℃复合物的粒径也最大,为(4.11±0.14) μm;随着ALA25℃浓度的进一步增加,LF90 ℃-ALA25 ℃复合物的粒径开始下降。需要指出的是,当ALA25 ℃浓度为2.5 mmol/L时,LF90 ℃-ALA25 ℃复合物的粒径为(591.6±66.5) nm,为亚微米颗粒。这一结果表明:可以通过改变ALA的浓度来调控LF-ALA复合物的结构,进而得到纳米级、亚微米级和微米级颗粒。
PDI值是评价颗粒在溶液中分布情况的重要指标。LF25 ℃-ALA25 ℃复合物的PDI随着ALA25℃浓度的增加呈现上升趋势,但其数值始终在0.2~0.4之间,表明LF25 ℃与ALA25 ℃形成的纳米颗粒较为均一稳定;而LF90 ℃-ALA25 ℃复合物的PDI始终在0.5~0.8之间,表明LF90 ℃与ALA25 ℃所形成的聚集体大小不均一,易发生聚集而导致沉淀。
2.4 光学显微镜观察
通过光学显微镜更加直观地观察了当ALA25℃浓度为0.75 mmol/L时,LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物的微观形貌。由图4可知,在磷酸盐缓冲溶液中,ALA25 ℃和LF90 ℃均为球形颗粒,分布较均一。在LF25 ℃-ALA25 ℃复合物溶液中,可以清晰地观察到大量的球形聚集体,这些聚集体尺寸介于100~200 nm之间,分布较均匀;而LF90 ℃-ALA25 ℃复合物则形成清晰的网状聚集体,尺寸约为2~3 μm,分布不均匀。这进一步证实了LF90 ℃-ALA25 ℃超分子结构的形成。同时也进一步证实了所推测的可能结合机制(见浊度分析部分)。

图4 ALA、LF和LF-ALA复合物(ALA浓度为0.75 mmol/L)的显微镜照片Fig.4 Micrograph of ALA,LF and LF-ALAcomplexes containing 0.75 mmol/L ALA
2.5 荧光光谱分析
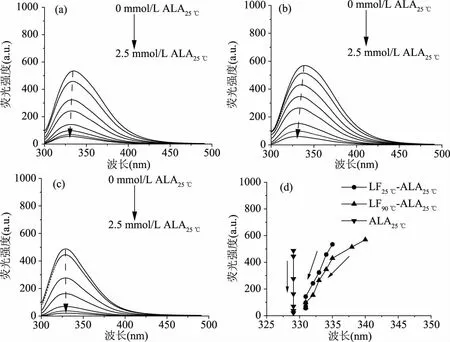
图5 不同ALA浓度下LF-ALA复合物和单独ALA的荧光光谱图(a~c)及荧光峰值变化(d)Fig.5 Fluorescence emission spectra(a~c)and peak value(d)of LF-ALA complexes and ALA alone at different ALA concentration注:(a)为LF25 ℃-ALA25 ℃复合物;(b)为LF90 ℃-ALA25 ℃复合物;(c)为单独ALA空白。
荧光淬灭法可以用来研究蛋白质与蛋白质之间的相互作用[31]。色氨酸(Trp)残基通常完全或部分埋藏在蛋白质内部的疏水核心中[32],通过监测色氨酸荧光发射峰的变化(强度变化和峰位移),可以获取色氨酸周围微环境变化和蛋白质结构变化的信息。当色氨酸基团位于天然蛋白质的内部时,色氨酸发射峰可能发生蓝移;当蛋白质变性展开,色氨酸发射峰可能发生红移[33]。
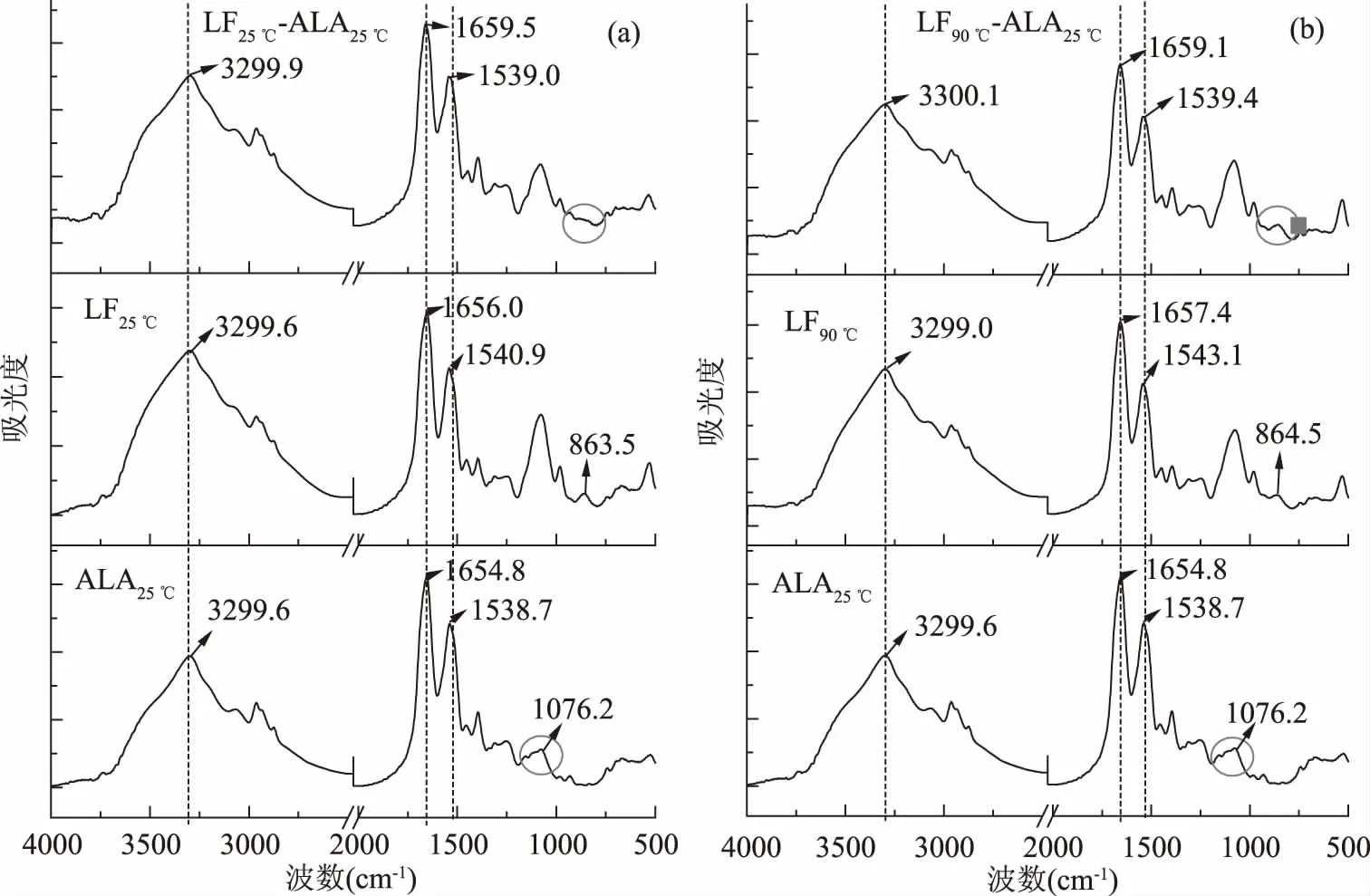
图6 LF,ALA25 ℃和LF-ALA25 ℃复合物(ALA浓度为0.75 mmol/L)的傅里叶变换红外光谱图Fig.6 FTIR spectra of LF,ALA25 ℃ and LF-ALA25 ℃ complexes containing 0.75 mmol/L ALA
如图5所示,LF25 ℃、LF90 ℃和ALA25 ℃的最大发射峰分别为335、340和329 nm。随着ALA25 ℃浓度的增加,LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物的荧光强度逐渐降低,表明:热变性前后LF和ALA25 ℃之间均存在结合行为。同时,最大发射峰均蓝移至331 nm,但并没有与ALA25 ℃的最大发射峰重叠。这表明Trp基团位于LF的内部,荧光强度降低说明了ALA25 ℃的添加增加了LF25 ℃和LF90 ℃分子中色氨酸的疏水性。即,LF25 ℃/LF90 ℃与ALA25 ℃之间的相互作用导致埋藏在LF分子内部的Trp残基暴露程度降低[33]。该结果与Monteiro等研究结果相似,在ALA和溶菌酶结合时,溶菌酶中Trp残基更加难以暴露于溶液环境中[31]。
2.6 FTIR分析
FTIR(400~5000 cm-1)是分析蛋白质结构变化的有力工具[34]。当蛋白质结构变化时,其红外光谱,尤其是酰胺A带、酰胺I带和酰胺II带的峰强度或峰位置会发生改变[35]。同时,通过FTIR可以判断LF与ALA非共价相互作用类型。图6分别为单独LF、ALA25 ℃,LF25 ℃-ALA25 ℃、LF90 ℃-ALA25 ℃复合物的红外光谱。
如图6所示,ALA25 ℃在1076.2 cm-1处有较宽的特征峰,代表C-O间的伸缩振动,LF25 ℃、LF90 ℃分别在863.5、864.5 cm-1有肩峰,这与CO2H中的弯曲振动有关[35],而在LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物中,这些峰均消失,这进一步表明LF25 ℃/LF90 ℃与ALA25 ℃之间发生了相互作用。
FTIR中酰胺A带(3310~3270 cm-1)通常与O-H间氢键的伸缩振动有关[19]。LF25 ℃和LF90 ℃的酰胺A带分别在3299.6和3299.0 cm-1处,而ALA25 ℃的酰胺A带在3299.6 cm-1处。在LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物的红外光谱中,复合物的酰胺A带分别蓝移了0.3和1.1 cm-1。这清晰地表明:氢键参与了LF25 ℃/LF90 ℃与ALA25 ℃之间的相互作用。
酰胺I带(1625和1750 cm-1)的C=O伸缩振动和酰胺II带(1475和1575 cm-1)的C-N伸缩振动均与蛋白质的二级结构单元间的氢键有关[36]。由图6可知,LF25 ℃和LF90 ℃的酰胺I带分别在1656.0和1657.4 cm-1处,ALA25 ℃的酰胺I带在1654.8 cm-1处。而在LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物中,酰胺I分别蓝移至1659.5和1659.1 cm-1。酰胺I的蓝移表明:热处理前后,LF中的C=O基团均参与了与ALA25 ℃的相互作用。LF25 ℃和LF90 ℃的酰胺II带分别在1540.9和1543.1 cm-1处。而在LF25 ℃-ALA25 ℃复合物和LF90 ℃-ALA25 ℃复合物中,酰胺II分别红移了1.9和3.7 cm-1。这一结果表明:LF中的C-N基团也参与了与ALA25 ℃的相互作用。
3 结论
综上,LF-ALA25 ℃复合物受LF结构的影响。天然LF与ALA自组装可形成纳米颗粒,粒径最大为(35.24±0.82) nm,颗粒分布均匀,稳定性较高;经过热变性,LF结构发生改变,与ALA自组装可形成的超分子结构,粒径最大为(4.11±0.14) μm。同时,ALA的添加降低了埋藏在LF内部的Trp残基的暴露程度。LF中的C=O和C-N基团均参与了与ALA25 ℃的相互作用。该研究为构建新型双蛋白结构提供了理论依据。
