江西省猪和啮齿动物宿主小肠结肠炎耶尔森菌病原学研究
2020-07-23刘晓青徐晓倩熊长辉黄星魁
杨 梦,王 鹏,袁 辉,刘晓青,徐晓倩,熊长辉,黄星魁,段 然,王 鑫
小肠结肠炎耶尔森菌(Yersiniaenterocolitica,Y.e)是一种在自然界以猪、啮齿动物等动物为宿主并分布广泛的一种人兽共患病病原菌。该菌通过被污染的食物、水,经粪口或与动物接触感染,引起一系列消化系统、呼吸系统、心血管系统和全身疾病。为了解江西地区小肠结肠炎耶尔森菌在宿主动物的分布和病原特征,本研究采集了2011-2016年猪咽拭子及肠内容物,鼠盲肠部内容物及舌根部标本,进行小肠结肠炎耶尔森菌的分离培养及鉴定,同时对筛选出的小肠结肠炎耶尔森菌进行血清分型、生物分型、相关毒力基因检测及脉冲场凝胶电泳,为预防江西地区小肠结肠炎耶尔森菌传播提供科学依据。
1 材料与方法
1.1样本 采集2011-2013年在江西省生猪屠宰场的生猪咽拭子202份、肛拭子100份;采集2013-2016年江西省鼠疫监测点的鼠盲肠部内容物及舌根部标本各358份,其中包括2013年采集的标本270份,2014年采集的标本54份,2016年采集的标本34份,2015年未采集标本。
1.2试剂及仪器 细菌的分离培养选用美国BD公司的耶尔森菌选择性培养基(Yersinia selective ager)及其配套抗生素及英国OXOID公司的哥伦比亚营养琼脂;细菌的菌种鉴定选用法国生物梅里埃公司(bioMérieux, France)的Api 20E生化鉴定条及其配套试剂;小肠结肠炎耶尔森菌的分型血清选用日本生研株式会社的分型血清试剂(O∶3、O∶5、O∶8、O∶9);酶切、电泳及成像分别选用TaKaRa公司的NotⅠ、蛋白酶K,Cambraex Bio Science Rockland公司的琼脂糖SeaKem Gold Agarose及美国Bio-Rad公司的CHEF Mapper XA脉冲场凝胶电泳仪和GEL Doc2000凝胶成像系统。
1.3 方 法
1.3.1菌株分离培养和鉴定 将采集生猪的咽拭子、回盲肠部位标本及啮齿动物的舌根部、回盲肠部位标本以1∶10的比例接种于改良PBS增菌液中,放至4 ℃冷增菌21 d后的增菌液上下颠倒混匀后,提取细菌DNA,利用PCR扩增检测foxA保守基因。将PCR结果为foxA阳性的标本接种于小肠结肠炎耶尔森菌选择性平板(CIN),25 ℃培养24~48 h,挑取菌落形态疑似“公牛眼”状(细菌的菌落中心为深红色,外周有一环呈无色透明)的菌落, 接种于克氏双糖斜面25 ℃培养24 h。挑选克氏双糖斜面表现为:葡萄糖、乳糖阳性、不产气、H2S阴性的菌落,接种于尿素培养基和半固体培养基,选择尿素酶阳性,25 ℃培养动力阳性、37 ℃培养动力阴性,革兰染色镜检为革兰氏阴性杆菌或椭圆或球杆菌细菌,用Api 20E生化板条28 ℃培养48 h,进行细菌生化的鉴定。
1.3.2血清学分型 本研究采用玻片凝集法进行血清分型(O∶3、O∶5、O∶8、O∶9)。选择少量纯培养的细菌,用生理盐水制成细菌悬液,通过研磨分型血清观察有无凝集颗粒形成,同时以生理盐水自凝作为对照。
1.3.3生物分型 将纯培养的小肠结肠炎耶尔森菌菌株按参考文献[1]的方法进行生物分型。
1.3.4DNA提取及毒力基因PCR检测 用细菌基因组DNA提取试剂盒,参照说明书步骤,从标本增菌液中提取标本的全基因组DNA。将鉴定分离到的79株小肠结肠炎耶尔森菌,进行6种毒力基因(ystA、ystB、yadA、virF、ail和rfbc)的PCR扩增,引物序列见参考文献[2]。采用50 μL PCR体系对提取的核酸进行扩增。体系如下:10×buffer 5 μL,上下游引物各1 μL,dNTPs终浓度0.2 mmol/L,模板DNA 5 μL,Taq DNA聚合酶(BioAsia)0.5 μL(5 u/μL),无菌水补齐至50 μL。
1.3.5脉冲场凝胶电泳(PFGE)分型分析 按照国家致病菌识别网标准化操作程序,主要参数如下:调整细菌悬液浓度至3.8-4.2 MCF;使用45 UNotI进行酶切;电泳脉冲时间:2~20 s;电泳时间:18 h。将PFGE图像录入到BioNumerics(Version 5.10,Applied maths公司,比利时)软件包识别图像条带,用Dice系数(Dice coefficients,SD)表示每两个图像之间的相似性系数。采用非加权配对算术平均法(unweighted pair group average method, UPGMA)进行聚类分析,并构建聚类树。
2 结 果
2.1标本分离结果 在2011-2016年间,本研究采集猪和鼠的标本共1 018份,分离到小肠结肠炎耶尔森菌79株,阳性率为7.76%(79/1 018)。
2.1.1生猪携带情况 2011-2013年采集猪咽拭子共202份,分离到小肠结肠炎耶尔森菌61株,阳性率为30.20%(61/202),采集猪肛拭子100份,分离到2株小肠结肠炎耶尔森菌,阳性率为2.0%(2/100)。其中2011 年采集102份猪咽拭子标本,分离到小肠结肠炎耶尔森菌56株,阳性率为54.90%(56/102);2013年采集100份猪咽拭子标本,分离到小肠结肠炎耶尔森菌5株,相对应的100份肛拭子标本,分离到小肠结肠炎耶尔森菌2株。见表1。
2.1.2鼠携带情况 2013-2016年采集鼠盲肠部内容物及舌根部标本共716份,其中鼠盲肠部内容物标本358份,分离到14株小肠结肠炎耶尔森菌,阳性率为3.91%(14/358),鼠舌根部标本358份,分离到2株小肠结肠炎耶尔森菌,阳性率0.56%(2/358)。见表1。
2013年鼠盲肠部内容物及舌根部标本共540份,其中盲肠部内容物标本分离到7株小肠结肠炎耶尔森菌,舌根部标本未分离到小肠结肠炎耶尔森菌;2014年鼠盲肠部内容物及舌根部标本共108 份,其中盲肠部内容物标本分离到6株小肠结肠炎耶尔森菌,舌根部标本分离到2株小肠结肠炎耶尔森菌;2016年鼠盲肠部内容物及舌根部标本共68 份,其中盲肠部内容物标本分离到1株小肠结肠炎耶尔森菌,舌根部未分离到小肠结肠炎耶尔森菌。
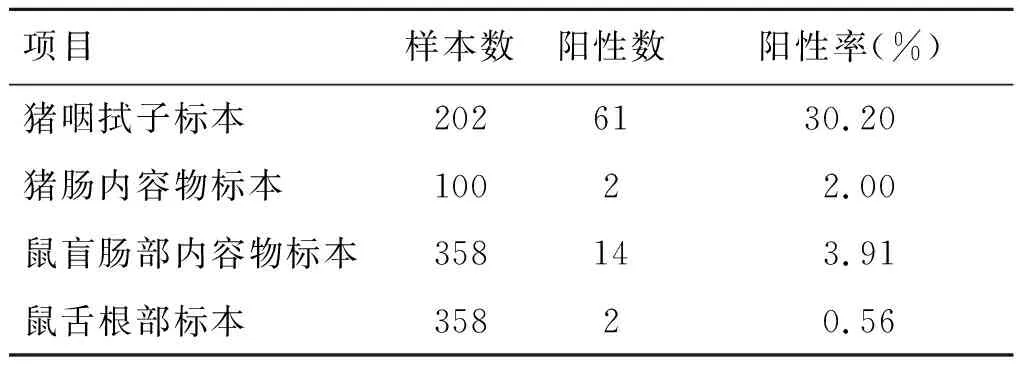
表1 2011—2016年猪、鼠标本中小肠结肠炎耶尔森菌分离情况Tab.1 Isolation of Yersinia enterocolitica from pigs and mice in 2011-2016
2.2菌株血清型、生物型结果 对79 株小肠结肠炎耶尔森菌进行血清分型和生物分型,发现有3种血清型(O∶3、O∶5以及O∶8)及2种生物型(1A型和3型);其中63株猪标本分离株血清分型均为O∶3血清型,生物分型62株为生物3型,1株不能分生物型;16株鼠标本分离株中,有3株O∶5血清型菌株,生物型全为 1A 型;有1株O∶8血清型菌株,其生物型为 1A型;未分型菌株共有12株,生物型均为1A型,见表2。
2.3菌株毒力基因检测结果 对79株小肠结肠炎耶尔森菌的6个基因(ystA、ystB、ail、yadA、rfbc、virF)进行PCR检测,结果显示,在63株O∶3血清型菌株中,59株携带ystA、yadA、virF、ail、rfbc基因,4株携带ystA、ail、rfbc基因;有12株携带ystB基因,其他的4株菌均为阴性,见表2。
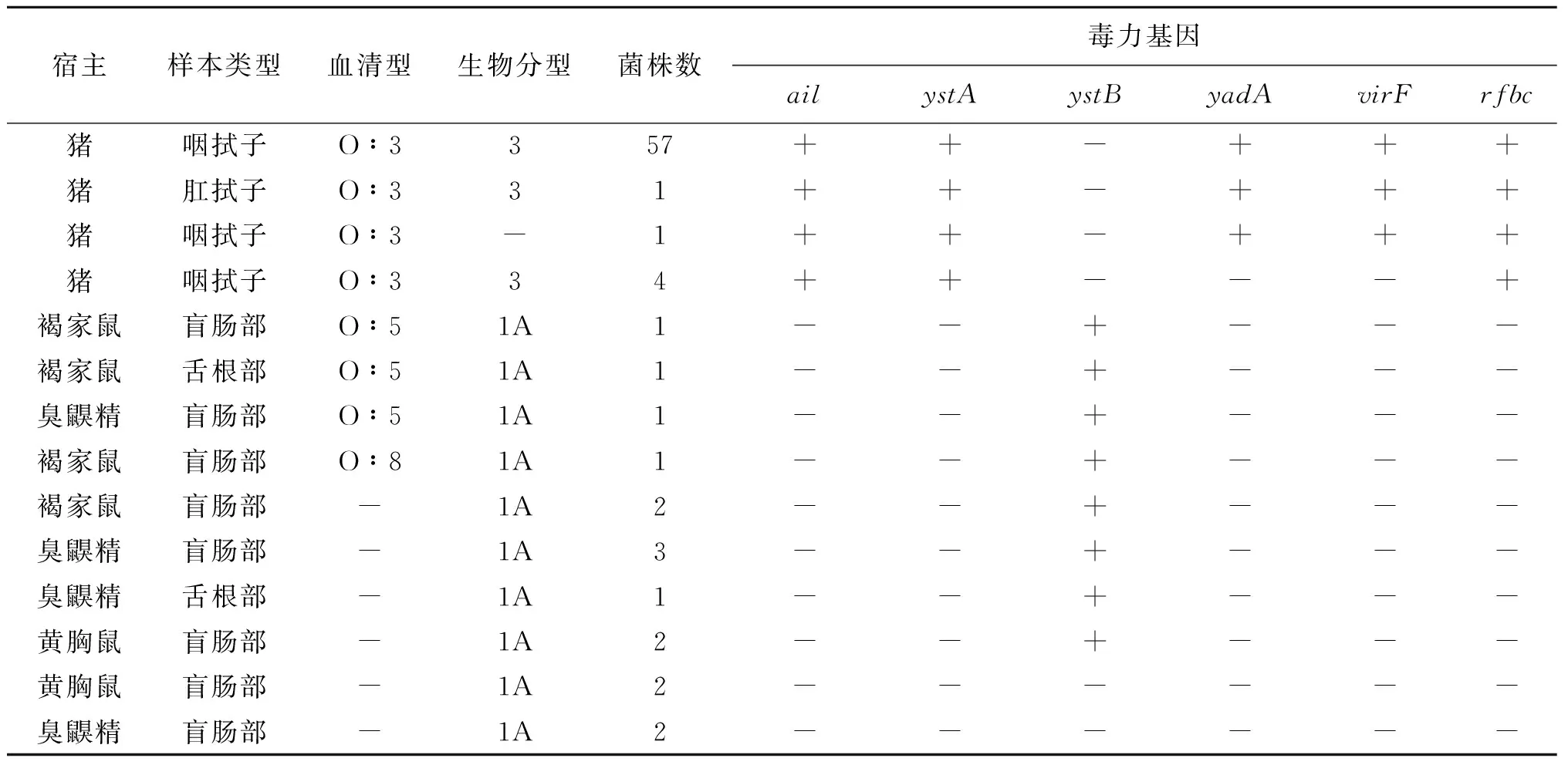
表2 79株小肠结肠炎耶尔森菌血清型、生物型和毒力基因型别及检测结果Tab.2 Serotypes, biotypes and virulence genotypes and distribution of 79 strains of Yersinia enterocolitica
2.4 PFGE分型结果
2.4.1致病性菌株PFGE分型结果 使用NotI内切酶对O∶3血清型的63株小肠结肠炎耶尔森菌进行酶切,并进行PFGE分型分析。结果显示,带型相似系数为90%~100%,可分为K6GN11-C30021、K6GN11C30012、K6GN11C30098、K6GN11-C30061、K6GN11C300100、K6GN11C30059 6种带型,以 K6GN11C30021为主要型别,占所有菌株的80.95%(51/63)。见图1A。
2.4.2非致病性菌株PFGE分型结果 使用NotI内切酶对1A生物分型的16株小肠结肠炎耶尔森菌进行酶切,并进行PFGE分型,结果表示,带型相似系数在70%~100%,可分为15种PFGE带型。见图1B。
3 讨 论
通过对1 018份猪、啮齿动物宿主标本进行核酸检测,总检出率为7.76%(79/1 018),初步了解江西省以生猪、啮齿动物为宿主的小肠结肠炎耶尔森菌的检出情况。生猪、啮齿动物检出率分别为20.86%(63/302)、2.24%(16/716),提示生猪可能为小肠结肠炎耶尔森菌的主要宿主,与国内外监测结果一致[3]。猪咽拭子的检出率为30.20%(61/202),猪肛拭子的阳性率为2.0%(2/100),这一结果表示,猪的扁桃体带菌率可能高于猪的回盲部内容物带菌率。
不同宿主动物的分离株的血清型和生物型差异较大。在生猪标本中,63株分离株均为致病性O∶3血清型,其中有62株是生物3型,有1株不能分生物型;在鼠标本中,16株为非致病性血清型O∶5、O∶8和某些未分型菌株,以1A型生物型为主。据此分析,对于存在不同血清型和生物型的小肠结肠炎耶尔森菌,动物的易感性不同:猪对致病性菌株的易感性较高,而啮齿动物对非致病性菌株的易感性较高。
毒力基因检测结果表明,目前被认为是小肠结肠炎耶尔森菌位于染色体上的重要毒力基因ystA在63株O∶3血清型菌株中均可检测到,其与菌株的致病性相关。本次监测中带有ystA基因的菌株主要来源于生猪,提示生猪可能在小肠结肠炎耶尔森菌的流行、传播与致病中起到重要作用。而16株生物1A型的菌株中,除12株携带ystB基因外,其他毒力基因检测均为阴性。一般认为,生物1A型为非致病性菌株,而携带ystB基因的生物1A型菌株与人类腹泻有显著的流行病学关联,可能对人类健康构成危害[4-5]。由此提示,应该提高对啮齿动物中非致病性生物1A型小肠结肠炎耶尔森菌的警惕性,防范其对该区域居民造成健康危害。
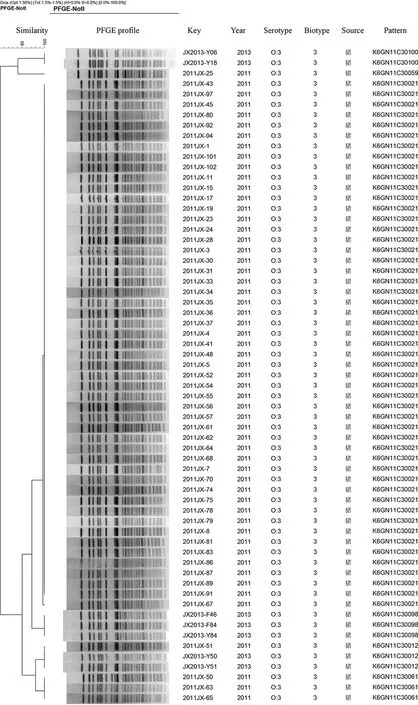
A
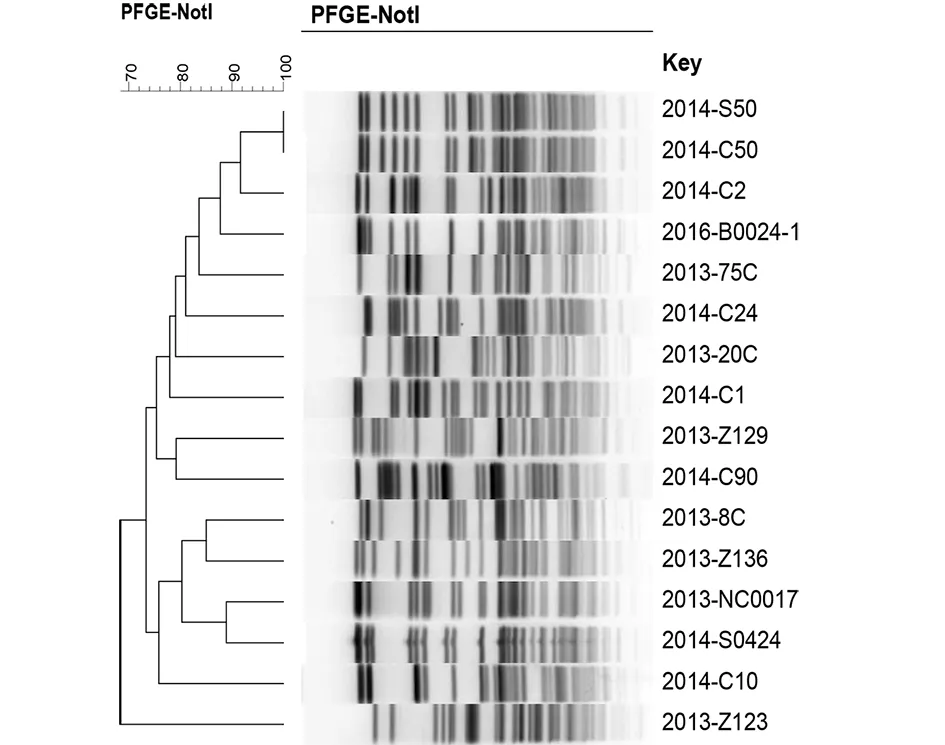
BA为63株O∶3血清型小肠结肠炎耶尔森菌PFGE分型聚类图 B为16株生物l A型小肠结肠炎耶尔森菌PFGE分型聚类图图1 小肠结肠炎耶尔森菌PFGE分型聚类图Fig.1 PFGE cluster tree of Yersinia enterocolitica strains
近年来,PFGE作为分子分型的“金标准”,稳定性好、敏感性高,被广泛用于菌株的遗传关系的研究中[6-7]。63株血清型为O∶3型的致病性菌株可分为6个带型,以K6GN11C30021为主要类型,聚类相似性较高,优势型显著,占80.95%(51/63)。K6GN11C30021这种带型与河南、江苏、宁夏回族自治区、内蒙古自治区、青海和四川分离株的带型一致,与北京、天津和云南分离株带型不一样(K6GN11C30012)。与致病性小肠结肠炎耶尔森菌的分型特点存在差异的是,16株生物1A型的非致病性菌株可分为15种PFGE带型,其总体聚类相似性比较低,遗传一致性不高,个体间的带型差异较大,呈现多元化流行趋势。
小肠结肠炎耶尔森菌作为一种在自然界以多种动物为宿主并分布广泛的人兽共患病病原菌,已发现有30多种动物携带小肠结肠炎耶尔森菌[8]。其宿主生猪,尤其是猪咽拭子中,分离率较高[9]。本研究中生猪咽拭子分离结果也进一步证实,生猪可能是小肠结肠炎耶尔森菌的某些致病性菌株的主要宿主,这大大增加了猪养殖和加工的从业人群的感染风险。因此,该地区应加强生猪中小肠结肠炎耶尔森菌的监测,降低其在猪体内的的感染风险,控制小肠结肠炎耶尔森菌的传播。
利益冲突:无
