流行性感冒
2020-07-23张智芳王晓欢梁小洁林志龙严延生
张智芳,王晓欢,梁小洁,林志龙,严延生
流行性感冒(influenza)简称流感,由流感病毒(influenza virus)引起急性呼吸道症状,主要侵犯机体呼吸道和肺部。早期症状包括发热、寒战、头痛、全身酸痛、乏力、嗜睡,肺部和呼吸道表现咽喉痛、干咳及鼻塞等。流感病毒主要分4型,即甲型、乙型、丙型、丁型,一般由甲和乙型致病人类,丙(C)型只发生在少数幼儿中,散发且症状不典型,丁(D)型宿主为牛,对人类基本不致病[1]。流感病毒起源不详,可能几个世纪前就有该病毒引起的疾病存在。该病是典型的人兽共患病,病毒宿主为禽类、猪及人类,有季节性流行和大流行之分。1930年英国首先分离出流感病毒,1935年美国研制出第一株流感疫苗。该病具有传染性,病毒在人类中长期循环存在。
1 病原学特征
1.1形态结构及分类 流感病毒属于正黏病毒科(Orthomyxoviridae)流感病毒属,为单股、负链分节段RNA病毒。根据病毒核蛋白(nucloprotein, NP)和膜蛋白(membrant protein, MP)抗原特性不同,人类致病性流感病毒分为甲、乙、丙,即A、B、C 3型,分别用 IAV、IBV及ICV简称。A、B型核膜包裹8个RNA节段,C型有7个节段(缺少编码神经氨酸酶蛋白节段)。用冷冻电子显微镜观察自鸡胚培养的两株IAV,约80%病毒粒子呈球形并有包膜,直径约为80~120 nm,其余病毒粒子呈多形性结构[2]。
IAV至少编码产生11 个蛋白。病毒表面可凝聚红细胞并具有抗原性的血红素(hemagglutinin, HA),可和宿主受体唾液酸结合的神经氨酸酶(neuraminidase,NA),负责离子通道的基质蛋白2(matrix2, M2),由这3种蛋白构成病毒的双层包膜。HA约占包膜总量80%,NA约占17%,M2蛋白量很微(每个病毒粒子只有16~20个分子)。HA的形态和功能类似冠状病毒的刺突蛋白,主要起型抗原性及侵入细胞作用;NA主要起释放子代病毒并清理唾液酸的作用。脂二层包膜主要成分是宿主膜的胆固醇。包膜的下层是基质蛋白1(matrix 1,M1),其内表层围着组成病毒8节段vRNAs为核心的遗传物质。vRNAs由核蛋白(nucleoprotein,NP)和微量的核运输蛋白(nuclear export protein, NEP)包绕着每一节段的RNA组成,在vRNAs的一端还有称为“3P蛋白”RNA依赖的多聚蛋白酶(RdRp),RdRp复合物由聚合酶酸性蛋白酶(polymerase acidic protein,PA)、聚合酶碱性蛋白酶1(polymerase basic protein1,PB1)和聚合酶碱性蛋白酶2(polymerase basic protein2,PB2)组成;由NP和NEP蛋白结合每一节段病毒RNA及顶端的3P蛋白构成病毒核糖核蛋白复合物(viral ribonucleoprotein comples,vRNP); IAV的非结构蛋白(non-structural protein,NSP)编码抗病毒反应蛋白拮抗剂;PB1片段还编码促凋亡蛋白PB1-F2[3-4]。见图1。
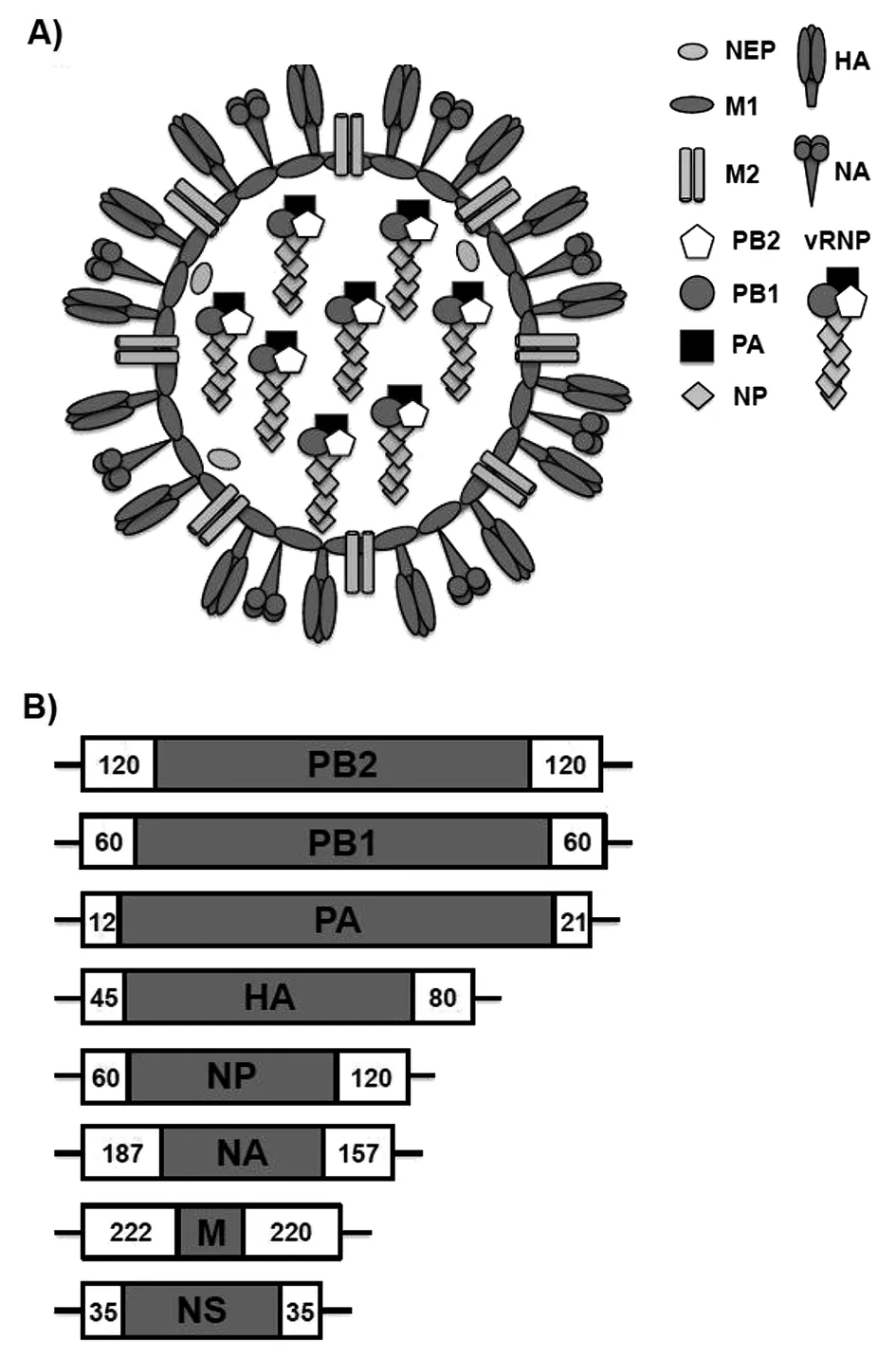
A) IAV的电脑模式图。 HA:血凝素;NA:神经氨酸酶;NEP:核移动蛋白;M1:基质蛋白1;M2:基质蛋白2;PB2:聚合酶碱性蛋白酶2;PB1:聚合酶碱性蛋白酶1;PA:聚合酶酸性蛋白酶;NP:核蛋白;vRNP:病毒核糖核蛋白复合物。B) IAV 8节段单股、负链vRNA基因组的基因组成及其每一节段vRNA编码的主要蛋白。如下:PB2, PB1, PA, HA, NP, NA, M, and NS。白框表示每个vRNA选择性包装入病毒粒子的信号,而数字则表示每个vRNA节段含有包装信号的核苷酸长度,黑线代表病毒基因组复制和转录时可被病毒RdRp识别的3′~5′非编码区(NCRs)。图1 甲型流感病毒(IAV)病毒和基因组结构(引自参考文献[4])Fig.1 Influenza A virus (IAV) virion structure and genome organization
迄今发现IAV有18个HA亚型(H1~H18),11个NA亚型(N1~N11),由这些血清型组成各种流感病毒株[5-6]。一般称血清型 H1~H3株为季节性流行株,其他组合型大多为禽流感株。2012~2013年分别从蝙蝠中测得核苷酸序列H17N10和H18N11,但病毒株至今仍未分离到。IBV只有山形(Yamagata)和维多利亚(Victoria)两型[7]。
流感病毒按以下公式命名分类:型别/宿主/分离地点/毒株序号(指采样时标本号)/分离年代(血凝素和神经氨酸酶亚型)[8]。
1.2IAV的生命循环 IAV的感染和产生子代周而复始的过程即是的IAV生命循环(见图2)。首先IAV的HA与宿主唾液酸的结合起始感染过程,因此,从感染来说,其宿主受体是非常重要的。在人类主要位于上呼吸道的α2,6键结合半乳糖的唾液酸,禽类则主要在于下呼吸道的α2,3键结合半乳糖的唾液酸[9],而在猪上呼吸道既有α2,6键结合半乳糖的唾液酸、也有α2,3键结合半乳糖的唾液酸,因此把猪称为流感病毒的混合器。
IAV HA的酸化(pH5~6)裂解出了HA1和HA2,其次HA2与宿主上皮细胞(巨噬细胞)内小体膜融合,M2进一步酸化促使M1释放vRNP进入宿主细胞质中,通过病毒NP,vRNPs被转运到病毒复制和转录的细胞核,进行vRNP的复制与转录。由进入细胞核的病毒RdRp操控了细胞的解旋酶、复制酶等,首先形成发夹状RNA,合成正链RNA,再转合成具有IAV特征互补的负链RNA;其次转录IAV mRNA,这种转录需要有引物引导,病毒 RdRp识别PB2活化了宿主细胞核的5′端帽酶,截取或偷窃(cap-snatching)了12~14个核苷酸作为引物[3],而3′端聚腺苷酸尾则由IAV 自带的RdRp序列作为引物转录mRNA,原则上这种转录机制可以转录单个PB2、HA、NA和NA蛋白和多个的PB1、PA、M和NS蛋白。在细胞核中复制的IAV遗传物质和转录生成的蛋白由NP及NEP在β肌动微纤毛的协同配合下移出细胞核,其中HA、NA和M2被转运到细胞的内质网中进行脂或糖基化修饰,最后由信号引导至细胞膜极性化顶端,等待包装好的vRNPs从极化的细胞膜顶端出芽生殖(图 2),按信号装配成功的子代病毒粒子具有感染性可以再感染周边细胞,完成了IAV的第一代生命循环。而在复制、转录等过程不能按照装配信号要求形成正确的8节段的vRNPs的子代病毒粒子或缺失某蛋白的子代病毒粒子则不能再感染周边细胞[10]。
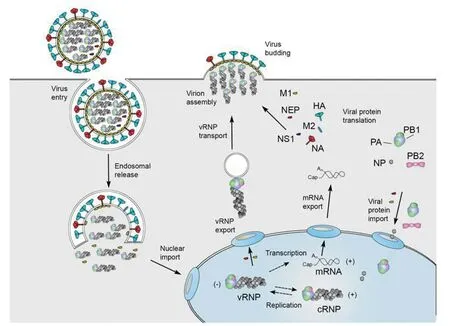
注:圆型为病毒粒子,方框示细胞内环境,方框内蓝色椭圆型部分为细胞核;各符号代表见图1。图2 甲型流感病毒(IAV)生命循环图(引自参考文献[10])Fig.2 Influenza A virus life cycle
2 流行特征及过程
流感一般分为流感大流行、季节性流感及禽流感。流感大流行一般难以预测,往往涉及禽或猪类流感病毒节段基因的重排。季节性流感指引起常年人类的流感,其抗原性的变化多为病毒的遗传物质发生“漂移”引起;其流感病毒亚型为H1~H3。据WHO报告,全球每年因流感发病300~500万人,严重感染者有约29~60万例死亡,是全球一大公共卫生的高负担疾病。禽流感有高、中、低致病性之分(致禽类死亡程度而分),高致病性禽流感一般为H5N1。2013年3月始,我国曾一度发生低致病性禽流感H7N9在活禽市场引发人感染事件,多年来感染病例合计1 537例;2017年2月份在广东发现的H7N9发生2个位点的变异而可能成为高致病性禽流感株后[11-12],同年9月在农业部的协调下,约有85%的禽类用含H5和H7的二价兽用疫苗免疫接种,此后终止了H7N9禽流感病毒的变异及感染人。我国每年禽类养殖在50亿羽以上,由于禽流感的流行可引起人员的死亡以及因疫情需要扑灭禽类,引起巨大的经济损失[12]。其他禽流感病毒亚型一般为低致病性,偶尔引起死亡病例发生。
2.1传染源、传播途径和易感人群 引起季节性流感发生的传染源为人类循环散发的流感患者,其本质是HA或NA病毒抗原发生位点突变的结果。猪和一些禽类在禽流感传播中可作为传染源。传播途径一般是经呼吸道途径,由飞沫或密切接触传播;从某种程度来说,全人群为流感易感人群。但按WHO分类,需接种流感疫苗的易感人群分为5类[13]:①孕妇;② 6个月~5岁儿童;③65岁以上老者;④ 患除单纯高血压外的基础疾病及免疫低下者;⑤ 医务工作者。
2.2时空分布 流感一般全年可以发生,但病例多寡有季节性分布。所谓季节性流感,在全球有南北半球的流行。在我国以长江为界,南北流行也很明显,北方约发生在每年的 11月至次年的2月份,即在冬季流行;南方如福建省、广东省,一年有两次流行,一次在夏季,约7~8月份,另一次在冬季。
甲型流感一般3~4年一次小流行,10~15年一次大流行,这种周期性流行与亚型病毒变异及人群免疫水平有关。乙、丙型周期性不明显。流感在全球各地均可发生,但不同地区间因气候因素、人群密集程度、交往频度、传染源数量、人群免疫情况、病毒抗原变异及防控策略措施不同其发病率出现较大差别。一般而言流感流行是先城市后农村,先平原地区后山区,没交通线路蔓延。
2.3流行状况 持续不断的流感流行,主要是由于流感病毒HA和NA的抗原易变性,抗原变异幅度大小直接影响流感流行的强度和规模。小幅度的变异即抗原漂移(drift),属于量变,其结果多引起中小型流行;而抗原转换(shift)即发生了较大幅度的抗原变异,形成新亚型,是质变,其结果常引起世界性大流行。
1918年大流感的死亡率高达3%~5%,其他3次全球流感大流行的发病率与死亡率也不能与1918年的比较。而作为季节性流感来说,其死亡率一般在0.003%~0.005%之间。
2.3.11918年流感大流行 1918年的流感大流行始于1918年的春天,一个不同寻常的特征是大多数的死亡病例发生在15至34岁的健康成年人中,要知道,这些身体健康的年轻人相对老幼来说拥有更强大的免疫力和自我修复力。而这场瘟疫在全球范围内流行,根据保守的统计数字,它至少感染了5亿人,死亡人数为2 500~5 000万人,而因为很多偏远地区和战乱无法统计,有学者认为,死亡人数超过一亿,而当时世界的全部人口也只有17亿而已。
Taubenberger等[13]从1918年一死者的福尔马林固定、石蜡包埋肺部组织中用RT-PCR扩增到4个节段9个基因的DNA片段,并进行测序分析,证实当初流行的IAV为H1N1[13]。2005年,Taubenberger等[13]又从埋葬于阿拉斯加冻土带下1918年因流感死亡的一女尸肺中获得标本,将其复活为具有活性的H1N1病毒,作为对照,取一经修饰暂称为德州的IAV,该H1N1病毒感染肺细胞株、小鼠与德州IAV进行比较,感染1 d后从肺细胞株中释放的病毒50倍高于德州IAV,感染2 d后小鼠失重13%,感染4 d后该病毒在小鼠肺部中的量高于德州IAV,6 d后感染该复活的H1N1小鼠全部死亡。当时认为该病毒可制成最有毒力的生物战剂[14]。
2.3.21957年H2N2大流行 1957年2月,我国西南贵州省首先检测出该流感的流行,4月份蔓延至中国香港,导致发生250 000个病例;此后5月,流行至日本和新加坡。该流感最终造成全球100~400万死亡,是中华人民共和国成立后流行最严重的流感。
1957年下半年第二波流感再度肆虐我国各省,虽然采取了关闭公共设施如学校、电影院等措施,但缺医少药造成不少的病例死亡[12]。同年,这一事件促使国家成立了流感中心(Chinese National Influenza Center,CNIC)进行流感的监控。
由于流感对人类的威胁,因此1947年WHO开展了全球流感项目,1952年成立了全球流感监测网络(the Global Influenza Surveillance Network,GISN),1957年的流感大流行即成为GISN的首个监测项目[12]。
2.3.31968年流感大流行 1968年7月大流行的流感株由H3N2引发。首先从香港突发病例,约15%的香港人群发病。疫情扩散蔓延至印度及澳大利亚北部城市。此后,1968-1969 冬疫情流行至北半球国家,全球约有(100~400)万死于该流感流行。我国虽处于“文化大革命”期间,大多数公共卫生资料没有收集。但由广东、四川、上海、北京、哈尔滨和青岛等仍有流感样病例(influenza-like illness,ILI)报告给CNIC,统计分析认为1968 年的年度报告的ILI 仍是1968-1992年报告的最高年份[12]。
2.3.42009年 H1N1pdm09流感大流行 2009年4月份墨西哥和美国等报告了甲型流感的流行,美国首先检测确定了该流感是由甲型H1N1流感病毒引起。 H1N1病毒的全基因组核苷酸测序表明,该病毒是由北美猪系的H1N1和欧亚猪系H1N1流感病毒的基因组重组而成,因此称为“猪源性甲型流感病毒”,以H1N1pdm09称之,区别现季节性H1N1 IAV。
2009年4月25日,根据《国际卫生条例》的规定,世卫组织(WHO)总干事宣布2009年 H1N1疫情为国际关注的突发公共卫生事件。4月27日,WHO将流感大流行疫情警戒级别从3级提高到4级;4月29日,WHO又把流感大流行的警戒级别从4级提高到5级,表明大流行迫在眉睫,6月11日,WHO将全球流感大流行警戒级别再升至6级。这是WHO 40年来第一次把传染病警戒级别升至最高级别。本次疫情相对多只引起轻症发生,但也蔓延到214个国家和地区,导致近20万人死亡,历时一年,2010年4月10日宣布本次大流行结束。
这次大流行美国估计发生大约6 080万例感染(95%可信限为4330万~8930万例),27.4万例住院治疗(195 086~402 719),死亡12 469例(8 868~18 306)。我国报告12.7多万例病例,住院治疗4 859例,死亡病例800多例。
本次大流感促进了我国进一步加强流感监测网的投入和建设,监测实验室增至411个,哨点医院增至556个[12]。
2.4禽流感在我国的发生 1997年及2005年分别在香港及我国内地发生高致病性禽流感的流行;2013年始迄今,我国流行H7N9禽流感,2017年2月份我国监测发现H7N9基因组发生2个位点的突变,有可能导致高致病性禽流感的流行。2017年9月我国对禽类进行了H5和H7二价兽用流感疫苗的接种,此后至今仅5个人病例的发生,合计病例1 537例,病死率高达近40%。其他亚型禽流感病例也引起个例死亡病例发生,但很快就被扑灭。禽流感的发生,引起很大的经济和人员死亡的损失,以致引起我国主要城市“白条鸡鸭”上市的改革[12]。
3 重症流感的病理机制
重症流感的引发肺炎病理机制有2种,季节性流感或流感大流行大多为随后感染化脓性细菌引起肺炎的发生[15-16],但也有少数是由于病毒的大量复制引发“细胞因子风暴”使肺部积血、充水、纤维化而致重症;H5N1、H7N9禽流感病毒和引发个别死亡的低致病性禽流感病毒也是由于肺部“细胞因子风暴”而致重症的[17]。
4 诊疗及实验室检测
4.1流感治疗 流感致病性与感染的毒株型别侵染有关,临床表现也不尽相同。个体免疫状况与感染也有密切关系,出现隐性感染或显性感染。一般感染流感后的潜伏期很短,为1~4 d,平均2 d。起病急,伴有发热(38 ℃或以上),全身中毒症状明显,表现为头疼、肌疼和严重不适,上呼吸道症状明显;婴幼儿有高热惊厥及拒奶等现象[18]。
流感的药物治疗一般抑制流感病毒的3个靶点,一是离子通道M2抑制剂,以金刚烷胺或金刚乙胺治疗,本世纪已发现该位点全部发生突变,现已不用该抑制剂治疗。二是神经氨酸酶(NA)抑制剂, 目前用磷酸奥司他韦(达菲)在流感发病48 h之内用该药治疗有效,该药2000年初被美国FDA批准用于13岁以上人群的治疗[19],但流感患者常超过时间就诊,临床医生发现在加倍使用奥司他韦情况下对此类还有作用;扎那米韦(zanamivir),因药效不稳定,我国未批准使用。三是RNA聚合酶抑制剂,该药有法匹拉韦和巴洛沙韦(Baloxavir),前者已在日本上市,美国也批准使用,但其使用范围主要为轻症;后者仍处于研究阶段。用流感恢复期血浆治疗也有用于重症流感治疗,但需要注意其中和抗体效价及安全性。季节性流感的治疗还配用抗生素(一般对老年人及幼童),以预防细菌随后侵入感染引起的大叶性肺炎。除此以外,一般以支持疗法或卧床休息为主。
4.2实验室检测 一般三大常规检测更要注意外周血象检测结果。白细胞计数范围广,没有发现明显的由细菌续发感染引发的肺炎症状时,看不出白细胞增高情况;中性粒细胞和淋巴细胞是白细胞的重要组成部分,特别是中性粒细胞占比达50%~70%,是对抗入侵细菌最重要的防卫细胞,特别是急性化脓性细菌入侵时,会引起中性粒细胞的增高;重症患者的淋巴细胞数量降低;另一重要指标是C反应蛋白(CRP),在感染、炎症等应急状态下,血浆中CRP会迅速增高[19]。
实验室直接检测流感病毒是特异性检测方法,现最精确的做法是用咽拭子采取口咽部标本提取RNA作qRT-PCR检测。因分离病毒较耗时,已较少用于疾病的早期诊断,但在病毒抗原变异监测中仍发挥重要作用。血清学检测一般用于感染或疫苗接种后评估流感病毒特异性抗体水平高低,常用的方法有血凝抑制试验(HIA)、中和试验和酶联免疫试验(ELISA)等,用于早期诊断,与qRT-PCR方法相比,其敏感性和特异性均较低,已基本不采用。
5 防治对策
目前尚无有效的控制流行性感冒流行的措施,为一世界性问题,一旦出现大流行,各国都难幸免。防治对策主要以降低发病率和死亡率为目的,以反复疫苗接种和各国协调一致的疫情监测和控制为重点。
5.1策略的实行 该策略包括3个部分,简介、概论和策略的实行。其中概论包括了4个应对内容措施。一是强调对公共卫生难以解决的问题需进行研究和创新;二是对全球流感的监测、溯源和资料利用;三是扩展季节性流感的预防控制和保护易感人群;四是为使全球更安全,要切实加强流感大流行的准备和应对。在策略的实行里也包括两大内容,一是概述2002年以来的主要对流感防控(包括对SARS、MERS等呼吸道病毒性疾病)成效;二是在2019-2030年流感应对策略中可能遇到的预防、控制等出现的问题和对策。客观地说,2002年以来的流感防控策略是取得了很大的成效,全球从1952年开始的全球流感系统的监测协作从最初的几个发展到目前110个国家的150个研究机构的参与;期间平息了SARS疫情;2005年制定了可操作的《全球卫生条例》(International Health Regulation,IHR);发现并控制了MERS的流行;开展了对医院SARI病例的报告和诊断,促进全球各地在流感(或呼吸道病毒性疾病)的防控、诊断和应对(包括防护衣帽、消毒物质的储备等)。
要是没有这样的储备,应对2019年末发生的新冠肺炎的流行可能情况更糟。
5.2WHO注重流感疫苗对流感的应对 WHO在2019-2030年全球流感应对策略中,特别强调采用疫苗保护易感人群的作用。流感疫苗每年需要通过全球100多家流感实验室报送当年流感流行的亚型,并经WHO的5个参比实验室经抗原测定,每年2次例会推荐企业生产用的疫苗株。对于多数疾病而言,目前主要使用五类疫苗,包括灭活苗、减毒苗、活病毒载体苗、基因重组苗和DNA或mRNA苗。但对于流感疫苗来说,主要是灭活苗(鸡胚苗)、活病毒载体苗(MDCK等细胞苗)两类。前者至少占全部苗的90%以上,又可分为主要含病毒颗粒的甲醛灭活苗、裂解苗和亚单位苗3种;甲醛灭活苗基本上保存了完整的病毒颗粒,其预防免疫效果也最为突出,但副作用稍大些;裂解苗系由完整的病毒颗粒经裂解后去除病毒RNA等,暴露出各病毒组成成分,免疫效果好,副作用也小,目前主要是这类疫苗在使用;亚单位苗,主要是血凝素HA成分,免疫效果小于裂解苗,但副作用较之裂解苗也小,这种苗大多用于儿童和65岁以上老人群中。活病毒载体苗主要是表达HA蛋白苗或添加有细胞免疫和/或体液免疫作用的佐剂(如MF59等)苗;流感疫苗目前主要是这4种。但因为抗原“漂移”的缘故,其保护作用一般只能达到60%,有的年份因预测不准或其他因素使选择的疫苗株不能匹配,还无法达到这样的保护效果,这也就是为什么流感疫苗需要年年注射接种预防的主要原因。
利益冲突:无
