茶用菊苗期枯萎病抗性鉴定技术研究
2020-07-03李媛媛柳丽娜陈素梅房伟民陈发棣管志勇
李媛媛 刘 晔 柳丽娜 赵 爽 陈素梅 房伟民 陈发棣 管志勇
(南京农业大学作物遗传与种质创新国家重点实验室/农业农村部景观设计重点实验室/园艺学院,江苏 南京 210095)
菊花(Chrysanthemum morifoliumRamat.)为菊科菊属宿根性草本植物,是中国十大名花之一,其栽培历史悠久,除用于观赏外,还有药用、饮用、食用等多种价值。 菊花茶气味芳香,消暑生津,利血脉,除湿痹,养肝明目[1-3]。 长期饮用菊花茶能调节心肌功能,降低胆固醇[4]。 近年来,随着生活水平的不断提高,人们对茶用菊的需求量日益增加。
枯萎病是由尖孢镰刀菌(Fusarium oxysporum)引起的一种土传性病害[5-8],而茶用菊枯萎病常造成植株死亡,严重影响茶用菊安全生产,是茶用菊生产的主要限制因子之一[9-13]。 尖孢镰刀菌从根部入侵[8-12],造成植株生长缓慢,叶片黄化、脱落,茎部维管束变褐腐烂,植株矮化,严重时导致植株死亡,造成严重的经济损失[14]。 茶用菊常连作栽培,枯萎病更易频发,严重影响了茶用菊的产量与品质。 目前,在菊花枯萎病防治中,主要措施是轮作换茬、采用抗性砧木嫁接[15-16]。 但嫁接存在费工、费时育苗效率不高的问题,在生产上大面积推广尚有难度;轮作换茬防治茶用菊的枯萎病效果明显,但限制了茬口的安排,两者在生产推广使用中存在一定局限性[17-20]。 种质资源作为育种的基础,其抗病性往往能影响育成品种的抗病水平[21]。优异抗病茶用菊种质资源的发掘对推动茶用菊花种质资源创新和新品种选育具有重要意义。 广泛收集种质资源并进行抗病性鉴定是抗病遗传育种工作的重要内容,采用科学合理的鉴定方法是先决条件[22]。 开展茶用菊资源品种的抗病性评价,从而筛选出抗病资源用于抗病育种,可极大提高育种效率。 因此,本研究主要通过采集发病茶用菊,在枯萎病病原菌分离、鉴定和致病力研究的基础上,开展茶用菊资源苗期枯萎病人工接种鉴定,旨在筛选出优良的枯萎病抗性品种,同时为茶用菊枯萎病抗性基因的挖掘与利用奠定基础。
1 材料与方法
1.1 试验材料
31 个茶用菊品种由南京农业大学中国菊花种质资源保存中心提供;病株采自湖北省麻城市福田河镇福白菊生产田。 马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)与马铃薯葡萄糖水培养基(potato dextrose water,PDW)培养基均购自青岛高科园海博生物技术有限公司。
1.2 试验方法
1.2.1 病原菌分离、纯化和保存 采用组织块分离法分离病原菌,即取病株茎基部的病健交界处,先用自来水冲洗干净,再将其分解成小的组织块,用流水冲洗15 min,随后用70%酒精表面消毒30 s,再用15%H2O2消毒15 min,反复3 次,再用无菌水冲洗4 次,并用灭菌滤纸吸干水分,接种在固体PDA 培养基上[23]。25℃暗培养4 d,从培养基上长菌植物材料周围,挑选单个菌落边缘转接到新的PDA 培养基上3 次,单孢菌株培养至纯化。 保存时,沿菌落边缘打直径约5 mm的菌块3 块,置于装有30%甘油的2 mL 离心管中,保存于-80℃冰箱中备用[24]。
1.2.2 病原菌鉴定 形态学鉴定:将分离得到的菌株接种在PDA 培养基上,25℃培养7 d,观察菌落形状、颜色、大小等形态特征,并观察菌丝和分生孢子的显微形态特征。
分子生物学鉴定:应用真菌18S rDNA/ITS 进行鉴定。 采用真菌DNA 提取试剂盒(Fungal DNA Kit,OMEGA,Bio-Teck,美国)提取真菌的基因组DNA。采用ITS1-F:5′-CTTGGTCATTTAGAGGAAGTAA-3′,ITS4: 5′-TCCTCCGCTTATTGATATGC-3′引物对病原菌的基因组DNA 进行PCR 扩增。 产物通过20 g·L-1琼脂糖凝胶电泳检测,切胶、纯化后,由思普金生物公司进行测序。 采用NCBI-BLAST 进行序列比对,采用Mega 5.05 软件利用Neighbor-joining 法构建系统进化树。
1.2.3 病原菌致病力鉴定
1.2.3.1 病原菌孢子悬浮液的制备 将保存的尖孢镰刀菌菌株在PDA 平板上活化,25℃培养箱中暗培养5~10 d,再转至PDW 液体培养基中,于180 r·min-1、25℃振荡培养3 d。 将培养好的菌液用无菌双层纱布过滤,用16×25 血球计数板计数,并将孢子悬浮液浓度调至成1×106个·mL-1的孢子浓度悬浮液备用。
1.2.3.2 病原菌致病性鉴定 应用1.2.3.1 中制备的孢子悬浮液对福白菊进行苗期人工接种,以不接种植株为对照,试验各处理重复3 次,通过统计病株,计算发病率以及病情指数。
取生长状态一致的福白菊插穗,扦插于穴盘(长12 cm、宽6 cm)中,待其生根后,移栽至营养钵中,钵内基质为草炭和珍珠岩(质量比为3 ∶1),培养5 d 后,即为供试福白菊幼苗。 选取健壮且长势一致的福白菊幼苗,将幼苗随机分成3 个重复,每个重复10 株,以不接种植株为对照。 接种植株在进行伤根处理后采取灌根法接种植株,每株幼苗每克土定量灌注1×106个·mL-1孢子浓度的悬浮液1 mL。 接种当天不浇水,第2 天开始正常的栽培管理。
病情调查与统计:接种后第7、第14、第21、第28、第35 天调查发病率与病情指数。 枯萎病病情分级标准、抗病类型分别见表1 和表2[21,25-26]。 病情指数(disease severity index,DSI)计算公式如下:
DSI=[∑(每级病株数×相应级数)×100/(调查总株数×最高病级)]。

表1 接种尖孢镰刀菌病菌后病情的分级标准Table 1 The grading standards of disease severity after inoculation with F. oxysporum

表2 病情指数的抗病评价标准Table 2 The equivalence of disease severity index
1.2.4 不同茶用菊材料的抗性鉴定 根据1.2.3 中的试验结果,筛选出致病力较强的一株菌株,对31 个茶用菊品种进行苗期人工接种鉴定,接种后35 d 统计并计算发病率与病情指数。 人工接种方法,病情指数统计与计算方法同1.2.3.2。
1.2.5 数据分析 利用Microsoft Office Excel 2003、SPSS 20.0 以及Mega 5.05 对数据进行处理及统计分析。
2 结果与分析
2.1 病原菌分离及鉴定
从福白菊病株分离纯化得到2 个病原菌菌株,分别命名为M15 和M16。 2 个菌株在PDA 培养基上的菌落均为圆形,菌落呈浅粉色至粉色,菌丝呈绒毛状(图1)。 菌株M15 背面颜色较浅,且正面有白色絮状突起(图1-A、B);菌株M16 背面颜色较深,正面无白色絮状(图1-C、D)。 分生小孢子呈卵形、椭圆形或肾形;分生大孢子呈镰刀形,略弯曲(图2)。 根据上述结果,初步判断 2 个菌株均为尖孢镰刀菌(F.oxysporum),但属不同的生理小种。
为了进一步确定菌株种类和分类学地位,提取菌株的基因组DNA,应用真菌18S rDNA/ITS 对2 个菌株进行片段扩增以及测序。 测序结果与NCBI 核苷酸序列比对,该菌株与尖孢镰刀菌相似度达99%以上,且在系统发育树上聚为一支(图3),结合菌株形态学特征,确定该菌株为尖孢镰刀菌。

图1 分离的尖孢镰刀菌株的菌丝体形态Fig.1 Mycelium of isolated F. oxysporum

图2 尖孢镰刀菌孢子形态Fig.2 Spore morphology of F. oxysporum
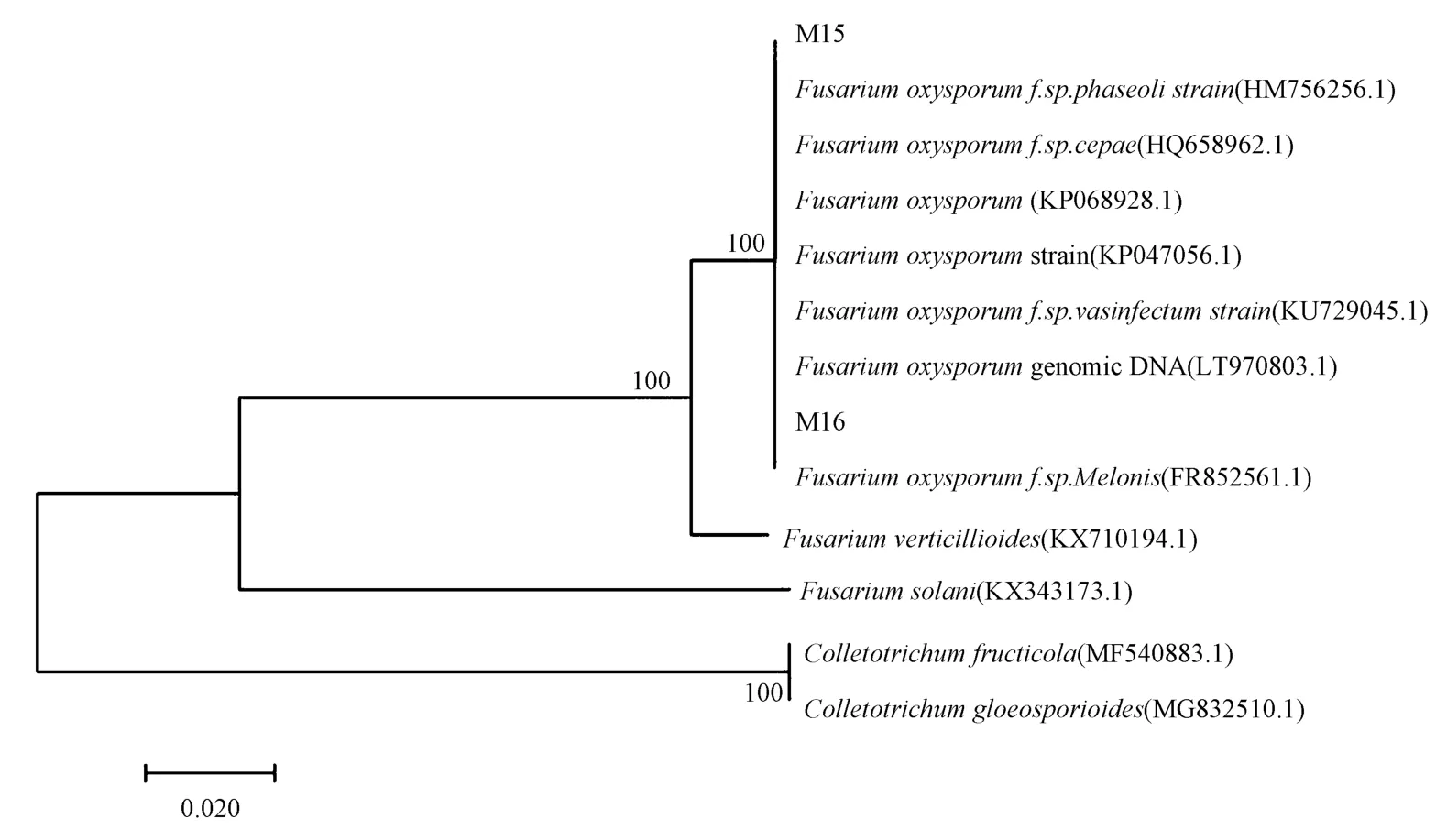
图3 基于ITS 基因序列菌株M15 与M16 的Neighbor-joining 系统发育树Fig.3 Neighbor-joining phylogenetic tree of M15 and M16 based on ITS gene sequence
2.2 病原菌致病力鉴定
在福白菊幼苗上人工接种2 个菌株鉴定其致病力。由表3 可知,福白菊在接种2 种菌株后14 d 时开始发病。 接种菌株M15 的福白菊在14 d 时,发病率为100%,而接种菌株M16 的发病率只有33.33%;接种菌株M15 的福白菊在28 d 时的病情指数为56.67,比接种菌株M16 的福白菊的病情指数高25。
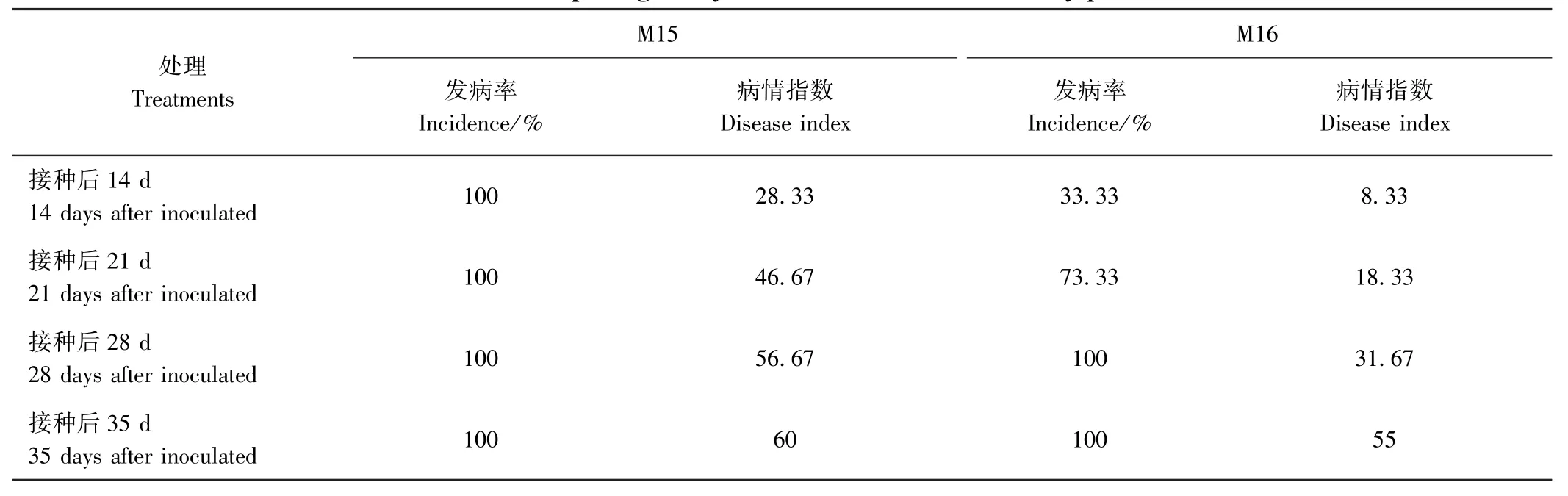
表3 不同尖孢镰刀菌致病力鉴定Table 3 The pathogenicity evaluation of different F. oxysporum
由图4 可知,福白菊在接种菌株M15 14 d 时,基部叶片已经变黄,而接种菌株M16 14 d 时无明显发病症状。 因此认为菌株M15 和M16 均为引起茶用菊枯萎病的致病菌株。 综合上述致病力的检测结果可知,菌株M15 的致病力较菌株M16 强。 根据科赫氏法则,将接种菌株M15 和M16 的发病植株重新分离病原菌,再次获得与原分离菌一致的菌株M15 和M16。

图4 接种病原菌后植株生长情况Fig.4 The growth of plants were inoculated with F. oxysporum
2.3 不同茶用菊品种抗病性鉴定
应用致病力检测中筛出的强致病尖孢镰刀菌菌株M15 对31 个茶用菊品种进行苗期人工接种鉴定,结果显示(表4),31 个茶用菊品种中有1 份高抗材料,即七月白(图5-A、B),病情指数为8.34;9 份抗病材料,包括休宁药菊、射阳大白菊等;17 份中抗材料,包括苏菊13 号、九月菊等;3 份感病材料,包括福白菊、苏菊6 号和小黄菊;1 份高感材料,即皇菊(图5-C、D),病情指数为73.34(表4)。 对2 次鉴定试验进行相关性分析,2 次试验显著相关,相关系数为0.860(表5)。
3 讨论
3.1 引起茶用菊枯萎病病原菌的分离及鉴定
田间土壤、发病植株中同时存在多种病原,分离病原菌并确定致病病原菌,是抗病鉴定的关键[27-28]。18S rDNA/ITS 具有序列片段小等优点,能够反映出属间以及差异菌株间碱基对的差异,并且可以从相对较小的序列中获得足够的遗传信息[29],广泛应用于真菌的属种间及部分种内组群水平的系统学研究[30-32]。本研究首次从连作多年的福白菊生产田群体发病的病株上分离病原菌,根据科赫氏法则,运用形态学与18S rDNA/ITS 分子生物学的鉴定,综合构建的系统发育树分析,2 个致病菌株被鉴定为尖孢镰刀菌。 表明引起福白菊枯萎病的主要致病菌为尖孢镰刀菌,小种类型有待确定。
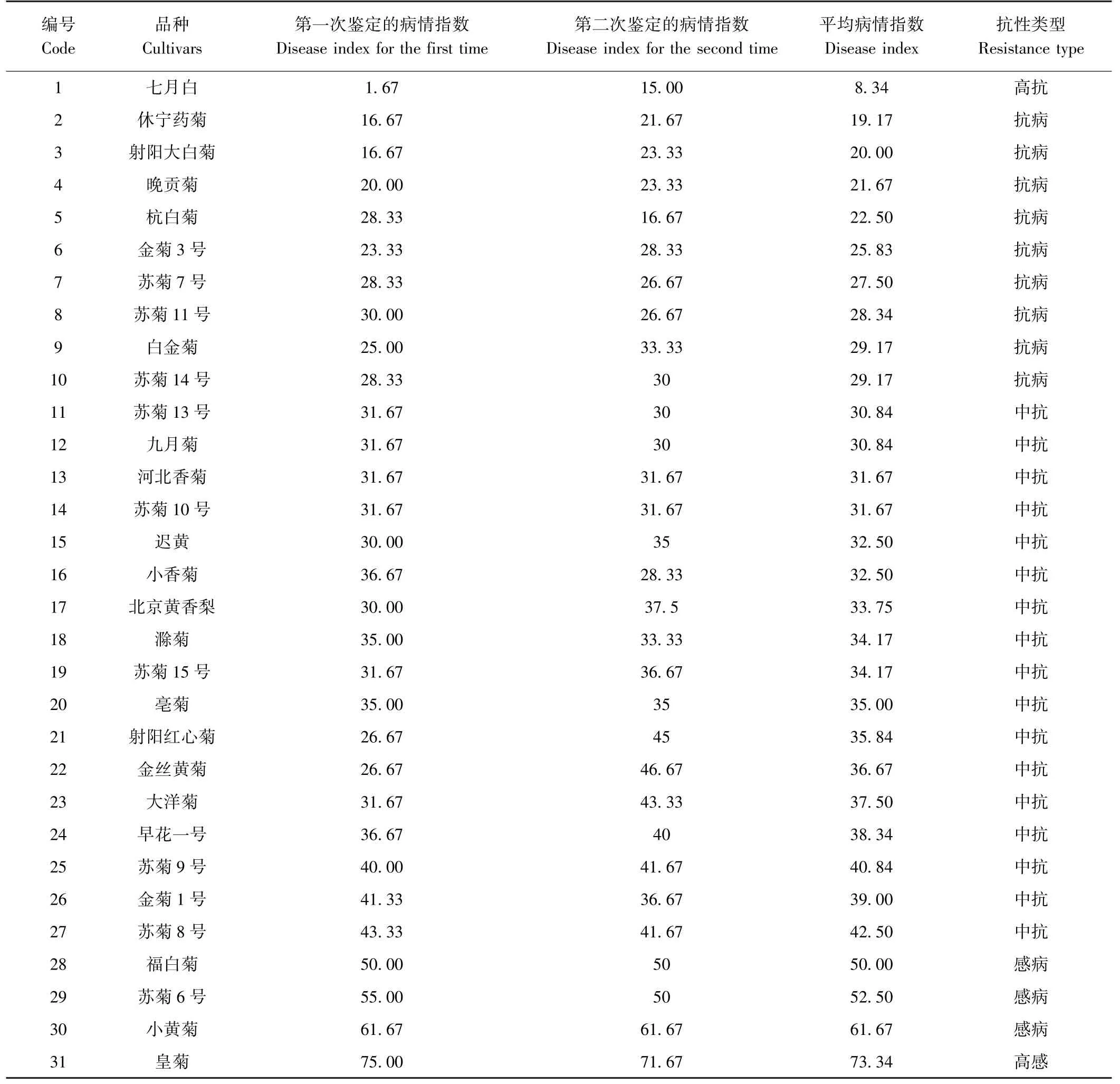
表4 茶用菊资源枯萎病抗性鉴定Table 4 Identification results on resistance to F.oxysporum M15 in Chrysanthemum for tea resources

表5 2 次试验相关性Table 5 Correlation between the two experiments
3.2 茶用菊枯萎病抗性评价体系的建立
种质资源的抗性筛选是抗性育种的基础,抗病性研究应基于可靠的抗性鉴定[33]。 在抗病品种改良的全过程中,育种亲本的选配、后代群体与新品种(品系)抗性表现的评判都依赖抗性鉴定[34-35]。 抗病鉴定评价的工作量大、可靠性要求高,建立高效的抗病鉴定评价体系具有重要意义[36]。 对本试验分离到的2 个菌株的枯萎病致病力进行鉴定后发现,M15 的致病力较M16 强,且由于在系统发育树中没有聚在一枝,推测2 个菌株属于尖孢镰刀菌的不同生理小种。 病原菌菌株致病力的强弱决定了致病力的效率[37-38]。 本研究采用致病力更强的菌株M15 进行人工接种,病情发展相对适中,鉴定效率高。 田间自然调查鉴定由于受气候环境等因素的制约,发病具有不确定性,需要多年、多点进行联合鉴定,并采取一些栽培调控措施[22,39-40]。 应用苗期接种病原菌鉴定植株病害抗性,周期短,速度快,可节省人力物力,能快速获得种质的抗性信息。

图5 接种0、35 d 时高抗品种七月白与高感品种皇菊的生长情况Fig.5 Highly resistance Qiyuebai and highly susceptible Huangju at 0,35 days post inoculation
许高娟[41]通过离体接种与苗期接种鉴定了33 份菊花近缘种属植物苗的抗黑斑病抗性;王顺利等[42]通过田间调查结合人工接种鉴定了47 个中国传统菊花品种的白锈病抗性;赵银平[21]通过田间调查结合苗期人工接种鉴定对32 份西瓜种质资源进行枯萎病抗性鉴定,发现大田鉴定与苗期人工接种鉴定结果无显著差异。 本研究利用建立的茶用菊苗期枯萎病抗性评价体系,对31 份茶用菊种质资源进行了2 次枯萎病抗性评价试验,2 次试验结果显著相关,说明本研究建立的茶用菊品种抗枯萎病的鉴定方法可用于茶用菊枯萎病抗性鉴定。 该方法鉴定周期短,有助于育种工作者快速了解育种材料的抗感性,提高育种工作效率。
3.3 茶用菊枯萎病抗性材料的筛选
品种改良依赖于可靠、客观的鉴定结果[33]。 相对于针对个别资源零星与分散的鉴定,在同一时间、同一条件下批量进行资源抗性鉴定,其结果更具有可比性,具有筛选优异种质的实际意义[43-44]。 目前,针对园艺作物种质资源的枯萎病抗性鉴定方面多有报道[45-48],并且开展了抗病机制方面的研究[49-55]。 张慧琴等[56]通过从发病猕猴桃枝条上分离与鉴定致病菌株,并接种病原菌鉴定了18 份种质材料的抗性,最终获得了2份高抗溃疡病的种质材料;杨宇红等[45]采用苗期抗性鉴定技术,从108 份不同来源甘蓝资源中筛选出40 余份抗枯萎病材料。 茶用菊、药用菊等功能性菊花产业规模、栽培面积远超观赏菊。 但有关其抗病鉴定方面的研究很少,有关抗枯萎病方面的研究更是鲜见报道。筛选优异抗性资源是抗病育种的基础工作,因此选育枯萎病高抗品种并推广是解决茶用菊枯萎病的根本办法。
4 结论
本研究从福白菊发病植株中分离出致病菌株尖孢镰刀菌,在病原菌鉴定和筛选的基础上,对31 个茶用菊品种进行了苗期人工接种鉴定。 筛选得到了1 份高抗品种,9 份抗病品种,17 份中抗品种,3 份感病品种以及1 份高感品种,品种群体表现出多层次的抗性水平,为茶用菊抗病性鉴定提供了借鉴。 筛选出的抗性品种,可应用于抗病基因的挖掘,或作为潜在的亲本用于抗病品种改良。 本研究为茶用菊的抗病机理研究和抗枯萎病新品种选育奠定了基础。
