EIAV Rev 蛋白拮抗eqTRIM5α介导的AP-1 信号通路的机制研究
2020-06-05宋丹丹王晓钧
宋丹丹,那 雷,王晓钧
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
TRIM5α 是TRIM 蛋白家族的重要成员之一。TRIM 蛋白家族是三结构域家族,包括N 端RING 锌指结构、B-box 结构和一个卷曲螺旋结构(Coiled coil,CC)。这3 个结构简称为RBCC 结构域。除了RBCC 结构域外,TRIM5α C 端还有一个B30.2(SPRY)结构域。TRIM5α是一种限制逆转录病毒跨种间感染的宿主蛋白,其SPRY 结构域特异性结合逆转录病毒的衣壳蛋白,加速衣壳解体,导致病毒反转录复合体降解,进而阻碍病毒复制过程。同时,TRIM5α也作为一种模式识别受体,特异性识别逆转录病毒的衣壳蛋白所形成的网格结构,招募E2 泛素结合酶复合体UBC13-UEV1A,催化形成游离的K63 多聚泛素链,在TAB2、TAB3 作用下活化TAK1,最终通过激酶级联反应激活AP-1和NF-κB信号通路,抑制病毒复制[1-2]。本实验室已经证明恒河猴TRIM5α激活AP-1 信号通路除了依赖于RING 结构域外,还需要完整的SPRY 结构域[3]。虽然马TRIM5α(eqTRIM5α)不具有完整的SPRY 结构域,但在293T 细胞中过表达的eqTRIM5α可以利用人源相关信号转导蛋白强烈激活AP-1 和NF-κB 信号通路[4]。
本实验室前期已经筛选到EIAV 的Rev 蛋白可以负调控宿主eqTRIM5α介导的AP-1信号通路,但是其机制还不清楚。本研究将pcDNA3.1-EIAV-Rev-HA 质粒分别与含eqTRIM5α及下游信号转导蛋白TAK1、TAB2、P38 和c-Jun 基 因 的 质 粒 共 转 染HEK 293T 细胞,利用荧光素酶报告试验及western blot 试验,证明EIAV 的Rev 蛋白显著下调eqTRIM5α介导的AP-1 信号通路,是通过蛋白酶体途径特异性降解P38 蛋白完成,本研究为进一步理解EIAV 与宿主蛋白相互作用及病毒逃逸机制提供了参考依据。
1 材料与方法
1.1 质粒与细胞 pcDNA3.1-TAK1-Flag(简称pTAK1-Flag,全文pcDNA3.1 载体均按该简称)、pTAB2-Flag 和pc-Jun 真核表达质粒由瑞士日内瓦大学Luban 教授惠赠;pGL3-AP-1-Luc 报告质粒、pRL-TK内 参 质 粒、pcDNA3.1、peqTRIM5α-HA、pEIAVRev-HA、pP38-Flag 质粒和HEK 293T 细胞均由本实验室保存。
1.2 主要试剂 Polyjet 转染试剂购自SignaGen Laboratories公司;鼠抗Flag单克隆抗体(MAb)购自OriGene公司;鼠抗HA MAb、鼠抗β-actin MAb、蛋白酶体抑制剂MG132、DMSO 均购自Sigma 公司;IRDye800CW标记的羊抗鼠IgG 购自KPL 公司;双荧光素酶报告系统购自Promega 公司;细胞裂解液1(150 mmol/L Tris-Cl、 50 mmol/L NaCl、 5 mmol/L EDTA、 1%Triton X-100,PH=7.6)、细 胞 裂 解 液2(50 mmol/L HEPES、50 mmol/L KCl、0.25%NP-40、1 mmol/L DTT、100 mmol/L NaCl,PH=7.9)均由本实验室配制。
1.3 EIAV Rev 对eqTRIM5α激活的AP-1 信号通路的检测 待12 孔板中的HEK 293T 细胞培养至细胞融合度80%时,参照Polyjet 转染试剂说明书,第一组转染900 ng pcDNA3.1 空载体质粒为阴性对照;第二组共转染450 ng peqTRIM5α-HA+450 ng pcDNA3.1质粒;第3 组共转染450 ng peqTRIM5α-HA+450 ngpEIAV-Rev-HA 质粒;第4 组共转染450 ng pEIAVRev-HA+450 ng pcDNA3.1 质粒,上述各组均同时转染100 ng pGL3-AP-1-Luc(报告质粒)和5 ng pRL-TK(内参质粒)。每组分别做3 个重复。转染24 h 后,两个重复组弃去上清液,每孔加100 μL 细胞裂解液1,4 ℃裂解10 min,室温振荡10 min。每孔分别取10 μL 上清液于微孔板中,参照Promega 说明书,利用双荧光素酶报告系统检测每组萤火虫荧光素酶与海肾荧光素酶的活性值,两者的活性比值即为每组所得数值,采用GraphPad Prism 5 分析数值。同时,为了证明每组质粒均转染成功,转染24 h 后,每组的第三个重复组弃去上清液,每孔加入200 μL 细胞裂解液2,离心收集裂解物上清,分别以鼠抗HA MAb(1∶10 000)、鼠抗Flag MAb(1∶2 000)、鼠抗β-actin MAb(1∶20 000)为一抗室温孵育2 h,以IRDye800CW 标记的羊抗鼠IgG(1∶5 000)为二抗室温避光孵育1 h,利用western blot 对每组蛋白表达情况进行检测。利用Image Studio Lite Ver 5.2 软件进行灰度分析,检测eqTRIM5α、EIAV Rev 蛋白及β-actin的表达情况。
1.4 EIAV Rev 对TRIM5α下游转导分子(TAK1、TAB2、P38、c-Jun)激活的AP-1 信号通路的检测该部分设置4 个转染试验,每个实验设置4 个组。第1 个转染试验设置如下:第一组转染900 ng pcDNA3.1 作为阴性对照;第二组共转染450 ng pcDNA3.1+450 ng pTAK1-Flag质粒;第三组共转染450 ng pEIAV-Rev-HA+450 ng pTAK1-Flag 质 粒;第4 组 共转染450 ng pEIAV-Rev-HA+450 ng pcDNA3.1 质粒。第2 个转染试验设置如下:第1、4 组同第一个转染试验;第2 组共转染450 ng pcDNA3.1+450 ng pP38-Flag 质粒;第3 组共转染450 ng pEIAV-Rev-HA+450 ng pP38-Flag 质粒。第3 个转染试验设置如下:第1、4 组同第一个转染实验;第2 组共转染450 ng pcDNA3.1+450 ng pP38-Flag质粒;第3组共转染450 ng pEIAV-Rev-HA+450 ng pP38-Flag 质 粒。第4 个 转 染试验设置如下:第1、4 组同第一个转染试验;第2组共转染450 ng pcDNA3.1+450 ng pc-Jun 质粒;第3组共转染450 ng pEIAV-Rev-HA+450 ng pc-Jun 质粒。上述各试验每组均同时转染100 ng pGL3-AP-1-Luc(报告质粒)和5 ng pRL-TK(内参质粒)。每组分别做3 个重复。转染24 h 后裂解细胞,裂解方法、荧光素酶检测方法和western blot 方法与1.3 中各方法一致。
1.5 EIAV Rev 对TRIM5α 下游转导分子激活的western blot 检测 待6 孔板中的HEK 293T 细胞培养至细胞融合度80%时,参照Polyjet 转染试剂说明书,第一孔共转染1 μg pTAK1-Flag+1 μg pcDNA3.1质粒;第二孔共转染1 μg pTAK1-Flag+1 μg pEIAVRev-HA 质粒;第3 孔共转染1 μg pTAB2-Flag+1 μg pcDNA3.1 质粒;第4 孔共转染1 μg pTAB2-Flag+1 μg pEIAV-Rev-HA 质粒;第5 孔共转染1 μg pP38-Flag+1 μg pcDNA3.1 质粒;第6 孔共转染1 μg pP38-Flag+1 μg pEIAV-Rev-HA 质 粒。每 孔 分 别 做3 个 重 复。转染24 h 后,弃去上清液,每孔加入200 μL 细胞裂解液2,离心收集裂解物上清,分别以鼠抗HA MAb(1∶10 000)、鼠抗Flag MAb(1∶2 000)、鼠抗β-actin MAb(1∶20 000)为一抗室温孵育2 h,以IRDye800CW标记的羊抗鼠IgG(1∶5 000)为二抗室温避光孵育1 h,经western blot 检 测TAK1、TAB2、P38、EIAV Rev 蛋白及β-actin 的表达情况,并经Image Studio Lite Ver 5.2 软件进行灰度分析。
1.6 蛋白酶体抑制剂恢复试验 待6 孔板中的HEK 293T 细胞培养至细胞融合度80%时,利用Polyjet转染试剂分别共转染1 μg pP38-Flag+1 μg pEIAVRev-HA(分 别 作 为 两 个 实 验 组2 和3)和1 μg pP38-Flag+1 μg pcDNA3.1(作为阴性对照组1)。转染24 h 后,实验3 组加入20 μmol/L 蛋白酶体抑制剂MG132,实验2组和阴性对照组分别加入相同浓度DMSO,作用24 h 后按1.3 的western blot 方法分别检测P38、EIAV Rev 蛋白及β-actin 蛋白表达。
1.7 统计分析 整理数据,按照T-test 统计方法对上述试验得到的数据进行显著性分析,p<0.05 或p<0.01 具有统计学差异。
2 结 果
2.1 EIAV Rev 对eqTRIM5α激活的AP-1 信号通路的检测结果 为了探究EIAV Rev 蛋白影响eqTRIM5α激活的AP-1 信号通路的机制,本试验通过荧光素酶系统检测EIAV Rev 蛋白对eqTRIM5α激活的AP-1信号通路的影响。结果显示:eqTRIM5α 与pcDNA3.1 共转染后激活AP-1 信号通路的倍数为26.0;eqTRIM5α与EIAV Rev 共转染后激活AP-1 信号通路的倍数为0.4;单转染pcDNA3.1 和共转染EIAV Rev和pcDNA3.1后激活AP-1信号通路的倍数分别为1.0和0.8(图1A)。Western blot 试验结果显示:eqTRIM5α、EIAV Rev 蛋白大小分别为40 ku、20 ku,与预期大小一致(图1B),表明荧光素酶试验结果成立。荧光素酶试验表明eqTRIM5α 可以激活AP-1 信号通路,而EIAV Rev 则显著抑制eqTRIM5α对AP-1 的激活作用(p<0.01)。
2.2 EIAV Rev 对TRIM5α 下游转导分子(TAK1、TAB2、P38、c-Jun)激活的AP-1 信号通路的检测结果 为了进一步研究EIAV Rev 负调控TRIM5α激活AP-1 信号通路的分子机制,本试验利用AP-1 双荧光素酶报告系统检测EIAV Rev 对TRIM5α下游重要信号转导分子TAK1、TAB2、P38、c-Jun 激活的AP-1 信号通路的影响。结果显示,实验组pEIAV-Rev-HA+pTAK1 组、pEIAV-Rev-HA+pTAB2 组、pEIAV-Rev-HA+pP38 组 和pEIAV-Rev-HA+pc-Jun 组 对AP-1 信号通路的激活倍数分别为7.7、0.1、0.6、9.8;对照组pTAK1+pcDNA3.1 组、pTAB2+pcDNA3.1 组、pP38+pcDNA3.1 组和pc-Jun+pcDNA3.1 组对AP-1 信号通路的激活倍数分别为60.0、1.5、6.3 及12.0;单转染pcDNA3.1 和 转 染pEIAV-Rev-HA+pcDNA3.1 后 对AP-1 信号通路的激活倍数分别为1.0 和0.8。可见,EIAV Rev 对TAK1、TAB2、P38 介导的AP-1 信号通路的激活作用分别下调了87%、93%、90%,而对于c-Jun 激活的AP-1 信号通路无明显影响(p>0.05)(图2A、2B、2C、2D)。Western blot 试 验 结 果 显 示:EIAV Rev、TAK1、TAB2、P38 和c-Jun 蛋白大小分别约为20 ku、78 ku、80 ku、40 ku 和43 ku,与预期大小一致(图2E、2F、2G、2H),表明各蛋白均在293T细胞中得到了表达,荧光素酶试验结果成立。荧光素酶试验结果表明,EIAV Rev 对TAK1、TAB2、P38 介导的AP-1信号通路均有下调作用,而其对c-Jun激活的AP-1 信号通路的下调作用无明显影响。
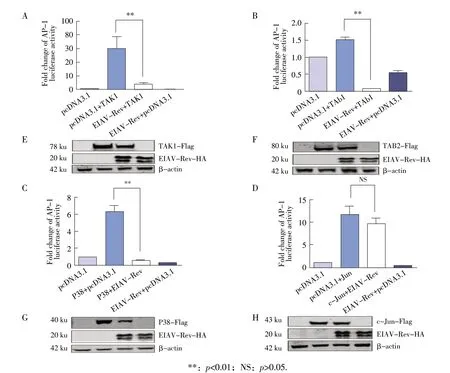
图2 EIAV Rev 对TAK1(A、E)、TAB2(B、F)、P38(C、G)、c-Jun(D、H)激活的AP-1 荧光素酶试验和western blot 试验结果Fig.2 Effect of EIAV Rev protein on AP-1 luciferase activity and western blot activated by TAK1(A/E),TAB2(B/F),P38(C/G)and c-Jun(D/H)
2.3 EIAV Rev 对TRIM5α下游信号转导因子(TAK1、TAB2、P38)蛋白表达水平的影响 为了进一步确定EIAV Rev 是否通过影响P38 蛋白表达而发挥对AP-1 信号通路的负调控作用,本研究通过共转染试验经western blot 检测细胞中EIAVRev、TAK1、TAB2和P38 的表达,以β-actin 为内参对照。结果显示,EIAV Rev、TAK1、TAB2和P38分别约为20 ku、78 ku、80 ku、40 ku,与预期大小一致,而pEIAV-Rev-HA+pP38-Flag 组 与pcDNA3.1+pP38-Flag 组 相 比,前者的P38 蛋白表达显著减少(图3A)。灰度分析结果显示,在过表达P38 的基础上,转染pEIAV-Rev-HA(Rev+)与未转染pEIAV-Rev-HA(Rev-)相比,EIAV Rev 显著降低P38 蛋白的表达水平;在共转染TAK1、TAB2 的基础上,转染Rev+与Rev-均对TAK1 和TAB2 蛋白水平无明显影响(图3B)。结果表明,EIAV Rev 通过下调P38 蛋白表达发挥对AP-1 信号通路的负调控作用。
2.4 蛋白酶体抑制剂恢复试验结果 为了明确EIAV Rev 对P38 蛋白的下调作用是否由蛋白酶的降解造成的,本研究将共转染pP38-Flag+pEIAVRev-HA 的两个实验组在转染24 h 后分别加入蛋白酶体抑制剂MG132 和DMSO(作为对照组),阴性对照组(pP38-Flag+pcDNA3.1 组)加入DMSO,作用24 h后经western blot 检测。结果显示,实验组中加MG132 组与只加DMSO 组相比,MG132 恢复了过表达Rev 后P38 蛋白的表达,且表达水平与阴性对照组一致(图4A)。灰度分析结果显示,加入MG132之后,P38 蛋白的表达量增加(图4B)。结果表明,EIAV Rev 蛋白是通过蛋白酶体途径降解P38 蛋白从而下调P38 蛋白的表达。
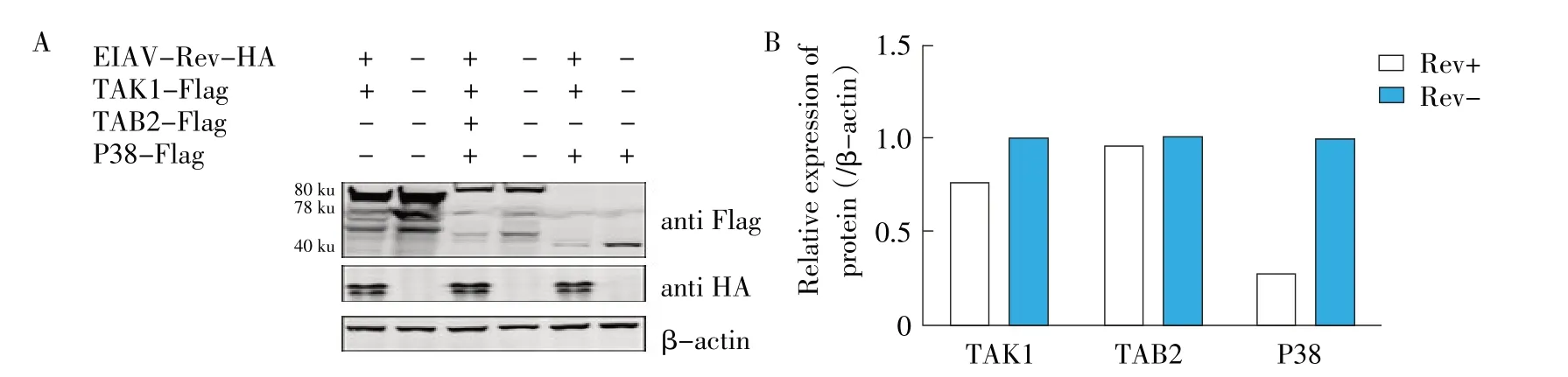
图3 EIAV Rev 对TRIM5α下游信号转导因子表达的影响(A)及灰度分析(B)Fig.3 Effect of EIAV Rev on the expression of TRIM5α down stream signal transduction factor(A)and grayscale analysis(B)

图4 MG132 对P38 表达的恢复效果(A)及灰度分析(B)Fig.4 Effect of MG132 on P38 expression(A)and grayscale analysis(B)
3 讨 论
TRIM5α是逆转录病毒衣壳的细胞内模式识别受体,通过SPRY 结构域特异性识别逆转录病毒的衣壳蛋白所形成的网格结构,招募泛素结合酶复合体UBC13-UEV1A,并在其作用下催化形成游离的K63多聚泛素链,进而在TAB2、TAB3 作用下活化TAK1,通过激酶级联反应激活AP-1和NF-κB信号通路,使细胞处于抗病毒状态[1]。不同种属的TRIM5α基因翻译的蛋白结构差异很大,犬和猫的TRIM5α基因是不完整的,不具有抗病毒活性,研究报道TRIM5α需要通过SPRY结构域结合病毒衣壳蛋白从而发挥抗病毒功能[5-7]。本实验室前期报道eqTRIM5α蛋白不具有完整的SPRY 结构域,但过表达eqTRIM5α在293T 细胞中仍然可以抗EIAV 的感染[8],也证明了过表达eqTRIM5α在293T 细胞中可以很好的激活天然免疫应答,推测eqTRIM5α抗EIAV 活性依赖于其激活的天然免疫。
EIAV 隶属于逆转录病毒科慢病毒属,主要感染马巨噬细胞,导致马持续感染和反复的病毒血症[9],对马行业影响重大。EIAV 是基因组最为简单的慢病毒且能造成潜伏感染,至今发现其仅包含Gag、Pol、Env 3 个结构蛋白以及Tat、Rev、S2 3 个辅助蛋白。本实验室前期以EIAV 为模型病毒通过荧光素酶试验筛选到Rev 蛋白,并且首次发现Rev 蛋白可以显著下调eqTRIM5α激活的AP-1 信号通路。Rev蛋白是EIAV 的重要辅助蛋白之一,主要承担在病毒复制晚期向核外转运未完全剪切的mRNA 的作用,以促进病毒的组装[10]。该蛋白全长为165 个氨基酸,主要包括精氨酸富集区、核定位信号、核输出信号、RNA 结合域(ARM)[11]。
为探究Rev 蛋白负调控eqTRIM5α激活的AP-1信号通路的具体阶段,将pcDNA3.1-EIAV-Rev-HA分别与TRIM5α 下游关键转导蛋白TAK1、TAB2、P38 和c-Jun 基因的质粒及AP-1 荧光素酶报告系统共转染HEK 293T 细胞。结果显示EIAV-Rev 显著抑制TAK1、TAB2 和P38 激活的AP-1 通路,而对c-Jun 激活的AP-1 通路无明显影响,表明EIAV-Rev 对TRIM5α激活的AP-1 通路的负调控作用发生在p38 与c-Jun 之间。进一步的western blot 试验表明EIAVRev 显著抑制p38 蛋白的表达。并且加入蛋白酶体抑制剂MG132 则恢复了p38 蛋白的表达,表明EIAV Rev 蛋白通过蛋白酶体途径降解P38 蛋白,导致依赖于P38 蛋白的AP-1 信号通路的负调控作用。但是,Rev 怎样直接或间接导致P38 蛋白的降解有待于进一步研究,本实验为进一步理解EIAV 与宿主的相互作用提供实验依据。
