人源H7N9 流感病毒促进I 型干扰素产生机制的研究
2020-06-05李继清万晓朋于晓菲陈化兰
李继清,万晓朋,于晓菲,陈化兰
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
自2013 年首次发现以来,H7N9 流感病毒给家禽养殖业造成了重大的经济损失,并且,新型H7N9 病毒可以突破种间障碍直接感染人,更为严重的是,病毒不断变异,2017 年在家禽和患者体内均分离到高致病性H7N9 流感病毒[1-2]。截止2019 年2 月,H7N9 流感病毒共导致1 567 人感染,其中有615 人死亡,死亡率高达39%,对人类公共卫生安全构成了巨大的威胁[3],因此,H7N9 流感的防控成为亟待解决的问题。
天然免疫系统是宿主抵抗病原微生物感染的第一道防线,在病毒感染的早期阶段,天然免疫系统通过模式识别受体(Pattern recognition receptor,PRR)识别病毒组分产生一系列抗病毒效应分子,其中I型干扰素(IFN-I)在抗病毒反应中发挥重要作用[4]。文献报道,在流感病毒感染的过程中,主要由胞内的PRR 视黄酸诱导基因I(RIG-I)识别由病毒RNA 在细胞内复制时所产生的5'-pppssRNA 等产物,并通过接头分子MAVS 招募并活化TANK 结合激酶1(TBK1)分子,最终通过磷酸化的干扰素调节因子3(IRF3)分子入核促进IFN-I 产生[5]。IFN-I 具有重要的抗病毒功能,不同来源的H7N9 病毒致病力不同,为研究不同宿主来源的H7N9 病毒诱导产生IFN水平差异及其机制,本实验选取两株不同来源的H7N9 流感病毒,一株人源病毒A/Anhui/1/2013(AH/1),另外一株是禽源病毒A/Pigeon/Shanghai/S1421/2013(PG/S1421),两株病毒仅在PB2 627 位点有一个氨基酸差异,分别为K 和E,然而,两株病毒对小鼠的致病性存在明显差异,AH/1 株感染导致小鼠死亡,PG/S1421 株感染小鼠不发病。本研究利用AH/1 和PG/S1421 两株病毒分别感染小鼠腹腔巨噬细胞,研究IFN-I 产生水平差异及其机制,结果显示,AH/1 株可以通过上调RIG-I 的表达量,进而诱导产生更多的IFN-I,揭示了人源H7N9 病毒促进IFN-I 产生的初步机制,为进一步解析人源H7N9 流感病毒促进IFN-I 产生的精细分子机制以及逃逸宿主天然免疫系统的机制研究奠定了基础,为H7N9流感防控提供参考依据。
1 材料与方法
1.1 主要实验材料 A549 细胞、H7N9 流感病毒PG/S1421 株和AH/1 株均由本实验室保存;小鼠腹腔巨噬细胞取自C57BL/6 小鼠按照参考文献[6]制备;实验用C57BL/6 小鼠购自北京维通利华公司。
RPMI 1640 培养基、F-12K 培养基、胎牛血清均购自GIBCO 公司;4%多聚甲醛购自索莱宝公司;Alexa Fluor®488 山羊抗鼠IgG、IFN-β ELISA 检测试剂盒购自Invitrogen 公司;兔抗GAPDH、RIG-I 抗体和山羊抗兔IgG-HRP 均购自CST 公司;SDS-PAGE蛋白上样缓冲液(5×)购自碧云天公司;H7N9 NP 单克隆抗体(anti-NP MAb)由本实验室制备。
1.2 病毒对小鼠致病性试验 将病毒株PG/S1421和AH/1分别10倍倍比稀释为101EID50/50 μL~106EID50/50 μL,每个稀释度取50 μL 滴鼻感染5 只6 周龄雌性C57BL/6小鼠,连续14 d 记录两组小鼠的体质量变化和死亡情况。以106EID50的PG/S1421 株和AH/1 株分别滴鼻感染5 只6 周龄雌性C57BL/6 小鼠,第6 d 时迫杀小鼠并无菌操作取小鼠的鼻甲、脑、肺、肾和脾5 个脏器分别放入2 mL EP 管,加入1 mL 含抗生素的PBS 和钢珠用组织研磨仪研磨,离心后取上清,10 倍倍比稀释后,分别以0.1 mL/胚的剂量尿囊腔接种9 日龄~10 日龄的鸡胚,48 h 后收集尿囊液,测定两株病毒鸡胚尿囊液HA 效价,计算小鼠脏器病毒滴度。
1.3 病毒对细胞的感染效率检测 将A549 细胞和小鼠腹腔巨噬细胞铺于6 孔板,待细胞贴壁时用两株流感病毒PG/S1421 和AH/1 以相同剂量(MOI 5)分别感染A549细胞和小鼠腹腔巨噬细胞,8 h后加入4%多聚甲醛固定,经Triton-X100透膜、BSA封闭后,以anti-NP MAb(1∶200)为一抗,加入Alexa Fluro 488 标记的山羊抗鼠IgG(1∶500)为二抗,采用间接免疫荧光试验(IFA)检测细胞荧光,同时采用流式细胞术测定感染细胞的比例,根据流式结果的峰图及统计学分析结果判断两株病毒感染细胞效率的差异。实验设未经病毒感染的细胞孔作为阴性对照(NC)。
1.4 病毒感染细胞后的IFN-β含量的检测 待6孔板中的小鼠腹腔巨噬细胞贴壁时,将两株病毒PG/S1421和AH/1 以MOI 1 的剂量分别感染细胞,分别在感染后0、2 h、6 h、12 h 时取细胞培养上清,采用IFN-β ELISA 检测试剂盒测定两株病毒感染细胞培养上清中IFN-β的含量,对实验数据进行分析比较。实验设未经病毒感染的细胞作为阴性对照(NC)。
1.5 病毒感染细胞后的RIG-I 表达量的检测 两株病毒感染小鼠腹腔巨噬细胞的方式同1.4,感染后在0、4 h、8 h、12 h 时裂解细胞收取总蛋白,热变性处理后进行SDS-PAGE 凝胶电泳,经湿转法转至PVDF 膜上,5%脱脂乳室温封闭90 min,分别以兔抗GAPDH 抗体(1∶1 000)、兔抗RIG-I 抗体(1∶1 000)为一抗,山羊抗兔IgG-HRP(1∶2 000)为二抗,经western blot 检测感染细胞中RIG-I 的表达水平。
1.6 统计分析 感染效率的流式数据用GraphPad Prism 6.0 软件进行统计整理,试验结果采用unpaired t-test方法分析。
2 结 果
2.1 两株病毒对小鼠的致病性试验结果 本研究采用不同剂量的两株流感病毒经滴鼻感染C57BL/6小鼠,连续记录小鼠的体质量变化和死亡情况,结果显示,106EID50剂量的PG/S1421 株感染小鼠不会造成其体质量下降和发病死亡(图1A、1C);AH/1株以较低剂量(101EID50~103EID50)感染小鼠时,不会对小鼠体质量变化造成影响,用104EID50剂量感染小鼠会导致小鼠体质量轻微下降,而以高剂量(105EID50和106EID50)感染小鼠时,会导致小鼠体质量显著下降并最终死亡(图1B、1D)。为检测两株病毒在小鼠体内脏器中的复制情况,将小鼠脏器研磨液上清接种鸡胚并计算EID50,结果显示,PG/S1421 株和AH/1 株感染的小鼠,在肺脏和鼻甲中均可以检测到病毒,与PG/S1421 株感染组相比,AH/1株感染组小鼠在肺脏和鼻甲中的病毒滴度分别高103倍和近104倍,但两组小鼠在脑、肾和脾中均检测不到病毒(图1E、1F)。结果表明两株病毒对小鼠的致病性存在显著差异,AH/1 株感染后在小鼠体内的病毒滴度高于PG/S1421 株,并且造成小鼠体质量下降和死亡,对小鼠致病性更强。

图1 PG/S1421 株和AH/1 株对小鼠的致病性试验结果Fig.1 Pathogenicity test of PG/S1421 and AH/1 in mice
2.2 病毒对细胞感染效率的检测结果 分别通过IFA 和流式细胞术检测两株流感病毒PG/S1421 和AH/1 对不同宿主细胞的感染效率,IFA 实验结果显示两株病毒感染A549 细胞和小鼠腹腔巨噬细胞的荧光数量和强度无明显差别(图2A),流式结果显示两株病毒感染两种细胞后的感染细胞数量无明显差别(p=0.5026 和p=0.6379)(图2B),表明两株病毒在A549细胞和小鼠腹腔巨噬细胞中的感染效率无差别。
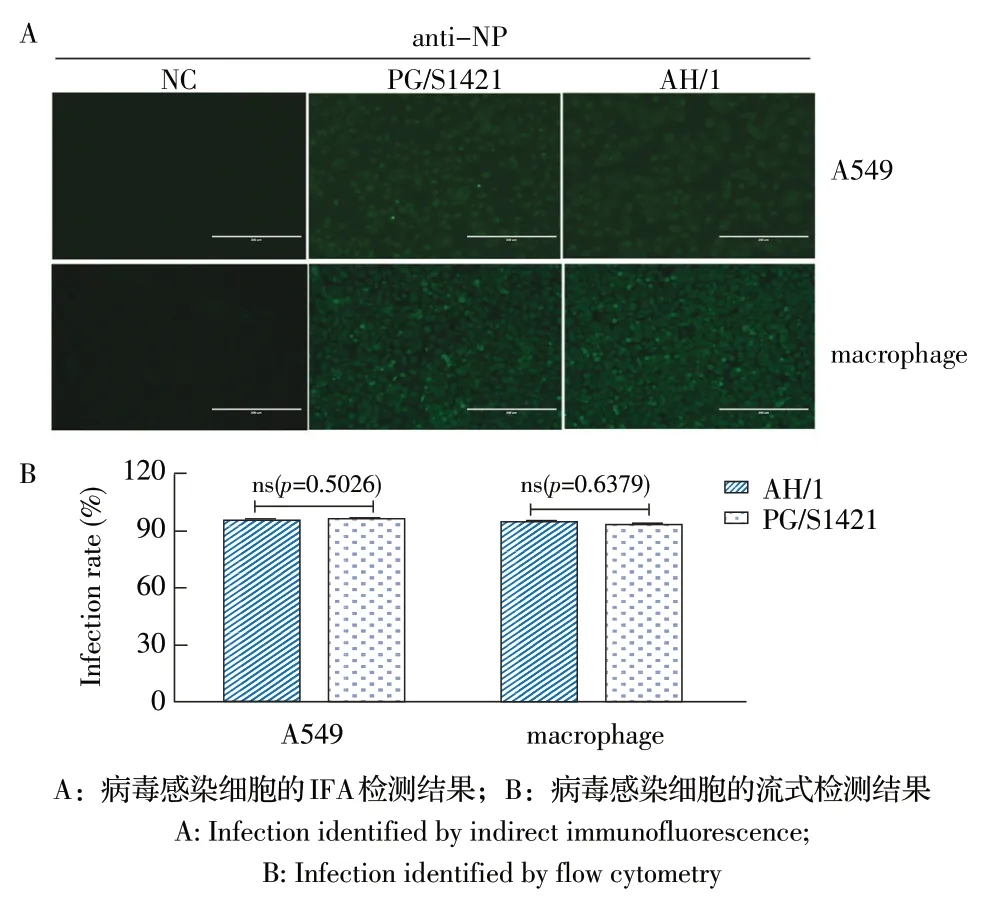
图2 PG/S1421 株和AH/1 株感染细胞后感染效率的检测结果Fig.2 Infection efficacy after the cell infected with PG/S1421 and AH/1
2.3 病毒感染细胞后IFN-β 表达量的检测结果利用IFN-β ELISA 检测试剂盒检测两株病毒感染后小鼠腹腔巨噬细胞培养上清中IFN-β的蛋白含量。结果显示,在感染后一定时间内,两株病毒均可以促进细胞中IFN-β表达,并且IFN 的表达量随时间的延长而增加(图3),但是相较于PG/S1421,AH/1株能够诱导产生更多的IFN-β,结合2.2 中结果,两株H7N9病毒对宿主细胞的感染效率不存在显著差异,表明IFN 含量差异不是由于感染效率不同引起的。

图3 PG/S1421 株和AH/1 株感染巨噬细胞后的IFN-β表达水平检测结果Fig.3 IFN-β expression in macrophages infected with PG/S1421 and AH/1
2.4 病毒感染细胞后胞内RIG-I 表达量的检测结果对IFN-I 通路中的RIG-I 表达量进行western blot 检测。结果显示,在PG/S1421 株感染细胞的12 h 内,胞内RIG-I 分子的表达量无显著性变化,而AH/1 株感染则可以上调RIG-I 的表达量,并且表达量呈现出随时间延长而上升的趋势(图4),表明AH/1 感染可以上调RIG-I 的表达量进而促进IFN-I 的产生,这与
2.3 中ELISA 方法检测IFN-β含量上升的结果一致。

图4 PGS1421 株和AH/1 株感染巨噬细胞RIG-I 表达量的检测结果Fig.4 RIG-I expression in macrophages infected with PG/S1421 and AH/1
3 讨 论
巨噬细胞是机体重要的免疫细胞,流感病毒感染时,单核巨噬细胞可以迅速趋化到感染部位清除病毒感染。本研究利用禽源和人源H7N9 病毒感染小鼠,对两株病毒在C57BL/6 小鼠中的致病性进行评价,结果显示两株病毒在小鼠体内的复制效率以及对小鼠的致病力不同,人源H7N9 病毒感染可以导致小鼠发病死亡,而禽源病毒感染被快速清除,表明人源H7N9 病毒可能逃避了天然免疫的清除。
H7N9 流感病毒PG/S1421 株和AH/1 株在PB2 蛋白的627 位点有一个氨基酸的差异,早先有研究报道,流感病毒的PB2 蛋白可以和线粒体抗病毒信号蛋白相互作用,抑制IFN-I 的产生从而影响病毒毒力[7],这可能导致两株病毒的PB2 蛋白在与宿主蛋白的相互作用方面存在差异,从而对IFN-I 的产生造成影响。本研究用两株病毒感染细胞并对IFN 表达量进行检测,结果表明人源H7N9 病毒AH/1 株诱导机体产生更多的IFN-I。
为探究AH/1 株诱导细胞产生更多IFN-I 的机制,对两株H7N9 流感病毒在小鼠腹腔巨噬细胞中的感染效率进行测定,结果显示两株病毒在吸附和感染方面没有显著差异,表明感染效率不是造成两株H7N9 流感病毒诱导产生IFN-I 差异的原因。流感病毒主要是通过RIG-I/MAVS/IRF3 这条通路诱导IFN-I 产生[8],本研究利用两株病毒感染小鼠腹腔巨噬细胞,对IFN-I 产生信号通路中的RIG-I 表达量进行检测,结果显示AH/1 株感染的巨噬细胞中RIG-I的表达量随感染时间延长而不断增加,表明人源H7N9 流感病毒感染通过上调细胞中RIG-I 的表达量进而促进IFN-I 的产生。
天然免疫是宿主抵抗病原微生物感染的第一道防线,IFN-I 是天然免疫反应中的关键成员,发挥重要的抗病毒作用。流感病毒感染宿主的早期阶段,病毒与宿主天然免疫系统相互抗争,病毒感染会激活宿主的天然免疫系统,诱导IFN 产生,发挥清除病毒的作用[9-10]。综上所述,本研究表明PG/S1421 株和AH/1 株感染均可以诱导细胞IFN-I 产生,但相较PG/S1421,AH/1 株可以通过上调细胞中RIG-I 的表达量,进而促进更多IFN-I 的产生,初步揭示了人源H7N9 病毒促进细胞IFN-I 产生的原因,为进一步阐明人源H7N9 流感病毒上调RIG-I 的精细分子机制以及人源H7N9 免疫逃逸机制研究奠定了基础。
