牛传染性鼻气管炎病毒单克隆抗体的制备及阻断ELISA 方法的建立
2020-06-05向文杰李德栋陈瑞红杨木娇朱远茂
向文杰,李德栋,林 俊,陈瑞红,杨木娇,薛 飞,朱远茂
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
牛传染性鼻气管炎病毒(Bovine infectious rhinotracheitis virus,IBRV)是引起牛呼吸道疾病的重要病毒性病原,感染后主要表现流涕、流泪、咳嗽、呼吸困难和体温升高等临床症状。IBRV 感染除引起呼吸道炎症外,还可引起结膜炎、乳房炎、脓疱性外阴阴道炎或龟头包皮炎、犊牛脑膜脑炎和流产等[1]。此外,IBRV 还可引起机体免疫抑制,进而继发细菌或支原体感染,导致牛呼吸道疾病综合征(Bovine respiratory disease complex,BRDC)[2],给养牛业造成较大的经济损失。目前针对该疫病的防控措施主要有两种:一是在该病的低发区淘汰检测出的阳性动物;二是在该病的高发区接种相关的gE 基因缺失疫苗,并淘汰gE 抗体阳性动物。欧洲已经启动了IBR 的根除计划,奥地利、丹麦、芬兰、瑞典、瑞士等已根除了IBR[3-5]。我国牛群IBRV 血清阳性率约46%,时有IBRV 局部流行,目前对该病的血清学诊断主要依靠实验室的中和试验或ELISA,尚无自主研发的商品化IBRV 血清抗体检测试剂盒[6],因此有必要开展相关诊断技术的研究。
本研究以经蔗糖密度梯度离心纯化的IBRV 全病毒作为免疫原,制备1 株IBRV 特异性单克隆抗体(MAb),再以该MAb 作为检测抗体建立检测牛血清抗体的阻断ELISA 方法。该方法具有较强的特异性和较高的敏感性,可以应用于IBRV 疫苗免疫监测和血清流行病学调查。IBRV 特异性MAb 的获得为IBRV 蛋白的结构和功能研究奠定一定的基础,阻断ELISA 方法的建立为我国IBR 的防控提供技术支持。
1 材料与方法
1.1 病毒株、细胞及实验动物 IBRV Barthanu/67、牛病毒性腹泻病毒(BVDV)、牛副流感病毒3 型(BPIV3)由本实验室保存。牛肾细胞(MDBK)和SP2/0细胞由本实验室保存,6 周龄~8 周龄雌性BALB/c 小鼠购自辽宁长生生物技术有限公司。
1.2 主要试剂 聚乙二醇(PEG)、HT、HAT、弗氏完全佐剂、弗氏不完全佐剂、辣根过氧化物酶(HRP)标记的山羊抗鼠IgG(IgG-HRP)、DMEM 均购自Sigma 公司;明胶购自FlakaAG 公司;脱脂乳购自博士德生物工程有限公司;马血清购自Hy-Clone 公司;3,3,5,5-四甲基联苯胺(TMB)购自北京泰天河生物技术有限公司;可拆卸ELISA 酶标板购自Costar 公司。
1.3 血 清 IBRV 标准阳性血清由本实验室制备并保存;IBRV 灭活疫苗免疫牛血清采自内蒙某一肉牛养殖场;IBRV 标准阴性血清采自黑龙江省某散养户牛;BVDV、BPIV3 和BADV-3 阳性血清由本实验室保存;O 型FMDV 阳性血清为疫苗免疫血清(周国辉副研究员惠赠);血清样本采自内蒙古、黑龙江、江苏、吉林、山西、北京、广东等省(市、自治区)(辛九庆研究员惠赠)。
1.4 全病毒抗原的制备 将1000 TCID50IBRV 接种于已长成良好单层的MDBK 细胞,CPE 达80%以上收毒。病毒液经30%和60%的蔗糖密度梯度超速离心(100 000 g,4 ℃,3 h) 纯化,置-70 ℃保存备用。经SDS-PAGE 电泳观察纯化效果,并用分光光度计测定蛋白含量。
1.5 MAb 的制备 取纯化的IBRV,经灭活乳化后免疫6 周龄~8 周龄的BALB/c 雌性小鼠。取小鼠脾脏与骨髓瘤细胞SP2/0 进行常规的细胞融合,采用本实验室建立的间接ELISA 进行MAb 筛选,对获得的MAb 制备小鼠腹水。
1.6 MAb 的鉴定
1.6.1 间接免疫荧光(IFA)鉴定 待IBRV 接种于24孔细胞培养板中长成良好单层的MDBK 细胞,CPE达到80%左右时用-20 ℃预冷乙醇固定,然后加入MAb 腹水(1∶1 000),4 ℃作用过夜,加入山羊抗鼠IgG-FITC(1∶64),37 ℃避光孵育1 h,于倒置荧光显微镜下观察。同时设BVDV、BPIV3 和正常MDBK细胞对照。
1.6.2 Western blot 鉴定 纯化的IBRV 进行SDSPAGE 电泳,转移至硝酸纤维素膜上,用5%的脱脂乳4 ℃封闭过夜后加入MAb 腹水(1∶1 000),37 ℃作用1 h,加入Dylight 800 标记的山羊抗鼠IgG(1∶5 000),37 ℃避光孵育1 h 后于扫膜仪观察结果。1.6.3 质谱鉴定 根据1.6.2 试验结果,切取与MAb反应相对应的IBRV SDS-PAGE 电泳条带,由上海中科新生命生物科技有限公司进行质谱分析。
1.7 阻断ELISA 方法的建立及初步应用
1.7.1 最佳工作条件的确定 采用方阵滴定法确定全病毒IBRV 最佳包被浓度(1∶100、1∶200、1∶400、1∶600、1∶800、1∶1 000、1∶1 200 和1∶1 400,抗原蛋白浓度为5.35 mg/mL)和检测MAb cp-1-1 最佳稀释度(1∶100、1∶200、1∶400、1∶800、1∶1600、1∶3 200、 1∶6 400 和1∶12 800, MAb 浓 度 为
7.8 mg/mL),待检血清(1∶2、1∶4、1∶8、1∶16 和1∶32)和山羊抗鼠IgG-HRP(1∶5 000、1∶10 000 和1∶20 000)最佳稀释度最佳封闭液(1%明胶、2%明胶、3%明胶、5%脱脂乳、10%马血清和20%马血清),最佳封闭时间(1 h、2 h 和4 h),血清(0.5 h、1 h、1.5 h 和2 h)、MAb cp-1-1(0.5 h、1 h 和2 h)、羊抗鼠IgG-HRP(0.5 h、1 h 和1.5 h)和TMB(5 min、10 min 和15 min)的最佳作用时间。
1.7.2 临界值的确定 取实验室保存的50 份IBRV抗体呈弱阳性的牛血清(中和抗体效价为1∶4~1∶16),同时设标准阴性牛血清作为阴性对照,按照1.7.1 确定的阻断ELISA 操作程序进行检测,读取OD450nm值。规定以上述50 份弱阳性牛血清的平均OD450nm值加2 倍的标准差(SD)作为该方法的OD450nm临界值,按照如下公式计算抑制率临界值。

1.7.3 特异性试验 按照已建立的阻断ELISA 方法对IBRV、BVDV、BPIV3、BADV-3 和O 型FMDV 阳性牛血清进行检测,根据抑制率临界值判断该方法的特异性。
1.7.4 敏感性试验 选择中和抗体效价为1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256、1∶512、1∶1 024 共10 份血清,对上述血清2 倍倍比稀释,每份血清最高稀释至比中和抗体效价高2 个滴度,例如中和效价为1∶4,则血清稀释至1∶16。用本研究建立的阻断ELISA 方法进行检测,确定该方法的敏感性。
1.7.5 重复性试验 取同一批次包被的ELISA 板,用IBRV 阴、阳性牛血清各3 份进行批内重复试验;取不同批次包被的ELISA 板,用IBRV 阴、阳性牛血清各3 份进行批间重复试验。计算批内和批间的变异系数。
1.7.6 符合率试验 取130 份现地牛血清,分别用中和试验和本研究建立的阻断ELISA 方法进行检测,计算该方法与中和试验的符合率。
1.7.7 阻断ELISA 方法的初步应用
1.7.7.1 用于免疫监测 内蒙古某肉牛养殖场实施了IBRV 灭活疫苗免疫,免疫后2 个月,采集206 份牛血清,采用本研究建立的阻断ELISA 方法进行检测,以评估疫苗免疫后抗体产生情况。
1.7.7.2 用于IBRV 血清抗体流行病学调查 收集我国10 个省(市、自治区)牛血清共801 份,采用本研究建立的阻断ELISA 方法进行检测,以调查我国IBRV 血清阳性率的情况。
2 结 果
2.1 全病毒抗原纯化结果 利用MDBK 细胞扩增的IBRV 经30%和60%蔗糖密度梯度超速离心后在60%层面上有一白色的病毒带,吸取脱糖后经SDSPAGE 电泳。结果显示,纯化的病毒与未纯化的病毒相比,培养液中的血清蛋白均去除,可见病毒的各结构蛋白,纯化效果良好(图略)。纯化后经分光光度计测定OD260nm/OD280nm为1.06,蛋白含量为5.35 mg/mL。
2.2 MAb 的筛选 经间接ELISA 筛选获得1 株阳性杂交瘤细胞,OD450nm值为1.95,命名为cp-1-1。经3次有限稀释法克隆纯化后阳性率为100%。
2.3 MAb 的鉴定 IFA 结果显示,MAb cp-1-1 与IBRV 呈阳性反应,可见特异性绿色荧光,而与BVDV、BPIV3 和正常MDBK 细胞均不反应(图1)。表明MAb 具有较强的特异性。
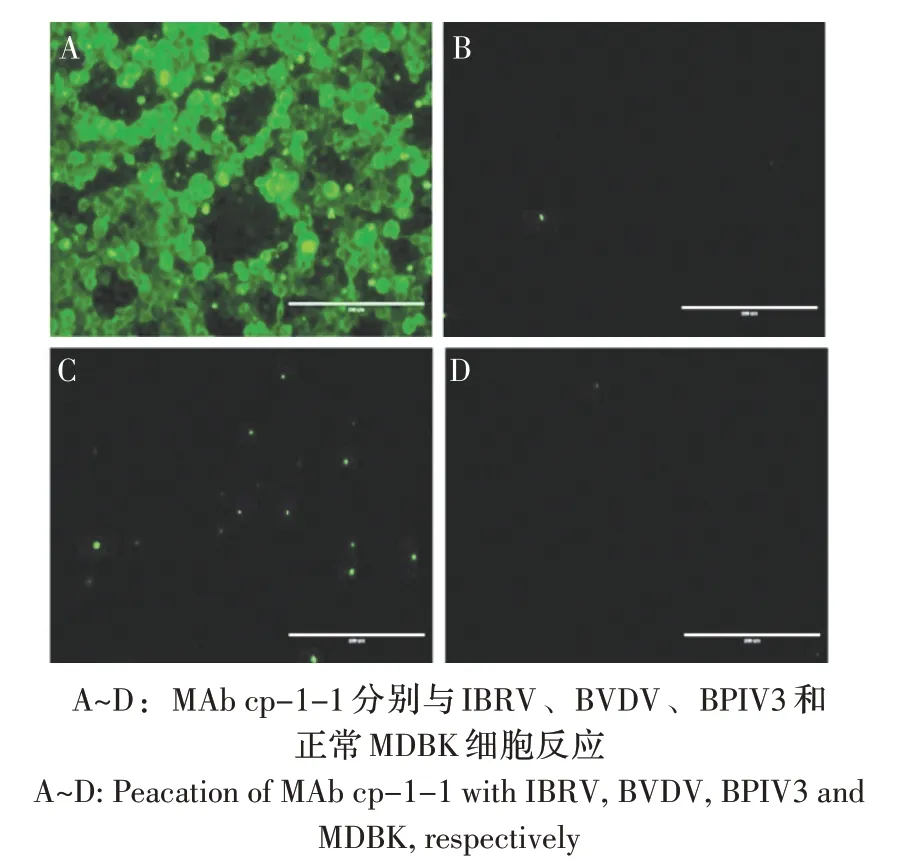
图1 MAb cp-1-1 的IFA 鉴定Fig.1 Identification of MAb cp-1-1 with IBRV,BVDV,BPIV3 and MDBK by IFA
Western blot 结 果 显 示,MAb 与 纯 化 的IBRV 在约100 ku 位置呈现阳性反应,可见特异性条带(图2)。表明,该MAb 可能为针对IBRV VP8 蛋白。
质谱鉴定结果显示,切取与MAb 呈western blot阳性反应相对应的IBRV SDS-PAGE 电泳条带,由上海中科新生命生物科技有限公司进行质谱分析,结果显示该蛋白为IBRV 的VP8 被膜蛋白(图略)。
2.4 阻断ELISA 方法的建立及初步应用
2.4.1 最佳反应条件的确定 根据方阵滴定及优化后的各反应条件,确定阻断ELISA 方法最优条件如下(表1)。

图2 MAb 与IBRV 反应的western blot 分析Fig.2 Western blot analysis of the reaction of the MAb cp-1-1 against IBRV

表1 阻断ELISA 检测方法的反应条件优化结果Table 1 The optimized of reaction conditions for blocking ELISA assay
2.4.2 临界值的确定 50 份IBRV 中和抗体呈弱阳性的牛血清按照确定的阻断ELISA 操作程序进行检测,结果显示其平均OD450nm为0.34(图3),标准差(SD)为0.045,根据平均OD450nm值加2 倍的标准差(SD)计算,OD450nm临界值为0.43。标准阴性牛血清的平均OD450nm值为0.897。按照临界值计算公式得出该方法的抑制率临界值为52.06%,即当抑制率≥52.06%时,判定结果为阳性,当抑制率<52.06%时,判定结果为阴性。

图3 50 份弱阳性样品结果正态分布图Fig.3 50 weak positive samples normal distribution diagram
2.4.3 特异性试验结果 利用建立的阻断ELISA 方法对IBRV、BVDV、BPIV3、BADV3 和O-FMDV 阳性牛血清进行检测,结果显示仅IBRV 阳性牛血清抑制率达80%以上;其余均低于10%(图4),表明该方法具有较强的特异性。
2.4.4 敏感性试验结果 对中和抗体效价为1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256、1∶512、1∶1 024 共10 份血清,分别标记为1~10 号。利用本研究建立的方法进行抗体效价测定,结果显示该方法可检测的最低中和抗体效价为1∶4,即中和抗体效价在1∶4 及以上时,该方法检测呈阳性。9号血清中和抗体效价为1∶512,采用该ELISA 方法检测的效价为1∶1 024,其它8 份血清中和抗体效价与该方法检测效价一致(表2),表明该方法与中和试验敏感性基本一致,中和抗体效价不低于1∶4 可检测为阳性。
2.4.5 重复性试验结果 重复性试验结果显示,6 份血清的批内重复试验及批间重复试验的变异系数均在10%以内(表3),表明该方法具有良好的可重复性。2.4.6 符合率试验结果 130 份现地牛血清,采用中和试验和本研究建立的方法进行检测,结果显示中和试验检测呈阳性的样品数为75,呈阴性的样品数为55;本研究建立的方法检测呈阳性的样品数为77,呈阴性的样品数为53。通过计算,该方法与中和试验的阳性符合率为100%,阴性符合率为96.36%,总体符合率为98.46%(表4)。

图4 特异性试验结果Fig.4 Specific test results

表2 阻断ELISA 方法与中和试验检测效价的比较Table 2 Comparison of the titer with the blocking ELISA method and neutralization test

表3 重复试验结果Table 3 Repeated test results
2.4.7 阻断ELISA 方法的应用
2.4.7.1 免疫监测 对内蒙古某肉牛养殖场实施了IBRV 灭活疫苗免疫的牛血清206 份进行检测,结果显示205 份呈阳性,阳性率高达99.51%(205/206),表明疫苗免疫后诱导抗体产生良好。

表4 符合率试验结果Table 4 Conformity test results
2.4.7.2 血清流行病学调查 对我国8 个省(市、自治区)共801 份牛血清,利用本研究建立的ELISA 方法进行检测,结果显示IBRV 抗体阳性率为0~86.89% ,总体阳性率为41.6%(333/801)(表5),表明我国IBRV 血清阳性率处于较高水平,应引起重视。

表5 血清流行病学调查Table 5 Serum epidemiological survey
3 讨 论
IBRV 是疱疹病毒科的成员,能够引起牛传染性鼻气管炎,感染牛容易继发细菌感染。该病毒可引起潜伏感染,导致乳汁减少、体重下降、流产甚至死亡[7],给养牛业造成较大的经济损失[8]。流行病学调查显示我国IBRV 血清阳性率达46.03%(3933/8545),表明在我国存在严重的IBRV 感染。目前,国内尚无商品化IBRV 的诊断试剂,国外的检测试剂盒比较昂贵,因此有必要进行IBRV 相关检测技术的研究。
本研究曾尝试用环磷酰胺免疫抑制法筛选针对IBRV gE 蛋白的特异性MAb。先用IBRV gE 缺失株和环磷酰胺同时免疫小鼠,小鼠对IBRV 除gE 蛋白之外的其它蛋白产生免疫抑制,再用全病毒对小鼠加强免疫,以期筛选到针对IBRV gE 蛋白的特异性MAb。但可能由于环磷酰胺抑制强度或抑制时间不足,也可能由于VP8 蛋白是IBRV 含量最丰富的被膜蛋白,其未得到完全的免疫抑制,再者VP8 蛋白部分暴露在病毒粒子表面,造成本研究只筛选到针对IBRV VP8 蛋白的MAb,未获得针对gE 蛋白的MAb。
目前我国用于IBRV 抗体检测方法主要有中和试验、实验室自建的间接ELISA 和进口的竞争ELISA 方法,国内尚无商品化的抗体检测试剂。本研究利用IBRV VP8 MAb 建立了检测牛血清抗体的阻断ELISA方法。VP8 蛋白为IBRV 中含量最高的被膜抗原[9],且为病毒的结构蛋白,在病毒的整个复制周期中一直存在,能够刺激机体产生较高滴度的抗体[10],所以用针对该蛋白的MAb 建立的阻断ELISA 方法来检测抗体是可行的。IBRV nu/67 株的VP8 蛋白序列与国内其它IBRV 分离株序列一致性为100%,所以本研究建立的ELISA 方法能够用于国内IBRV 血清学检测。该方法可检测到IBRV 灭活疫苗免疫诱导的抗体最早时间为首次免疫后1 周,表明该阻断ELISA方法可以用于疫苗免疫后的血清抗体监测,根据监测结果可以快速确定疫苗免疫的效果和血清中的抗体水平,从而制定科学的免疫程序。此外,该方法可检测的最低中和抗体效价为1∶4,与中和试验的敏感性一致,中和试验检测需要5 d~7 d,该方法仅需1 d,大大缩短检测时间,为疫病的快速诊断和早期防控提供依据。
为了简化ELISA 操作术式,本研究尝试用HRP直接标记MAb cp-1-1 作为检测抗体,但标记后进行检测由于阴性样品OD450nm值偏低导致阻断率偏低,不易区分阴阳性,分析其原因可能有三点,第一,MAb经标记后部分降解或变性,有效MAb含量降低,导致与抗原结合量减少,使OD450nm值整体偏低,抑制率偏低;第二,MAb标记时可能存在未标记的MAb,检测时未标记的MAb竞争结合标记的MAb,导致OD450nm值整体偏低,抑制率偏低;第三,HRP与MAb标记结合量少,造成标记抗体效价偏低,同样导致OD450nm值整体偏低,抑制率偏低。为了解决这个问题,本研究委托生物技术服务公司进行MAb 标记,结果效价仍然偏低,可能与VP8蛋白本身结构有关。为此,本研究选择商品化的山羊抗鼠IgG-HRP 作为二抗,建立了阻断ELISA,虽然操作时多一步程序,但阻断效果良好,可用于IBRV血清抗体的检测。
本研究利用MAb cp-1-1 建立了阻断ELISA 诊断方法,该方法特异性强、敏感性高、重复性好,与中和实验的符合率为98.46%,可用于IBRV 免疫监测和血清流行病学调查,为我国IBR 的防控奠定了一定的基础。
