东乡野生稻MYB转录因子 LOC_Os01g62410-DX苗期低温诱导荧光定量表达分析及克隆
2020-04-22於紫蕾却志群沈春修
於紫蕾,却志群,沈春修
(宜春学院 生命科学与资源环境学院,江西省作物生长发育调控重点实验室,江西宜春 336000)
各种各样的环境胁迫都会严重影响作物的生长及其产量,在这些非生物胁迫条件中,由低温胁迫引起的冷害又是影响各种作物分布和生产的最重要胁迫类型之一,在低温胁迫条件下,植物的基因表达、生物膜脂质组成、光合效率都将发生变化,另外植物细胞中还会产生一些对细胞有毒害作用的小分子和自由基[1-4]。水稻是一种喜阳植物,对寒冷天气尤为敏感,特别是在苗期,水稻苗期遭受低温冷害后经常引起秧苗失绿、发僵以及分蘖数减少,严重时甚至引起水稻幼苗全株枯萎乃至死亡[5-6]。所以如何提高水稻抗寒性已经成为全国水稻科研工作者非常关注的一个问题,而提高水稻抗寒能力最有效的方法就是挖掘和利用水稻自身耐寒基因。
水稻的抗寒性属于多基因控制的数量性状,多个抗寒基因的协同作用才能提高其抗寒性,所以向水稻细胞内导入单个功能性蛋白基因,往往难以达到提高其抗寒性目的。抗寒功能性蛋白基因的启动子上常含有相同的转录因子调控元件,一个转录因子的超表达往往会激活多个抗寒功能性蛋白基因的表达,从而提高水稻的抗寒性[7-8]。因此,转录因子在未来水稻的抗寒育种中有着广阔的应用前景,从目前已克隆的水稻转录因子类耐冷基因的供体来源来看,这些基因大多来自粳稻,鲜有来源于野生稻资源的报道。野生稻未经过人工驯化,长年需要在恶劣的自然条件下经历越冬,所以携带了许多优良的耐冷基因,野生稻中的这些优良耐冷基因是培育耐冷栽培稻新品种的珍贵资源,东乡野生稻是目前已发现的耐冷性极强的野生稻资源之一,该水稻自发现至今30多年以来,其超强的耐冷性引起了广大水稻科研工作者的广泛关注。
笔者前期通过对正常生长条件和冷胁迫条件(4 ℃处理3 d)下的4个水稻材料(包括东乡野生稻,茶陵野生稻,东乡野生稻与‘93-11’杂交后的F2越冬混合群体3个冷耐材料,以及冷敏感材料93-11)苗期的转录组测序数据(RNA sequence,RNA-seq)进行比较分析,鉴定到了冷处理后在冷敏感材料中无差异表达而在3个冷耐材料中出现差异表达的318个水稻耐冷相关基因(数据公布于http://link.springer.com/article/10.1007/s12374-014-0183-1)[9]。这些在不同耐冷野生稻中都表现出差异表达的基因,不仅验证了其表达水平的可靠性,还表明这些基因在耐冷野生稻中的功能可能是保守的。它们可能在冷胁迫过程中起重要作用。
本研究正是基于以上前期研究成果,结合基因蛋白功能和基因本体(Gene Ontology,GO)注释信息,从转录组比较分析鉴定到的318个水稻耐冷相关基因中筛选出可能与冷耐调控直接相关的上调表达MYB(v-myb avian myeloblastosis viral oncogene homolog, MYB)转录因子基因LOC_Os01g62410(并将东乡野生稻中的该基因位点暂定名LOC_Os01g62410-DX),以东乡野生稻作为实验材料,运用实时荧光定量PCR(quantitative Real-Time PCR,qRT-PCR)技术分析该基因位点的在低温处理条件下的表达量差异,并通过RT-PCR(Reverse Transcription-Polymerase Chain Reaction,RT-PCR)方法从东乡野生稻中克隆该基因位点的全长cDNA(complementary DNA,cDNA),构建过表达载体,然后借助农杆菌介导转化方法导入到水稻受体品种台北309(TP309)中,获得转基因植株,本试验为后续研究东乡野生稻中LOC_Os01g62410-DX基因在低温胁迫条件下的功能奠定材料基础。
1 材料与方法
1.1 试验材料
1.1.1 供试水稻 供试耐冷水稻材料东乡野生稻,转基因受体水稻材料TP309,均由江西省作物生长发育调控重点实验室保存并提供。
1.1.2 供试载体 T载体pEASY-Blunt Zero Cloning Kit购自北京TransGen Biotech公司,植物表达载体pCAMBIA1301M是由江西省作物生长发育调控重点实验室改造并提供(图1)。

图1 植物双元过表达载体pCAMBIA1301MFig.1 Plant binary over-expression vector pCAMBIA1301M
1.2 试验方法
1.2.1 提取RNA 采集鲜嫩水稻叶片组织于液氮中研磨成粉末,按照FOREGENE公司Plant Total RNA Isolation Kit试剂盒说明进行提取。
1.2.2 引物设计和获得cDNA 所有引物均使用primer premier 5.0软件进行设计,包括qRT-PCR试验用内参引物Tubulin-F和 Tubulin-R,目的基因荧光定量扩增引物DL-62410-F和DL-62410-R;目的基因全长cDNA扩增引物62410-F和62410-R;T载体阳性克隆PCR鉴定引物M13-F和M13-R(表1)。引物序列委托上海Sangon Biotech公司合成,cDNA反转录合成按照TransGen Biotech公司TransScriptOne-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒说明进行。

表1 引物及序列Table 1 Primers
1.2.3 实时荧光定量PCR 首先使用DL-62410-F和DL-62410-R为引物,以常温培养条件下的东乡野生稻叶片的cDNA为模板进行PCR,探索扩增特异性最好的退火温度,再按照TIANGEN公司Super Real PerMix Plus(SYBR Green)试剂盒说明进行预混,于StepOne PlusTM荧光定量PCR仪中进行实时荧光定量PCR扩增,后通过ΔΔCt值的方法对初始数据进行分析,评估基因表达水平。将种子萌发后的东乡野生稻在实验室条件下(25 ℃左右)培养至4~5周,然后用于冷处理(于4 ℃冷藏柜中进行),以冷处理前采集的水稻叶片样本为对照组,4 ℃环境下冷处理24 h、48 h、72 h采集的水稻叶片样本为试验组。在研究过程中,以微管蛋白(Tublin)基因作为内参,设置3次生物学重复和3次技术重复。
1.2.4 T载体克隆 使用62410-F 和62410-R引物,利用RT-PCR技术扩增东乡野生稻LOC_Os01g62410-DX全长cDNA,连接反应按照TransGen Biotech公司pEASY-Blunt Zero Cloning Kit试剂盒说明并稍作改进后进行,反应体系5 μL: PCR Product 4.5 μL,pEASY-Blunt Zero Cloning Vector 0.5 μL,于PCR仪中22 ℃反应2 h。随后按照Trans1-T1 Phage Chemically Competent Cell 说明书进行热激操作。
1.2.5LOC_Os01g62410-DX基因生物信息学分析 利用NCBI中的Blast功能对LOC_Os01g62410-DX基因序列与数据库中的日本晴对应位点序列进行比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi);使用Prot-Param预测目的基因编码蛋白质的理化性质(http://web.expasy.org/protparam/);使用DNAMAN软件进行氨基酸序列的多重比对分析和系统进化树的绘制;使用功能结构域在线分析软件SMART进行保守结构域的预测。
1.2.6 农杆菌介导的遗传转化及转基因植株GUS染色 以粳稻品种TP309作为转基因受体,利用其成熟胚诱导愈伤组织,按照农杆菌介导转化植物细胞的方法将重组质粒导入受体细胞直至最终获得转基因植株,转基因过程中各培养阶段培养基配制方法及具体操作参照李丁[10]报道的方法进行,转基因幼苗叶片GUS染色具体实验操作过程参照沈春修等[11]报道的方法进行,GUS染色液的配制参照李莉等[12]介绍的方法进行。
2 结果与分析
2.1 LOC_Os01g62410基因位点不同冷处理时间相对表达量分析
基于前期通过RNA-seq技术获得的转录组测序数据[9],分析发现1个MYB转录因子基因位点LOC_Os01g62410冷胁迫处理后在东乡野生稻、茶陵野生稻和OOP(东乡野生稻与‘93-11’杂交后的F2越冬混合群体)都同时出现了明显的表达水平提高(表2)。为了进一步验证LOC_Os01g62410基因位点冷处理后在东乡野生稻苗期叶片中的表达量情况,本研究以4~5周叶龄的耐冷东乡野生稻和冷敏感籼稻品种93-11苗期叶片作为试验材料,通过实时荧光定量PCR对2个水稻材料中的LOC_Os01g62410基因位点冷胁迫处理条件下的表达模式进行了分析,结果如图2所示,在正常生长条件下(25 ℃)的东乡野生稻中LOC_Os01g62410-DX表达量相对较低,冷处理24 h后表达量出现上调,约为处理前的31.8倍,冷处理48 h后该基因的表达量较冷处理24 h时有所下调,但仍比处理前表达水平高,约为处理前的8.2倍,冷处理72 h后表达量重新上调,约为处理前的25.5倍。表明LOC_Os01g62410-DX在冷处理3 d的过程中表达量呈上调-下调-上调的趋势。而在籼稻93-11中,LOC_Os01g62410基因位点冷胁迫处理前后的表达量无显著差异。

表2 LOC-Os01g62410基因冷处理后在耐冷水稻中的表达情况Table 2 Expression of LOC-Os01g62410 gene in cold-tolerant rice after cold treatment
注:Ratio.处理后基因表达量与处理前基因表达量的比值;OOP.东乡野生稻与93-11杂交后的F2越冬混合群体。
Note:Ratio.The ratio of gene expression before and after cold treatment;OOP.The F2population derived from the cross of Dongxiang wild rice and 93-11.
2.2 LOC_Os01g62410-DX全长cDNA扩增及过表达载体构建
通过RT-PCR方法扩增LOC_Os01g62410-DX的全长cDNA,将其与pEASY-Blunt Zero Cloning T 载体相连,导入大肠杆菌感受态细胞,挑取单菌落摇菌,使用M13F和M13R引物进行菌液PCR鉴定阳性克隆,结果如图3所示,挑取的菌落克隆扩增出约1 500 bp大小的片段,与预期的目的片段大小相符。然后,选择正确的阳性克隆,用KpnⅠ和SalⅠ内切酶对质粒进行双酶切,经琼脂糖凝胶电泳后回收,与同样经KpnⅠ和SalⅠ内切酶剪切后的过表达载体pCAMBIA1301M(图1)进行连接,限制性内切酶KpnⅠ和SalⅠ双酶切鉴定重组质粒1301M-62410-DX,结果如图4所示,获得1个阳性克隆,在电泳图谱中显示为 2条带,大小约 14 kb 的大片段为 pCAMBIA1301M载体,大小约 1 500 bp 的小片段为目的基因LOC_Os01g62410-DX的全长cDNA。
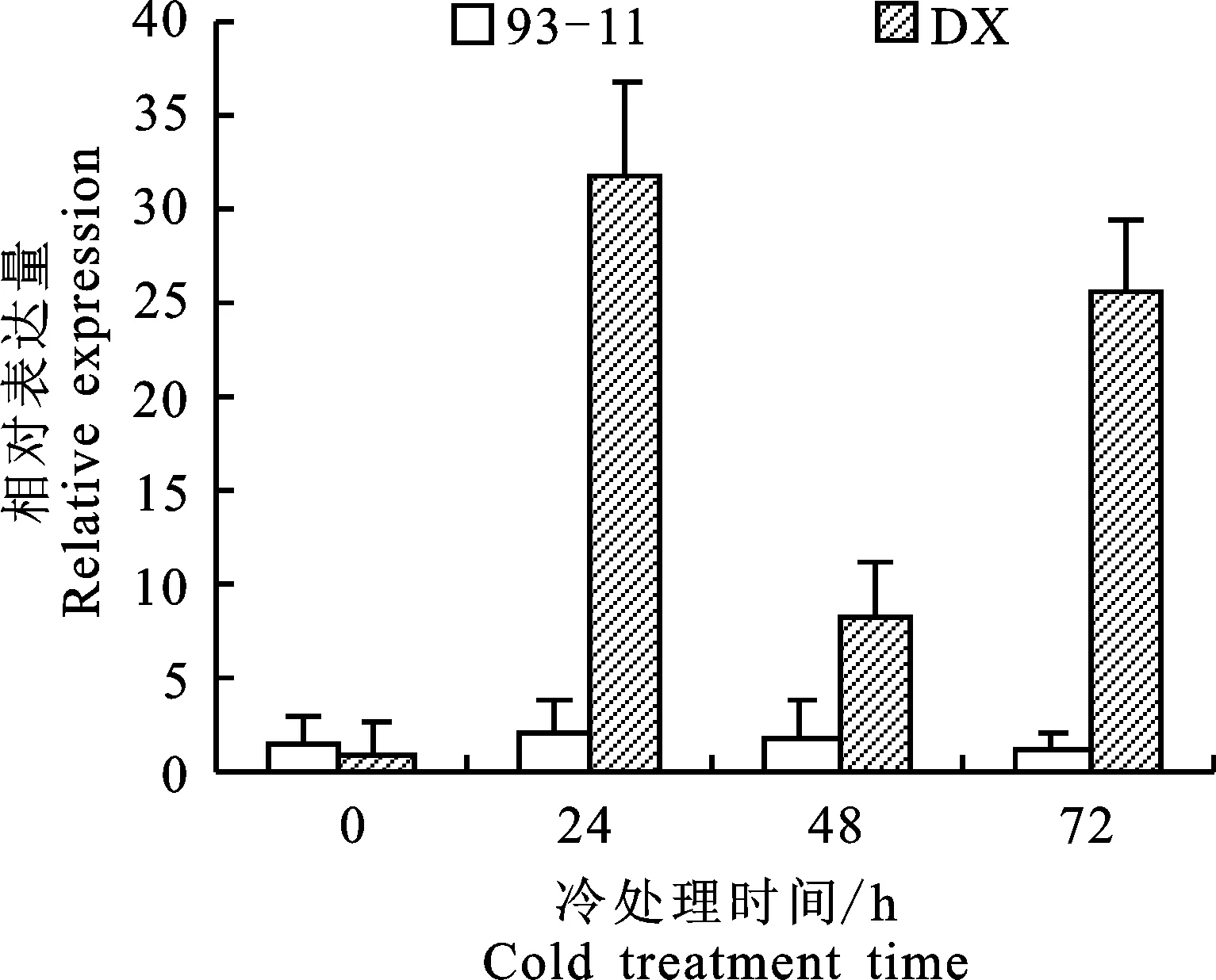
柱形图上方不同字母代表不同处理时间段差异显著(P< 0.05) Different letter donate significant difference(P<0.05) between different stress treats;DX.东乡野生稻 Dongxiang wild rice;93-11.水稻品系93-11 Rice line 93-11
图2LOC_Os01g62410基因位点冷胁迫下表达分析
Fig.2 Expression analysis ofLOC_Os01g62410gene locus under cold stress
2.3 LOC_Os01g62410-DX全长cDNA测序及生物信息学分析
选择酶切鉴定正确的阳性克隆送样测序,测序结果表明,LOC_Os01g62410-DX全长 cDNA共1 500 bp,共编码499个氨基酸。使用Prot-Param进行该基因编码蛋白质的理化性质预测,表明蛋白质分子质量为55.04 ku,理论等电点(pI)为7.62。在NCBI网站中与测序水稻品种日本晴对应位点的DNA序列Blast比对分析发现,东乡野生稻LOC_Os01g62410-DX基因全长cDNA与日本晴相比仅有一个碱基有所差异(第 1 085位脱氧核糖核苷酸碱基不同,日本晴中为G,而东乡野生稻中为T),而此差异也导致对应位置氨基酸的改变(第362位氨基酸不同,日本晴中为R,对应cDNA链碱基为CGG,而东乡野生稻中为L,对应cDNA链碱基为CTG)。使用在线分析软件SMART对LOC_Os01g62410-DX基因翻译后的氨基酸序列的保守域进行分析,结果表明,LOC_Os01g62410-DX蛋白的N端均有2个高度保守功能区SANT (SWI3, ADA2, N-CoR and TFIIIB DNA-binding domains,SANT)(图5),分别位于30~79位和80~130位氨基酸,该保守区是MYB转录因子家族典型的R2R3型结构域,因此LOC_Os01g62410-DX基因属于R2R3型MYB转录因子基因。进一步使用DNAMAN软件将LOC_Os01g62410-DX编码的氨基酸序列与国家水稻数据中心(www.ricedata.com)统计的已克隆的水稻其他R2R3型MYB转录因子的氨基酸序列进行多重比对,发现LOC_Os01g62410-DX编码蛋白与OsJAMyb[13]、OsMYB2[14]、OsMYB2P-1[15]、Osmyb4P[16]和OsMYB103L[17]的编码蛋白之间存在29.41%的氨基酸序列一致性(图6)。

M.DL2000 bp; 1.LOC_Os01g62410-DX菌液PCR Bacterial liquid PCR ofLOC_Os01g62410-DX
图3 T载体LOC_Os01g62410-DX菌液PCR鉴定
Fig.3 Bacterial liquid PCR detection ofLOC_Os01g62410-DX

M.Trans 15K Marker; 1.1301M-62410-DX阳性克隆 Positive clones of 1301M-62410-DX
图4 重组质粒1301M-62410-DX酶切鉴定
Fig.4 Digestion detection of recombinant plsmid 1301M-62410-DX

图5 LOC_Os01g62410-DX蛋白结构域的预测Fig.5 Prediction of protein domains of LOC_Os01g62410-DX gene

图6 LOC_Os01g62410-DX与水稻其他R2R3型MYB基因氨基酸序列比对Fig.6 Alignment of amino acid sequence of LOC_Os01g62410-DX and other R2R3 type MYB gene in rice
2.4 LOC_Os01g62410-DX基因系统进化分析
为了预测LOC_Os01g62410-DX基因的功能,将从东乡野生稻中克隆得到的LOC_Os01g62410-DX基因与与国家水稻数据中心(www.ricedata.com)统计的具有已知功能的19个水稻 MYB 转录因子基因的氨基酸序列一起利用DNAMAN软件进行系统发育分析(图7),结果显示东乡野生稻中LOC_Os01g62410-DX基因与水稻Osmyb3[18]和Osmyb4[19-20]编码的蛋白位于相邻分支上,亲缘关系最近,与水稻MYB 家族成员OsMYBc[21],MYBS3[22]和CTMYb1[23]的亲缘关系最远。
2.5 遗传转化及转基因植株叶片GUS 组织化学染色鉴定
将携带LOC_Os01g62410-DX基因的农杆菌克隆1301M-62410-DX侵染受体水稻品种TP309的愈伤组织,共培养3 d,随后接入含有50 mg/L浓度潮霉素的筛选培养基中,经两轮筛选约35 d时长培养后将新长出的抗性愈伤接入同样含50 mg/L潮霉素的分化培养基进行30 d左右的见光分化培养,而后经历生根壮苗,GUS 组织化学染色鉴定,最后,重组质粒1301M-62410-DX转化后共获得了37 株阳性转化苗(图8)。图 9 所示为部分转基因幼苗的GUS染色结果,取4~5周龄的转基因植株和野生型水稻叶片组织同时进行GUS染色,5株转基因植株叶片均可被不同程度的染上蓝色,尤其是在剪刀剪切过的切口处和叶尖部分都被染上了较深的蓝色,而野生型水稻TP309的叶片则没有任何部位被染上蓝色,表明测试转基因植株皆为成功导入了目的基因的阳性转基因植株。

图7 LOC_Os01g62410-DX与水稻MYB家族其他基因氨基酸序列的系统进化树Fig.7 Phylogenetic tree of the amino acid sequence of LOC_Os01g62410-DXand other MYB family genes in rice

A.愈伤组织培养 Callus culture;B. 1301M-62410-DX农杆菌克隆与愈伤组织共培养 Co-culture of 1301M-62410-DX agrobacterium clone and callus;C.抗性愈伤组织筛选培养 The resistant callus culture;D.抗性愈伤组织分化培养 Resistant callus redifferentiation;E.转基因植株生根炼苗 Rooting and strong seedling culture of transgenic plants
图8 过表达质粒1301M-62410-DX遗传转化实物图
Fig.8 The map of overexpression plasmid 1301M-62410-DX genetic transformation process

A.野生型TP309 Wild type rice variety TP309; B,C,D,E,F.转基因植株 Transgenic plants
图9 转基因植株叶片GUS 活性检测
Fig.9 GUS activity detection of transgenic plants
3 讨 论
在公共数据库Rice Genome Annotation Project(http://rice.plantbiology.msu.edu/index.shtml) 中进行位点查询可知,LOC_Os01g62410是一个MYB转录因子。MYB是植物中最大的一类转录因子家族,该转录因子家族因编码蛋白的N端所包含的DNA结合结构域(MYB结构域)的重复数目不同而被分为三类:R1-MYB、R2R3-MYB、R1R2R3-MYB[24],植物中最主要的 MYB转录因子是具有2个不完全重复(R2,R3)的R2R3-MYB类型。此外,植物中也发现了具有3个重复的MYB蛋白类型,以及仅仅包含有1个MYB域的MYB蛋白类型。MYB转录因子在不同植物的基因组中都有大量的分布,且广泛参与植物的次生代谢调节、细胞形态发生过程、信号传导以及生物和非生物胁迫反应应答等生命活动,近年来,MYB转录因子参与逆境反应应答越来越引起科学家们的关注,甘蓝型油菜BnMYB1基因对高盐、低温、干旱和水杨酸等逆境胁迫都有不同响应[25];蝴蝶兰中有152个MYB家族基因与病毒胁迫响应有关[26];在水稻中,超量表达MYB转录因子OsMYB55[27]和OsMYB91[28]分别增强了水稻对高温和盐胁迫的耐性等研究发现也都被相继报道。
植物基因表达受环境条件的影响时常会有不同程度的上调或下调,这种现象在植物转录因子基因中尤为常见[29]。转录组分析数据表明LOC_Os01g62410基因位点的表达量在冷胁迫处理(4 ℃处理3 d)后在耐冷水稻材料东乡野生稻中出现上调,而在冷敏感水稻‘93-11’中没有出现明显的表达量变化,推测LOC_Os01g62410-DX基因或许并不是东乡野生稻在冷胁迫条件下的一种敏感基因,而是与东乡野生稻在寒冷逆境条件下的强耐冷性表现有关的耐冷相关基因。本研究进一步通过qRT-PCR技术研究发现东乡野生稻中MYB转录因子LOC_Os01g62410-DX在冷胁迫处理3 d的时间内表达量出现不同程度的上调。尤其以冷处理24 h内该基因上调最多,等到冷处理时长达48 h时,该基因的表达量相比冷处理24 h时有明显的降低,但依然比冷处理前要高,当冷处理时长达72 h时,相比冷处理48 h,该基因的表达量又有显著的提升。在遭遇逆境环境胁迫时,转录因子往往较逆境胁迫相关的结构基因先感知到胁迫信号指令调控,当转录因子的表达量达到一定水平后,转录因子再与结构基因的启动子区域进行结合调控其下游的结构基因的表达以抵御逆境环境。所以推测在胁迫条件处理后,当转录因子自身所调控的结构基因的表达被启动后,植物细胞可能有一段暂缓的时间不需要去高表达转录因子。这也可能是本研究中MYB转录因子LOC_Os01g62410-DX在冷胁迫处理24 h基因表达量上调最高,而当冷处理时长达48 h却出现明显下降的原因。
另外,本研究将东乡野生稻中克隆到的MYB转录因子LOC_Os01g62410-DX与水稻中已克隆的其他R2R3型MYB转录因子的氨基酸序列进行了多重比对,发现它们的N端虽然都包含有2个高度保守结构域SANT,然而它们编码蛋白的全部氨基酸序列之间的一致性却只有29.41%,说明水稻中的R2R3型MYB转录因子的序列存在较大的差异,可能存在多个进化分支。目前,水稻中尚未有关于LOC_Os01g62410基因位点功能鉴定的相关报道。通过将东乡野生稻中克隆到的MYB转录因子LOC_Os01g62410-DX与水稻中已报道过的的所有MYB转录因子进行系统进化分析,发现LOC_Os01g62410-DX基因与水稻MYB 转录因子Osmyb3和Osmyb4基因具有最近的亲缘关系,已有报道表明过量表达水稻Osmyb4基因可以明显增强拟南芥转基因植株的耐寒能力,且在Osmyb4的过量表达转基因拟南芥植株中,一些位于冷胁迫应答通路中的基因的表达也发生了改变[19-20],表明Osmyb4在植物耐冷性调控过程中扮演了一个总开关的作用。这暗示LOC_Os01g62410-DX基因在水稻冷胁迫逆境过程中也可能起重要作用。
