硼硅酸盐玻璃成分对硫酸钡热稳定性的影响
2020-03-16江枫吴浪雷杰张海洋康泽王宾姚颖
江枫 吴浪 雷杰 张海洋 康泽 王宾 姚颖
(西南科技大学材料科学与工程学院 绵阳 621000)
0 引言
在含硫的矿物中,以重晶石(BaSO4)矿物的化学稳定性和热稳定性最高[1]。据资料表明[2-4],在自然界中含重晶石的矿物在各种沉积岩、变质岩和火成岩中经过上亿年地质作用后仍然稳定存在,展现出了优良的长期稳定性。李宁等[5]利用BaSO4的高温热稳定性和BaO的化学活性,研究了钡基固硫剂在煤高温燃烧过程中的固硫过程和机理。结果表明BaSO4的燃烧固硫率可达35.52%,远高于CaSO4的固硫率13.88%,反应原理如式(1)所示。Yanagisawa F等[6]研究发现BaSO4和SiO2的混合物需高于1 400 ℃才发生反应,热解出SO3,反应原理如式(2)所示。白瑞梅等[7]研究热解BaSO4时发现,当按BaSO4、V2O5和SiO2的质量比为1∶3.5∶3.5加入V2O5,在1 000 ℃反应20 min后,BaSO4就发生分解,反应原理如式(3)所示,说明V2O5的加入,明显降低了BaSO4的热稳定性。
我国现存高放废液的特点是硫和钠的含量较高,其中硫是以Na2SO4形式存在[8-13]。尽管Na2SO4晶体本身的分解温度较高(~1 200 ℃),但美国Ebert等人的研究表明[13],当Na2SO4与SiO2同时存在时,会显著降低分解反应发生的温度(~850 ℃),Na2SO4熔融后将会快速分解。在玻璃熔制过程中部分硫不可避免地会挥发,导致固定在玻璃体中的硫含量较低。课题组前期通过在模拟高放废液中加入适量Ba(NO3)2,与Na2SO4反应可生成稳定的BaSO4。制备的含有BaSO4晶相的硼硅酸盐玻璃陶瓷固化体可提高硫酸盐的包容量[14-16]。然而,在高温下硼硅酸盐玻璃熔制过程中,部分BaSO4仍然会发生分解。如在玻璃组成中以BaSO4形式引入6 % SO3,在1 200 ℃熔制3 h,制得的样品中SO3质量分数仅为2.17 %[16]。
本文主要研究硼硅酸盐玻璃主要成分(SiO2、Na2O、B2O3)对BaSO4热稳定性的影响,通过分析BaSO4与SiO2、Na2O、B2O3不同组成的混合物在不同温度(800~1 200 ℃)煅烧后样品的热重、物相组成、显微结构、硫含量和拉曼光谱等,探讨共存物相对BaSO4热稳定性的影响。
1 实验
1.1 样品制备
实验所用原料SiO2、H3BO3、Na2CO3、BaSO4,均为国药集团化学试剂有限公司生产的分析纯试剂。按照表1中的组成,将BaSO4与SiO2、Na2O、B2O3不 同组成的混合物分别记为样品A(BaSO4∶SiO2摩尔比为7.5∶92.5)、样品B(BaSO4∶SiO2∶Na2O摩尔比为7.0∶86.0∶7.0)、样品C(BaSO4∶SiO2∶Na2O∶B2O3摩尔比为5.5∶67.5∶5.5∶21.5),选取该组成的依据是课题组前期研究的含BaSO4晶相的硼硅酸盐玻璃陶瓷固化体配方[10]。将称得的原料在玛瑙研钵中研磨30 min使原料充分混合均匀,然后将样品装入氧化铝坩埚,放置于陶瓷纤维炉中,在不同温度(800~1 300 ℃)下保温2 h,升温速率5 ℃/min,最后随炉冷却制得样品。
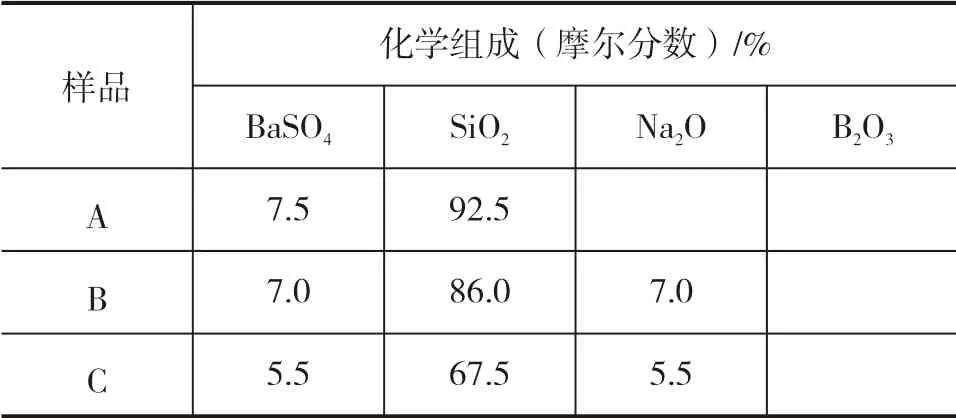
表1 实验所用配方
1.2 样品表征
采用 STA449F5 同步热分析仪(Synchronous thermal a nalyzer, TG-DSC), 以20 ℃/min的升温速率在N2气氛下从室温升到1200 ℃,分析不同配方原料的质量损失情况。采用DM A X1400 型X射线衍射仪( X - ray diffractometer,XRD)分析样品的物相组成。用Axi os型X射线荧光光谱仪(X-ray fluorescence spectrometer,XRF)分析样品中SO3的保留率。将样品打磨、抛光、超声清洗后,用T M-4000型扫描电子显微镜(Scanning electron microscope,S E M)以及Oxford I E450XMax 80 能谱仪( Energy disperse spectroscopy,EDS)分析样品断面的微观形貌及成分。采 用I n Via型显微激光拉曼光谱仪对样品进行Raman测量,分辨 率:1 ~-12 cm ,波长范围:100~4 000 cm 。
2 结果与分析
2.1 样品的热分析
图1为纯BaSO4和样品A、B、C在室温至1 200 ℃范围内的TG-DSC曲线。
从图1(a)中可以看出,纯BaSO4的热稳定性优良,TG曲线表明BaSO4在900~1 200 ℃温度范围内,质量损失仅为0.178%;Ebert等人[12]报道加热BaSO4(升温速率为10 ℃/min)在900 ℃以上即检测到了SO2气体,在1 140 ℃SO2浓度达到最大值。图1(a)中DSC曲线在1 150 ℃附近出现的吸热峰,可能是由于少量BaSO4分解引起。图1(b)为BaSO4和SiO2组成的混合物(即样品A)的TGDSC曲线。TG曲线显示在900~1 200 ℃温度范围内,质量损失约为1.596%。由BaSO4、SiO2、Na2C O3组成的混合物(即样品B)的TG-DSC曲线如图1(c)所示,TG曲线显示在700~800 ℃温度范围内出现明显的失重,结合DSC曲线分析得出,这是由于样品B中Na2C O3发 生分解放出CO2气体。在900~1 200 ℃温度范围内,质量损失约为5.153 %,远大于样品A在此温度范围的质量损失(1.596%)。在570 ℃附近出现的吸热峰是由于SiO2发生位移性转变(a-石英和b-石英的相互转变)。在800 ℃附近出现的吸热峰是由于Na2C O3的分解,1 150 ℃附近出现的吸热峰是由于BaSO4的分解。
图1( d) 为 由BaSO4、SiO2、Na2C O3、H3B O3组成的混合物(即样品C)的TG-DSC曲线。从图中的TG曲线可以看出,在100~200 ℃和600~700 ℃两个温度范围内出现明显的失重,结合DSC曲线中120 ℃和160 ℃出现的吸热峰分析得出,在100~200 ℃之间的失重是由于样品中H3B O3的分解,在120 ℃附近硼酸失去一分子水而形成偏硼酸,160℃附近偏硼酸继续失去一分子水转变为焦硼酸; 600~700 ℃之间的质量损失是由于样品中Na2CO3的分解,产生CO2。在900~1 200 ℃温度范围内,质量损失约为1.147 %,小于样品B在此温度范围的质量损失(5.153 %)。这可能是由于样品C中含有大量H3B O3, H3B O3在200 ℃左右熔融分解后产生大量液相,使Na2C O3和 BaSO4在较低温度下就开始分解。例如样品C中Na2C O3的分解吸热峰(700 ℃)明显低于样品B中Na2C O3的分解吸热峰(800 ℃)。
综上所述,当只加入SiO2时,对BaSO4的热稳定性影响并不明显,当加入Na2C O3和 H3B O3后,由于Na2C O3和 H3B O3的熔点较低,在样品中起到助熔的效果,明显降低了BaSO4的热稳定性。
2.2 样品的物相组成
图2为纯BaSO4在不同温度下保温2 h后样品的XRD图谱。
从图2中可以看出,在800~1 200 ℃温度范围内,样品均呈现出单一的BaSO4晶相(PDF NO.89-3749)。随着温度的升高,样品中没有生成新的物相,且BaSO4衍射峰的强度逐渐增强,说明BaSO4的结晶度提高。在1 200 ℃煅烧2 h后,其物相组成不变,表明纯BaSO4的热稳定性非常优良。
图3为样品A在不同煅烧温度下保温2 h后样品的XRD图谱。
从图3中可以看出,在800~1 100 ℃温度范围内,样品A主要呈现出两种晶相,BaSO4(PDF NO.89-3749)和石英(Quartz PDF NO.70-3755)。随着煅烧温度的升高,BaSO4和SiO2的衍射峰强度逐渐减弱。在1 200 ℃保温2 h后,样品A中出现新物相BaSi2O5(PDF NO.71-1441)。可能是由于部分BaSO4与SiO2发生了化学反应:BaSO4+ 2SiO2→BaSi2O5+SO2(g)+1/2O2。
图4为样品B在不同煅烧温度下保温2 h后样品的XRD图谱。
从图4中可以看出,在800~1 000 ℃温度范围内,样品B主要存在BaSO4(PDF NO.89-3749)和石英(Quartz PDF NO.70-3755)两种晶相。值得注意的是,在800 ℃保温2 h后,样品B中就已经出现新的物相BaSi2O5(PDF NO.71-1441),并且随着煅烧温度的升高,BaSi2O5的衍射峰强度逐渐增强。在1 100 ℃保温2 h后,样品B中石英逐渐转变为方石英(Cristobalite PDF NO.77-1316),在1 200 ℃保温2 h后, BaSi2O5和方石英成为主要晶相。说明Na2CO3的加入,促进了BaSO4和SiO2的反应,并且使SiO2发生晶型转变。
图5为样品C在不同煅烧温度下保温2 h后样品的XRD图谱。
从图5中可以看出,在800~1 200 ℃温度范围内,样品C呈现出BaSO4(PDF NO.89-3749)和石英(Quartz PDF NO.70-3755)两种晶相,并未出现其它晶相。这是由于样品C中含有大量H3BO3,H3B O3分解后产生的B2O3作为玻璃网络形成体,并且具有助熔作用,使产生的其它物相融入玻璃网络中。随着煅烧温度的升高,BaSO4和SiO2的衍射峰强度逐渐降低,在1 200 ℃保温2 h 后,样品C中BaSO4和SiO2的衍射峰几乎消失并且呈现出玻璃的馒头峰。
2.3 样品的硫含量分析
表2为样品在不同煅烧温度保温2 h后的硫含量(以SO3质量分数计)。
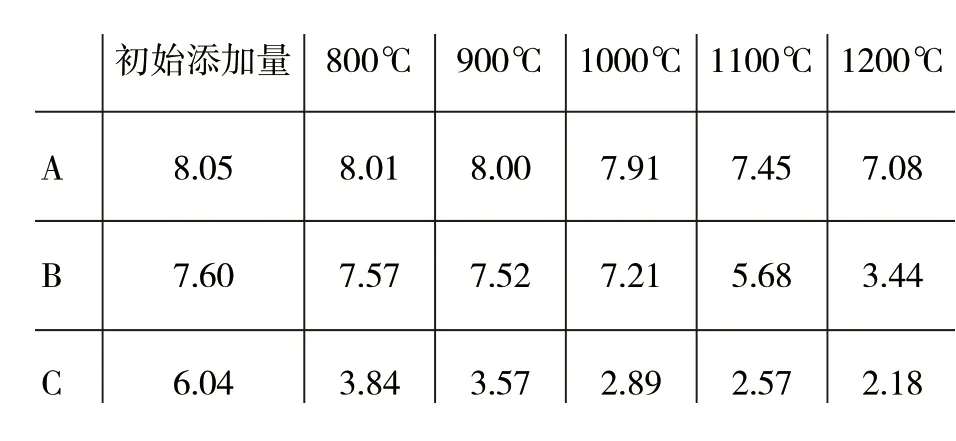
表2 样品在不同温度煅烧后的硫含量(以SO3质量分数计)/%
从表2中可以看出,随着煅烧温度的升高,样品A中硫含量减少缓慢,在1 200 ℃保温2 h后,样品A中的硫含量为7.08%,相比于初始添加量仅减少0.97%。样品B在1 000 ℃以下硫含量减少缓慢,当煅烧温度升高到1 000 ℃以后,硫含量开始急剧减少,在1 200 ℃保温2 h后,样品B中的硫含量为3.44%。样品C在800 ℃保温2 h后,硫含量就明显降低,这是由于样品C中含有大量H3B O3,H3B O3熔 融分解后产生大量液相,促使BaSO4在较低温度下就开始分解,在1 200 ℃保温2 h后,样品B中的硫含量为2.18%。
2.4 样品的显微结构分析
图6为样品C在1 200 ℃保温2 h后的BSE图片和Ba、S、O、Si、Na元素在其中的分布图。
从图6(a)可以看出样品C在1 200 ℃保温2 h后,明显呈现出两种物相。进行能谱分析后发现,O元素均匀地分布在样品中,其它元素分布并不均匀,晶相区域主要分布的元素是Ba、S,玻璃相主要分布的元素是Si、Na。这与图5的XRD图谱分析保持一致,样品C在1 200 ℃保温2 h后,只存在BaSO4晶相。
2.5 样品的拉曼光谱分析
图7为不同样品在1 200 ℃保温2 h后的拉曼光谱图。
图7中主要有4个明显的特征峰。结合文献[17-19]分析得出,拉曼光谱中的特征峰是由SO4四面体4个基本振动模式引起的:v1是以~990 cm-1为中心,分配给S-O键的对称拉伸振动;v2是以~460 cm-1为中心,分配给O-S-O键的对称弯曲振动;v3是以~630 cm-1为中心,分配给O-S-O键的非对称弯曲振动;v4是以~1100 cm-1为中心,分配给S-O键的非对称拉伸振动。从图中可以看出,在1 200 ℃保温2 h后,BaSO4晶体的拉曼特征峰非常明显;样品A中SO4四面体拉曼特征峰和BaSO4晶体的拉曼特征峰差别并不大;样品B中SO4四面体的特征峰强度稍微减弱,样品C中SO4四面体的拉曼特征峰明显减弱,只在990 cm-1处有微弱的S-O键对称拉伸振动。表明加入SiO2、Na2CO3和H3BO3后,由于H3BO3和Na2CO3的熔点较低,可以起到明显的助熔效果,样品C中的BaSO4解离成Ba2+和SO42-,SO42-在高温下分解产生SO3带出S元素,使样品中的SO4四面体数量急剧减少,因此SO4四面体的拉曼特征峰明显减弱。
3 结论
本文研究了硼硅酸盐玻璃主要成分(SiO2、Na2O、B2O3) 对BaSO4热稳定性的影响,主要结论为:
(1)样品A在煅烧温度低于1 200 ℃时,其物相均为BaSO4和SiO2,样品中硫含量变化不大;当温度升高到1 200 ℃后,出现了少量的硅钡石相(BaSi2O5)。
(2)样品B在800 ℃煅烧后就出现了少量BaSi2O5相,当温度升高到1 100 ℃时,样品B中石英逐渐转变为方石英,在1 200 ℃煅烧后,BaSi2O5和方石英成为主要物相,硫含量明显减少。
(3)样品C在800~1 200 ℃温度范围内未出现新物相,随着煅烧温度的升高,BaSO4和SiO2的衍射峰强度逐渐减弱,在1 200 ℃保温2 h后,呈现出玻璃的非晶态峰,BaSO4和SiO2晶相基本消失。
(4)低熔点的Na2O和B2O3的引入促进了BaSO4的分解,在1 200 ℃煅烧后,样品A、B、C中SO4四面体的拉曼特征峰依次减弱。
