伪狂犬病病毒gB蛋白单抗的制备及其夹心ELISA检测方法的建立
2020-03-12张泽财李子义王新平吉林大学第一医院转化医学研究院吉林长春300吉林大学动物医学学院吉林长春3006吉林大学人兽共患病研究所教育部人兽共患病研究重点实验室吉林长春3006
王 方,张泽财,袁 悦,张 胜,王 旭,林 倩,李子义∗,王新平,3∗ (.吉林大学 第一医院/转化医学研究院,吉林 长春300;.吉林大学 动物医学学院,吉林 长春3006;3.吉林大学 人兽共患病研究所 教育部人兽共患病研究重点实验室,吉林 长春3006)
伪狂犬病(pseudorabies,PR)是世界动物卫生组织(OIE)法定通报的疫病之一,也是“国家中长期动物疫病防治规划(2012-2020)”中被列为优先防制的猪病之一,其病原体为猪疱疹病毒Ⅰ型(Su HV1),也称为奥耶斯基氏病毒(ADV)或伪狂犬病病毒(PRV)。PRV 在分类上属于疱疹病毒科,α-疱疹病毒亚科,水痘病毒属[1-2]。该病毒可感染多种哺乳动物,包括猪、食肉动物、啮齿动物和反刍动物[3],其中猪感染PRV 临床上以新生仔猪呈现神经系统紊乱和死亡、成年猪表现为呼吸困难、母猪繁殖障碍为特征,给养猪业造成严重的经济损失[4-8]。
在我国,PR 最早是刘永纯[9]于1947年在猫中发现,随后在牛和猪中也陆续有报道。至2000年以后,PR 已在中国所有区域呈地方流行或零星分布[10]。为控制PRV 感染猪,1979年我国从匈牙利进口了Bartha-K61疫苗并评估其安全性和免疫效果[11]。自20世纪80年代后期,国内许多地区大规模接种PR 基因缺失活疫苗(Bartha-K61株或其衍生物),对防控PR 的发生与流行发挥了重要作用[12-13]。然而,自2011 年底开始,国内许多接种Bartha-K61 疫苗的猪群出现了大量的PRV 变种[4,10,14],传统的Bartha-K61疫苗对其不能提供完全保护,给养猪业造成了巨大的经济损失;因此,建立快速有效的诊断检测方法对控制和根除PR 具有重要的意义[15-19]。
1980年以前,PR 的诊断方法包括病毒分离、病毒中和试验(VNT)以及动物接种试验。20世纪90年代以来,酶联免疫吸附试验(ELISA)、聚合酶链式反应(PCR)以及实时荧光定量PCR 被广泛运用于PR 的快速诊断。由于PRV 感染多是持续性感染或隐性感染,平时难以发现,因此迫切需要建立更加特异、敏感和方便的方法,用于识别和淘汰PRV 潜伏感染的携带者。双抗体夹心ELISA 方法是检测抗原最常用的方法,且该方法特异性强、敏感、易于操作,并且经济、省时,尤其适合大规模的流行病学调查。gB糖蛋白是PRV 包膜的主要成分,由913个氨基酸(aa)组成,属于高度保守的疱疹病毒糖蛋白,介导病毒的侵入过程和细胞至细胞的传播,在诱导保护性免疫中起重要作用,被认为是制备亚单位疫苗最有希望的备选蛋白基因[20-21]。因此,本研究应用PCR 技术扩增出PRV gB基因,并将克隆的目的片段连接到表达载体,以表达纯化的重组蛋白为抗原制备单克隆抗体,建立检测PRV 抗原的双抗体夹心ELISA 方法,并对吉林省某地区猪群感染PRV 的情况进行了流行病学调查。
1 材料与方法
1.1 PRV 毒株、菌株及载体PRV 毒株分离于吉林省某发病猪场,分离毒株进一步鉴定后命名为PRV-JL15株,-80℃低温冰箱保存;DH5α和BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司;p GEX-4T-1原核表达载体,由本实验室保存。
1.2 PRV gB基因的扩增以天根生化科技(北京)有限公司的基因组提取试剂盒,从PRV-JL15毒株感染的细胞中提取DNA 模板,利用上海生工生物工程有限公司合成的引物进行PCR 扩增gB 基因。引 物 序 列gB-UP:5′-CGCGGATCCCGTGCTCTTCAAGGAGAACATC-3′(Bam H Ⅰ);gB-DN:5′-CCGGAATTCGAGTCCAGGTCGATGGGGTAG-3′(Eco RⅠ)。
1.3 原核表达质粒的构建以及重组蛋白的表达与纯化将扩增的DNA 片段以Bam HⅠ和EcoRⅠ酶切后,连接到pGEX-4T-1载体的Bam HⅠ/EcoRⅠ酶切位点。连接产物转化后,挑取单一菌落,培养后提取重组质粒p GEX-4T-1-B。通过双酶切鉴定和测序验证后的重组质粒再转化到BL21(DE3)感受态细胞中,获得表达菌株。挑取单一菌落培养至对数生长期(D600=0.6~0.8),加入IPTG 至终浓度1 mmol/L,于37℃诱导表达3 h,然后以SDSPAGE电泳检测重组蛋白的表达及可溶性。
蛋白的纯化按照本实验室优化的蛋白纯化方法进行[22]。培养收集的细菌以PBS洗涤后,反复冻融3次,冰浴条件下超声波裂解菌体,待溶液变透亮时,用1.5 mol/L尿素清洗沉淀3次,最后用8 mol/L尿素溶解沉淀。纯化后的蛋白利用碧云天BCA蛋白浓度测定试剂盒测定浓度后分装,-80℃冻存。
1.4 单克隆抗体的制备与特性鉴定纯化的重组蛋白与等体积的弗氏佐剂混合充分乳化后,免疫BALB/c小鼠。将100μL(120μg)抗原分点注射到6~8周龄的BALB/c雌性小鼠的背部皮下,14 d和28 d后,以相同剂量加强免疫2次。免疫小鼠血清效价达到1∶100 000以上时,于融合前3 d,直接腹腔注射120μg 抗原,之后取其脾细胞与骨髓瘤SP2/0细胞以5∶1的比例进行融合。待杂交瘤细胞长至孔底1/3 以上时,取培养液上清用间接ELISA 方法进行检测,免疫小鼠血清作为阳性对照,SP2/0细胞培养上清作为阴性对照,筛选出阳性杂交瘤细胞。多次亚克隆筛选后扩大培养注入小鼠腹腔,10 d 后小鼠明显腹胀时,取其腹水并纯化,-80℃保存。
单克隆抗体特异性的鉴定采用间接ELISA 方法进行。以100 ng/孔包被纯化后的单抗,加入PRV、猪瘟病毒(CSFV)和猪戊型肝炎病毒(HEV)抗原作为待检抗原,同时以纯化后的gB 重组蛋白作为阳性对照,缓冲液PBS作为阴性对照,每种病毒选取3个样品,每个样品重复3次。
1.5 PRV多克隆抗体的制备与标记以同样的免疫方法将1.8 mg的免疫原多点注射到新西兰大白兔的背部皮下,经过2次加强免疫,兔血清效价达标后,采用心脏采血法获得高免血清,应用郭春祥等[23]过碘酸钠氧化法对纯化后的多克隆抗体进行HRP标记,-80℃冻存备用。
1.6 夹心ELISA方法的建立
1.6.1 最佳捕获抗体及酶标抗体工作浓度的确定 以单克隆抗体作为捕获抗体,辣根过氧化物酶标记的兔源多克隆抗体作为酶标抗体,建立检测PRV抗原的双抗体夹心ELISA 方法。最佳捕获抗体及酶标抗体的浓度采用方阵滴定法确定。用包被液将单抗分别按2.00,1.50,1.25,1.00,0.75 mg/L 的质量浓度进行稀释,酶标反应板每孔加入100μL,4℃包被过夜。5%脱脂奶粉封闭37℃1 h,洗板后加入1∶5预处理粪便样品100μL,洗涤3次后分别加入1∶200,1∶400,1∶800,1∶1 000,1∶1 600,1∶2 000 系列稀释的HRP 标记的多抗。每种组合3个重复,比较各重复的平均值,取D490值在1.0 左右,P/N 值最大的孔所对应的单抗包被浓度和多抗稀释度为捕获抗体与酶标抗体的最佳工作浓度。
1.6.2 夹心ELISA 条件的优化 采用已确定的单抗最佳包被浓度,将单抗分别按37℃1 h、37℃2 h、4℃过夜等3种不同条件包被酶标板,每种条件3个重复,其他反应条件不变,进行夹心ELISA 试验,从而确定最佳包被条件。以同样的方法确定最佳封闭液、最佳封闭时间、酶标二抗的最佳作用时间和最佳显色时间。
1.6.3 夹心ELISA 判定标准的确定 根据以上优化出的夹心ELISA 的试验条件,检测40份PRV 阴性的粪样,计算阴性样品D490值的平均值()和标准差(s),根据统计学原则,当样本的D490值≥+3s时判定为阳性,否则为阴性,从而确定本方法检测样品阴阳性临界值。
1.6.4 夹心ELISA 特异性试验 应用建立的双抗体夹心ELISA 方法对猪瘟、猪圆环病毒病和猪戊型肝炎病阳性粪液进行特异性检测,同时设立PRV 阳性、阴性对照。每种病毒选取4个样品,每个样品重复3次,确定方法的特异性。
1.6.5 夹心ELISA 敏感性试验 应用夹心ELISA方法和扩增gB基因的PCR 方法,分别检测30份待检粪样,比较2种方法检测结果的符合率。
1.6.6 夹心ELISA 重复性试验 取不同批次或同一批次不同种类的酶标板,分别检测PCR 验证的PRV 阳性粪便样品和阴性粪便样品,进而计算出不同批次酶标板的组间变异系数,以及同一批次不同酶标板间的组内变异系数。
1.7 吉林省PRV流行病学的调查应用建立的双抗体夹心ELISA 方法,检测采集吉林省不同地区的451份猪粪便样品,其中育肥猪粪样71份、妊娠母猪粪样163份、产房母猪粪样87份、保育仔猪粪样130份,确定PRV 带毒率。
2 结果
2.1 原核表达质粒的构建以PRV 的DNA 为模板,利用合成的gB特异性引物进行PCR 扩增,得到一条555 bp的DNA 片段(图1A),经Bam HⅠ和EcoRⅠ酶切纯化后,将其连接到p GEX-4T-1 载体的Bam HⅠ/EcoRⅠ酶切位点。连接产物转化后,挑取菌落,提取重组质粒p GEX-4T-1-B。双酶切鉴定结果如图1B 所示,出现了预期大小约5 000 bp的片段和略大于500 bp的片段。质粒测序结果表明,目的片段没有突变、移码,表明原核表达质粒构建正确,重组质粒命名为p GEX-4T-1-B。
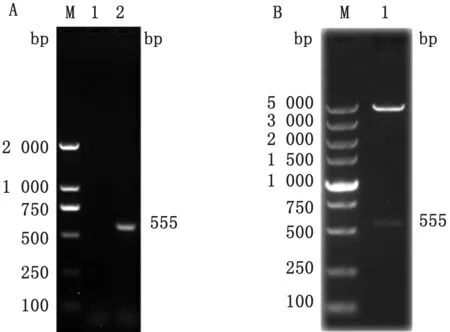
图1 PRV-gB基因的扩增及重组质粒p GEX-4T-1-B 的双酶切鉴定 A.PRV-gB基因的扩增结果(1.阴性对照;2.PRV gB基因片段扩增产物;M.DL2000 DNA Marker);B.构建重组质粒pGEX-4T-1-B的Bam HⅠ/EcoRⅠ酶切鉴定结果(1.Bam HⅠ和EcoRⅠ双酶切产物;M.DL5000 DNA Marker)
2.2 重组蛋白的表达与纯化将重组阳性菌培养至对数生长中期D600=0.7,然后加入IPTG 继续37℃诱导,3 h后收集菌液与等体积的上样缓冲液混合,沸水中加热10 min,室温冷却后进行SDSPAGE电泳。凝胶经染色、脱色后显示,诱导菌比未诱导菌明显多一条约46 000的蛋白条带(图2),与预期结果一致。采取尿素纯化包涵体的方法纯化蛋白,用BCA 法测定蛋白质量浓度为2.4 g/L。
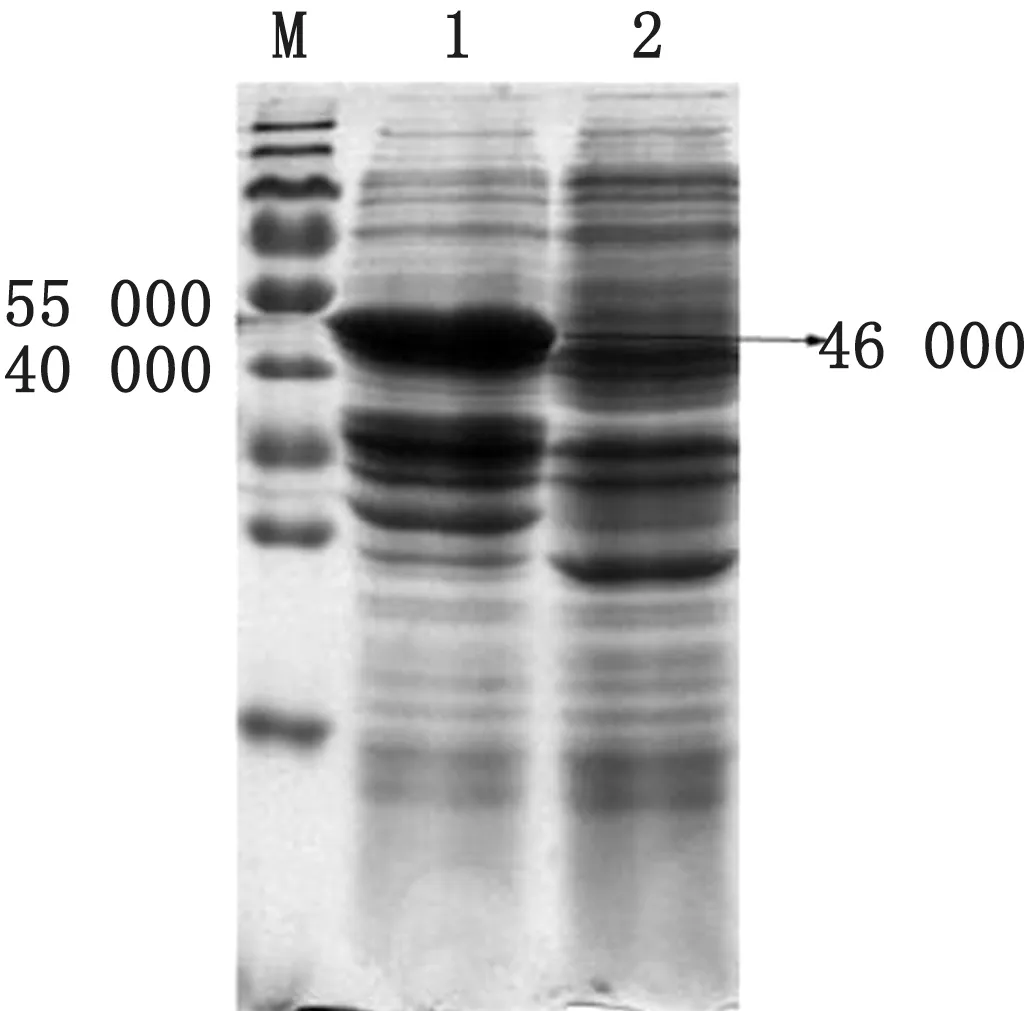
图2 表达产物的SDS-PAGE检测 1.诱导菌;2.未诱导菌;M.蛋白相对分子质量标准
2.3 单克隆抗体的制备与鉴定小鼠三免后,选取血清效价最高的1号小鼠脾细胞与SP2/0 细胞进行融合试验(图3),应用间接ELISA 方法筛选出19株分泌抗体的杂交瘤细胞株,再经有限稀释法进行亚克隆筛选、GST 标签及稳定性的检测,最终获得1株稳定分泌单克隆抗体的细胞株8G3。应用佰奥通单抗Ig 类亚类鉴定试剂盒判断出抗体亚型为IgG2a,BCA 法测其浓度为2 g/L。采用间接ELISA 方法对单克隆抗体的特异性进行鉴定,如图4所示,8G3细胞株制备的单克隆抗体不与CSFV、HEV 抗原反应,仅与PRV 抗原发生特异性免疫反应,具有良好的特异性。
图3 免疫小鼠血清抗体效价

图4 单抗特异性检测
2.4 多克隆抗体的制备与标记采用郭春祥等[23]的方法对纯化的多克隆抗体进行HRP标记来制备酶标抗体,应用微观吸光、荧光光度计分别测得280 nm 和403 nm 波长的D值,经计算,IgG 含量为1.323 g/L,HRP含量为0.611 g/L,克分子比值为1.847,HRP标记率为58.95%,表明标记效果良好。
2.5 夹心ELISA方法的建立及判定标准方阵滴定法确定捕获抗体最佳包被质量浓度为1.25 mg/L,酶标抗体最佳稀释倍数为1∶1 600(表1)。确定的最佳反应条件为4℃过夜包被单抗,5%脱脂奶粉37℃封闭1 h,酶标二抗37℃工作45 min,显色液室温避光反应10 min。

表1 捕获抗体与酶标抗体不同条件下P/N 的比值
对40份PRV 阴性的粪样进行夹心ELISA 检测,确定阴性样品D值的平均值()为0.185 6,标准差(s)为0.021 6。根据统计学原则,当样本的D490值≥+3s时,可以在99.9%的水平上判定为阳性;所以,夹心ELISA 检测样品的阴阳性临界值为0.250 4。
2.5.1 夹心ELISA 特异性试验 如图5所示,应用建立的双抗体夹心ELISA 方法对猪瘟病毒(CSFV)、猪圆环病毒2 型(PCV2)和猪戊型肝炎病毒(HEV)阳性粪液进行检测,结果均不反应,表明所建立的夹心ELISA 方法具有良好的特异性。
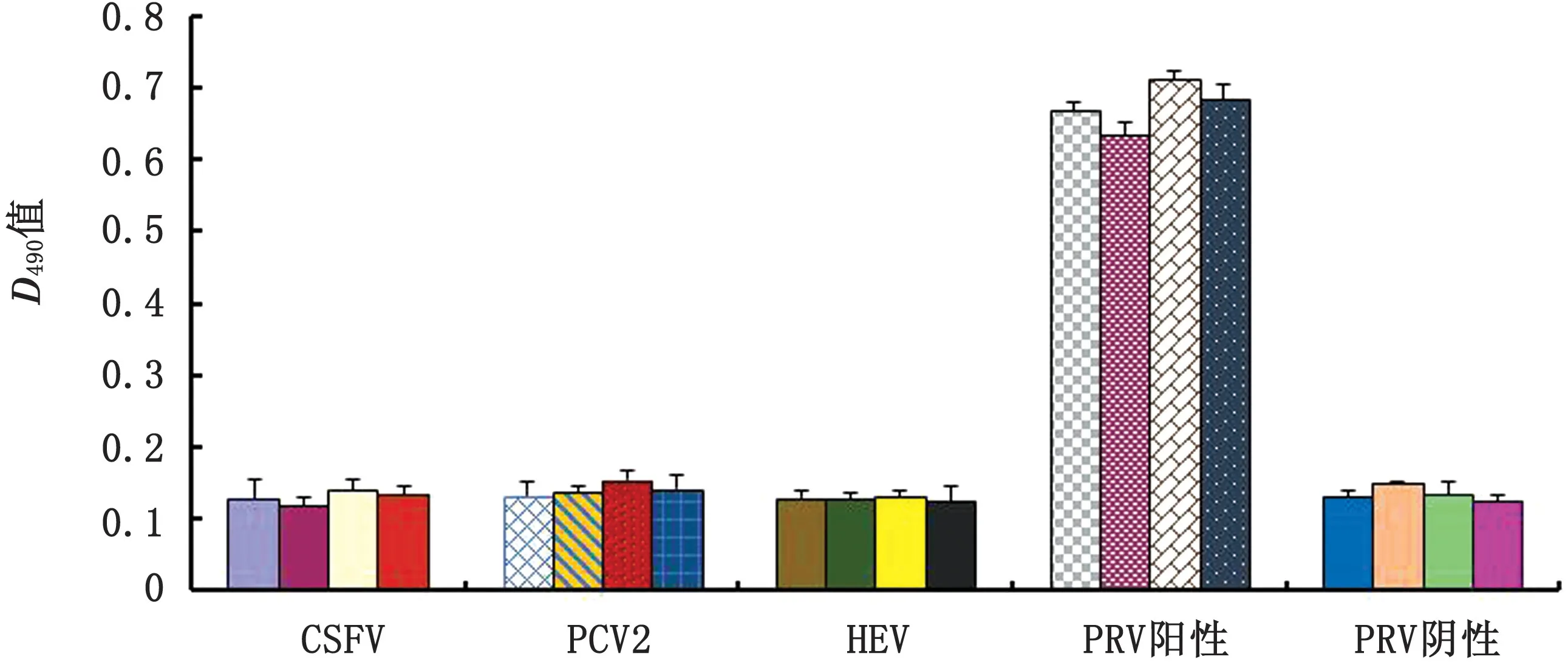
图5 夹心ELSIA 特异性检测
2.5.2 夹心ELISA 敏感性试验 应用PCR 方法检30份粪样,其中阳性3例,阴性27例,而应用夹心ELISA 方法检测粪样得到了相同的结果(表2)。2种方法检测的结果一致,表明夹心ELISA 方法具有较高的敏感性。
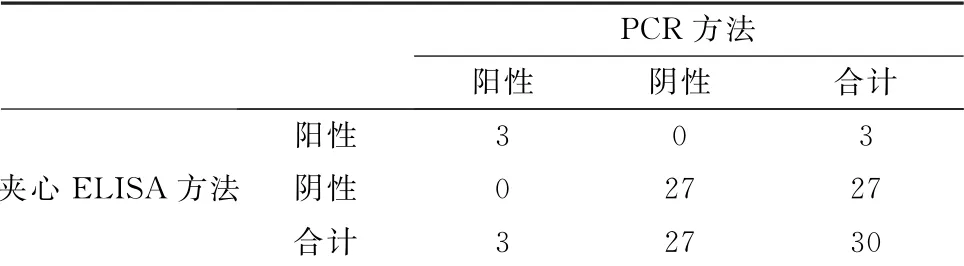
表2 PCR 方法与夹心ELISA 方法试验结果的比较
2.5.3 夹心ELISA 重复性试验 利用同一批次不同种类的酶标板(表3)和不同批次的酶标板(表4)分别检测PCR 验证的PRV 阳性粪便样品和阴性粪便样品,结果显示,各个样品的变异系数均小于6%,说明建立的夹心ELISA 方法具有很好的组内重复性和组间重复性。

表3 同一批次重复性的检测 D 490值

表4 不同批次重复性的检测 D 490值
2.6 吉林省某地区PRV流行病学的调查应用建立的双抗体夹心ELISA 方法对吉林省某地区451份猪粪便样品进行检测,结果表明该地区的猪场存在不同程度的感染,且妊娠母猪感染PRV 野毒的阳性率较高(表5)。
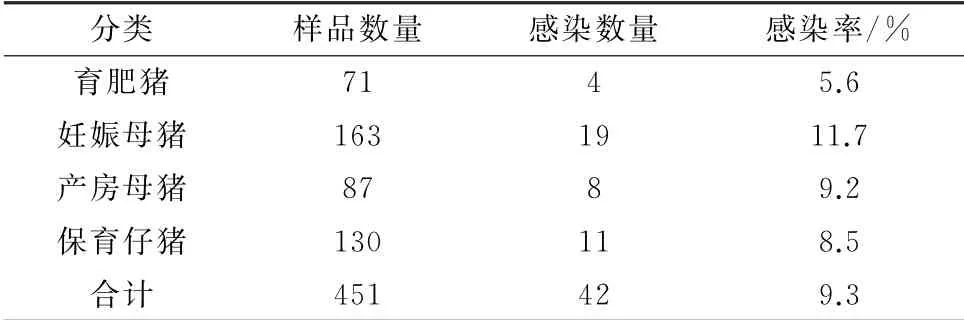
表5 吉林省某地区猪群感染PRV 的检测
3 讨论
伪狂犬病(PR)是由PRV 引起的,具有传播快、流行广、致死率高等特点,对畜牧业造成了巨大的经济损失,严重阻碍了我国养猪业的可持续发展。控制和根除PR 除了安全有效的疫苗,快速诊断和检测出感染猪也是非常重要的措施。ELISA 是以免疫学反应为基础,将抗原、抗体的特异性反应与酶对底物的高效催化作用相结合起来的一种敏感性很高的试验技术。此项技术自20世纪70年代初问世以来,发展十分迅速,目前已被广泛应用于生物学和医学科学的许多领域。双抗体夹心ELISA 法则是检测抗原最常用的方法,但对抗体的特异性和亲和性要求较高,因而本试验中的包被抗体和酶标抗体分别取自不同种属的动物。试验将鼠源单抗作为捕获抗体,仅能识别某一特定抗原位点,减少了非特异性结合造成的假阳性;将兔源多抗作为检测抗体,与多种抗原表位结合,避免漏检,放大信号;同时,优化了双抗体夹心ELISA 试验条件,确定了检测样品阴阳性临界值为0.250 4;建立了特异、敏感、可重复性的双抗体夹心ELISA 方法。
为了解近年来吉林省某地区猪场中PRV 野毒的感染情况,应用建立的双抗体夹心ELISA 方法对该地区的猪粪便样品进行了检测,结果表明,PRV平均感染率为9.3%,低于2000年吉林省兽医科学研究所对PRV 血清学调查的临床发病率(12%)[24],也低于初小辉[25]2011 年调查的吉林省各地区的抗体平均阳性率22.66%,说明该地区采取免疫、监测以及淘汰等综合防制措施对PRV 野毒感染的控制取得了显著效果。此次对不同日龄、不同性别的猪粪便进行调查,发现妊娠母猪PRV 阳性率11.7%,高于产房母猪、保育仔猪以及育肥猪,表明母猪的带毒现象仍然存在,是导致母猪繁殖障碍的重要原因之一,应当引起高度重视。
