裕民贝母种子形态休眠解除过程中的形态学研究
2019-12-04朱敏嘉黄俊华杨文英王厚强帕孜来提古丽塞买提王严严
朱敏嘉,黄俊华*,杨文英,王厚强,帕孜来提古丽·塞买提,王严严
(1. 新疆农业大学 林学与园艺学院,新疆 乌鲁木齐 830052;2. 新疆农业大学 林业研究所,新疆 乌鲁术齐 830052)
裕民贝母(FritillariayuminensisX. Z. Duan),隶属于百合科(Liliaceae)贝母属(Fritillaria)多年生草本,是一种极富园林用途兼备药用价值的早春蓝紫色球根花卉资源。茎光滑直立;叶呈披针形,以轮生为主,仅基部叶对生;花呈伞状倒钟形,具湛蓝及浅粉两种花色;蜜腺窝向外凸起;花药基着;柱头不开裂;花柱上部具微毛;蒴果具翅[1]。喜阴耐湿,常出现在海拔2200-2800 m的高山地带,如草地、旷野和砾石等自然环境中;分布于我国北疆塔城地区及中亚地区[2]。由于裕民贝母的观赏及药用价值备受关注,导致其被过度采挖、数量锐减,加之其多态性百分率低[3],存在遗传风险,并且分布区狭窄,资源紧张,是亟待保护和研究利用的种质资源。采集和研究裕民贝母种子可为野生抚育及人工栽培提供基础材料,这对种质保育、开发利用及引种驯化具深刻意义。
关于裕民贝母种子的研究较为贫乏,仅郑秀菊[4]和段咸珍[5]指出该种子在5-10℃低温条件下完成形态后熟需50 d,之后再经过35-40 d生理后熟才能萌发。针对这一现象,拟以裕民贝母种子为研究对象,采取有效措施打破种子形态休眠,并从种子形态结构和亚微结构两方面阐述种子解除形态休眠的响应机制,为进一步打破种子生理休眠提供借鉴意义。
1 材料与方法
1.1 试验材料
试验以裕民贝母种子为供试材料,采集于2017年7月,地点位于新疆维吾尔自治区塔城地区裕民县江克斯乡附近(45°56'-46°10' N,82°39'-82°67' E,海拔757-1080 m)。
1.2 仪器与设备
RTOP-268Y智能人工气候箱(浙江托普公司),SMZ-25体式显微镜(日本Nikon公司),KB-250超声波清洗器(德国Elma公司),JFC-1600离子溅射仪(日本JEOL公司),LEO-1430VP扫描电子显微镜(德国Zeiss公司)。
1.3 试验方法
1.3.1 种子预处理
设置6个时间段,每个时间段取GA3:30 mg/L(CK)、GA3:30 mg/L两处理种子40粒,重复3次,浸种3 d后置于智能人工气候箱中进行5/10℃暗环境培养。
1.3.2 种子形态结构的变化
每隔20 d取CK和GA3:30 mg/L两处理种子各10粒,重复3次,用体式显微镜进行解剖,观察带皮种子、去皮种子、胚乳及胚的形态结构变化,拍照并计算胚率。公式如下:

(1)
1.3.3 种子亚微结构的变化
每隔20 d取CK和GA3:30 mg/L两处理带皮种子、胚乳及胚各10粒,重复3次,用60%的丙酮溶液固定样品24 h,待样品自然干燥后,使用超声波清洗器进行清洗,再用导电胶固定于铜质电镜台上,随后使用离子溅射仪喷金镀膜,最后转入扫描电子显微镜下观察气孔器、种皮、胚乳及胚的亚微结构,拍照并记录各参数指标。种子亚微结构描述参考Barthlott[6]和Song等[7];气孔器密度,气孔器指数测定参考Dilcher[8]和Wilkinson[9]。公式如下:
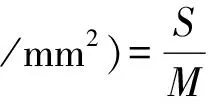
(2)
(3)
式中:D为气孔器密度(个/mm2);S为固定面积内气孔数量(个);M为固定面积;I为气孔器指数(%);E为固定面积内表皮细胞数量(个)。
1.4数据处理
SPSS 18.0软件分析试验数据,Duncan方差分析检验单因素(One-Way ANOVA),Photoshop CS6软件处理图片,Microsoft Excel 2003软件绘制图表。
2 结果与分析
2.1 种子形态休眠解除过程中形态结构的变化
2.1.1 种子形态结构
裕民贝母种子扁平且光滑,呈三角倒卵形或倒卵椭圆形,吸水肿胀后可观察到种皮、胚乳及胚;棕褐色种翅干瘪无弹性,具皱褶细纹;黄褐色种皮轻薄如纱,表面纹路同于种翅;弧形胚腔狭长且弯曲;种子尖端处存在小型种孔;经测量胚长(1.13±0.07)mm,胚乳长(5.06±0.05)mm,胚率为(22.33±0.33)%(见图1:A)。胚乳吸水后变为半透明状,圆形微小的淀粉粒广布其中(见图1:B);胚乳未吸水时硬如甲片,线形纹路清晰可见(见图1:C)。点状胚半透明,位于种孔和胚腔基部交汇处,停留在原胚阶段,无分化明显的子叶、胚芽、胚轴和胚根,子叶暂未分化出吸器、子叶联结以及子叶鞘(见图1:D)。
2.1.2 带皮种子形态结构的变化
图2可见,裕民贝母带皮种子吸水肿胀后,呈中间略鼓两边扁平状态,乳白色胚尚未发育完全,处于点状原胚阶段,位于种孔端,体量很小,由于半透明状胚乳面积较大,此时胚率仅为22.33%,弧形胚腔约与胚乳等长,种翅由种皮内部萎焉细胞演化而来,并附着在胚乳周围一圈。CK和GA3:30 mg/L的胚随时间推移不断生长发育,并逐渐充斥整个胚腔,胚率不断增长。20-40 d胚率增长最快,CK的胚率由27.00%增至54.00%,而GA3:30 mg/L的胚率由36.33%升至62.67%;60 d时,GA3:30 mg/L的胚率已突破81.67%,CK的胚率则停留在70.00%。80 d时,CK的胚率缓慢增长为77.00%,GA3:30 mg/L的胚率稳定在86.67%;100 d时,CK的胚率稳定在79.33%,GA3:30 mg/L的胚率则高达87.67%,两者胚率相差8.34%。综上,裕民贝母种子发育不健全,存在形态休眠。CK处理80后胚率日渐恒定,说明裕民贝母种子形态休眠自然破除需80 d,但GA3:30 mg/L处理60 d后胚率高于80%并趋于稳定,另外GA3:30 mg/L最终胚率高于CK,表明GA3:30 mg/L仅需60 d便可打破种子形态休眠,这意味着外源GA3能刺激胚细胞伸长从而提高胚率。整个过程种皮颜色有一定程度的加深,种翅吸水后弹性有些许增强但张力极小,后期少数种皮出现不同程度的龟裂情况,种皮龟裂部位大多数集中在种子略鼓的中部,另外始终不见胚根突破种孔,种子没有任何发芽迹象。
2.1.3 去皮种子形态结构的变化
裕民贝母种子未吸水时,种皮与胚乳很难被剥离,但是吸水后能很大程度的改善这种情况,反映出水分可以有效减轻种皮与胚乳的粘连程度,图3显示胚乳充分吸水后透明度变高。在种子破眠期间,两处理去皮种子的胚乳清晰可见,还可以观察到胚腔以及乳白色内含物。胚腔是没有任何细胞的空腔组织,位于胚乳中部,主要源于中部原始胚乳细胞的降解,为胚的生长发育提供场所。胚乳中主要可见的内含物是淀粉粒,它们多以圆形微小颗粒散布于胚乳中,在胚成熟过程中为其提供营养物质。随处理时间延长,胚乳中的淀粉粒由胚腔向四周逐渐水解,且淀粉粒数量不断减少,胚通过吸收胚腔中的降解物来维持生命活动。此外,胚乳质地不再坚硬,变得柔软光滑,但胚乳中的半纤维素组织依旧发达,细胞壁仍保持较高的机械强度,弯曲的满胚无法借助反向作用力顶破珠孔端进行萌发。
2.1.4 胚乳形态结构的变化
图4可见,人为分离胚乳和胚时,珠孔端有不同程度的开裂情况,形态破眠阶段胚乳虽有弱化现象,但胚乳机械强度并未减少到胚根可直接突破珠孔,说明胚乳对胚具一定机械阻力。种子形态破眠时,由于胚乳吸收水分后变软,胚乳与胚相比之前更易分离,水分蒸发后胚乳表面的线形纹路更加清晰,胚乳也因失水和内含物减少慢慢呈干瘪状,因此胚乳对胚的机械阻碍越来越弱,可见胚完成形态休眠所需的营养主要由胚乳提供,在这个过程中胚乳将自身贮存的大分子内含物水解成小分子化合物供胚吸收。
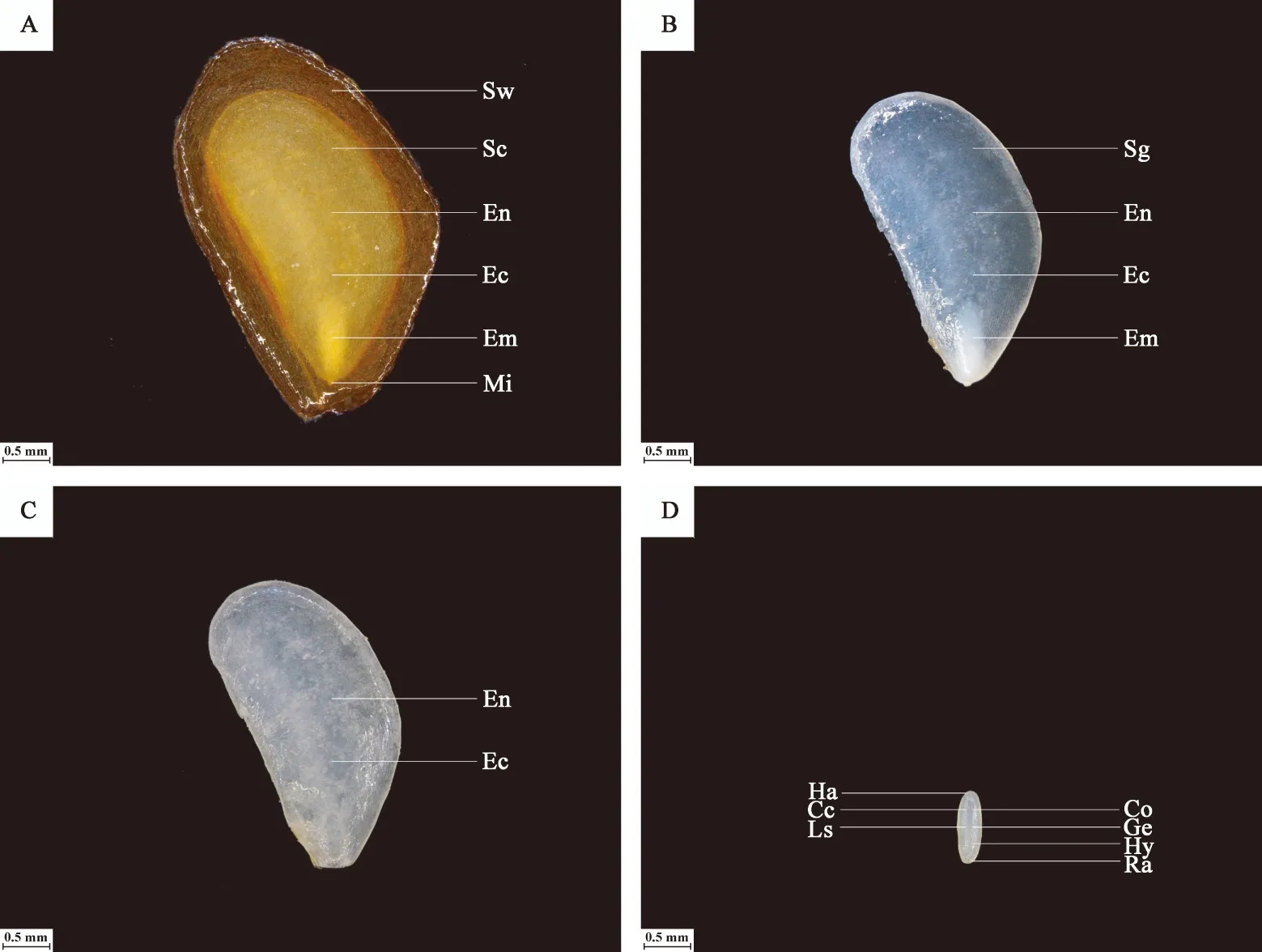
图1 裕民贝母种子形态结构Fig. 1 Morphological structure of seeds in F. yuminensisA-带皮种子;B-去皮种子;C-胚乳;D-胚。A-Seeds with coat; B-Seeds without coat; C-Endosperm; D-Embryo.注:Sw-种翅;Sc-种皮;En-胚乳;Ec-胚腔;Em-胚;Mi-种孔;Sg-淀粉粒;Co-子叶;Ge-胚芽;Hy-胚轴;Ra-胚根;Ha-吸器;Cc-子叶联结;Ls-子叶鞘。Note: Sw-Seed wing; Sc-Seed coat; En-Endosperm; Ec-Embryo cavity; Em-Embryo; Mi-Micropyle; Sg-Starch granule; Co-Cotyledons; Ge-Germ; Hy-Hypocotyl; Ra-Radicle; Ha-Haustoria; Cc-Cotyledon coupling; Ls-Leaf sheath.

图2 裕民贝母带皮种子形态结构的变化Fig. 2 Morphological structure changes of seeds with seed coat in F. yuminensis注:A-CK;B-GA3 30 mg/L。Note: A-CK; B-GA3 30 mg/L.

图3 裕民贝母去皮种子形态结构的变化Fig. 3 Morphological structure changes of seeds without seed coat in F. yuminensis注:A-CK;B-GA3 30 mg/L。Note: A-CK; B-GA3 30 mg/L.
2.1.5 胚形态结构的变化
图5可见,0 d时,两处理的点状原胚均未观测到分化明显的子叶、胚芽、胚轴以及胚根。20 d时,两处理的胚均有一定的生长,形状类似鱼雷,GA3:30 mg/L的胚稍长于CK。40 d时,两处理胚的顶端有所膨大,CK的胚呈棒状,而GA3:30 mg/L的胚出现折角,形似镰刀,显然此时胚已分化出子叶,子叶分为远基和近基两部分,远基处将来会形成吸器,近基处将来会形成子叶鞘,两者中间部位则会形成子叶联结。60 d时,两处理胚的顶端保持膨大且透明的状态,呈扁舌状,膨大部分为吸器,吸器透过胚腔吸收胚乳水解的内含物来维持种胚正常生长;GA3:30 mg/L的胚不仅变长变粗,并且弯折角度变大,胚开始变绿,表明此处为子叶联结,子叶联结具有纵向生长能力,是胚根突破种孔的主要力量。80 d时,两处理的胚保持缓慢速度纵向生长,弯折程度进一步加深,CK的胚开始泛绿,GA3:30 mg/L处理下胚的绿色部分有所加深和延长。100 d时,两处理胚的长度变化较小,弯折有所平展;透明吸器有些萎焉,作为胚的营养储备物,即使将来胚乳消失,吸器依旧可以保证胚的正常发育,最终从种皮处脱落;子叶联结部分变长且颜色加重,已具备同化功能,此后在胚腔内产生的反向作用力,有利于短缩的胚芽、胚轴和胚根一起突破种皮而萌发;短缩状态的胚芽、胚轴以及胚根始终很难被分辨出来,胚芽上端具保护功效的子叶鞘分化不明显,胚轴作为胚前期生长的主要方式将会进行向地性生长,胚根则会在种子萌动期间率先突破种孔端。种子虽然未萌发,但是胚形态已趋于成熟,且胚率稳定,标志着种子形态休眠基本解除。

图4 裕民贝母胚乳形态结构的变化Fig. 4 Morphological structure changes of endosperm in F. yuminensis注:A-CK;B-GA3 30 mg/L。Note: A-CK; B-GA3 30 mg/L.

图5 裕民贝母胚形态结构的变化Fig. 5 Morphological structure changes of embryo in F. yuminensis注:A-CK;B-GA3 30 mg/L。Note: A-CK; B-GA3 30 mg/L.
2.2 种子形态休眠解除过程中亚微结构的变化
2.2.1 种子亚微结构
图6A所示,裕民贝母气孔器随机分布于种翅边缘,呈宽卵圆形或长椭圆形,被4-6个表皮细胞包围,位置略微低于表皮细胞的平面,内部的细胞壁厚实,外部的细胞壁扁薄,由两个肾形保卫细胞组成,内含少数排列整齐的叶绿体,无副卫细胞,气孔器处于开放状态,属于无规则型气孔器,长度为(68.89±1.44)μm,宽度为(56.72±0.28)μm,密度为(0.67±0.33)个/mm2,指数为(0.68±0.34)%。图6B所示,裕民贝母种皮表面纹饰为网纹型,表皮细胞为不规则形并且排列无序,长度为(171.05±22.34)μm,宽度为(60.30±6.77)μm,密度为(100.33±4.62)个/mm2,垂周壁样式为深波形(波状深度/表皮细胞宽度≥ 1/4)。图6C所示,裕民贝母胚乳表面纹饰为条纹型,表皮细胞为长矩形或近四边形并且排列有序,长度为(188.70±10.59)μm,宽度为(62.16±6.75)μm,密度为(107.33±5.61)个/mm2。图6D所示,裕民贝母胚顶部表面纹饰为网纹型,表皮细胞为长矩形或多边形并且排列紧致,长度为(48.06±3.63)μm,宽度为(30.39±0.08)μm,密度为(388.33±4.70)个/mm2。图6E所示,裕民贝母胚中部表面纹饰为条纹型,表皮细胞为长矩形并且排列整齐,长度为(63.54±6.00)μm,宽度为(18.62±0.99)μm,密度为(762.33±10.99)个/mm2。图6F所示,裕民贝母胚基部表面纹饰为网纹型,表皮细胞为长矩形或多边形并且排列紧密,长度为(46.68±2.93)μm,宽度为(26.36±0.64)μm,密度为(437.33±15.03)个/mm2。
2.2.2 气孔器亚微结构的变化
观察图7,发现裕民贝母位于种翅边缘的气孔器呈宽卵圆形或长椭圆形,由两个凹陷的肾形保卫细胞组成。随时间推移,肾形保卫细胞内部的叶绿体数量显著增加,CK处理80 d时叶绿体几乎遍布整个保卫细胞,而GA3:30 mg/L处理仅需60 d,意味着外源GA3可以促进气孔器发育成熟。裕民贝母种子形态破眠各阶段,两处理气孔器的着生位置未发生改变,并且气孔器始终处于开放状态,这有利于种子的呼吸作用。内侧细胞壁较厚,可以尽量减少气孔器在开闭过程中遭受外界伤害。外侧细胞壁较薄,能够有效连接气孔器和种皮的表皮细胞。不同时期的气孔器大小尺寸略微不同,是否存在差异需根据气孔器长度、宽度、密度以及指数等数据进一步确定。
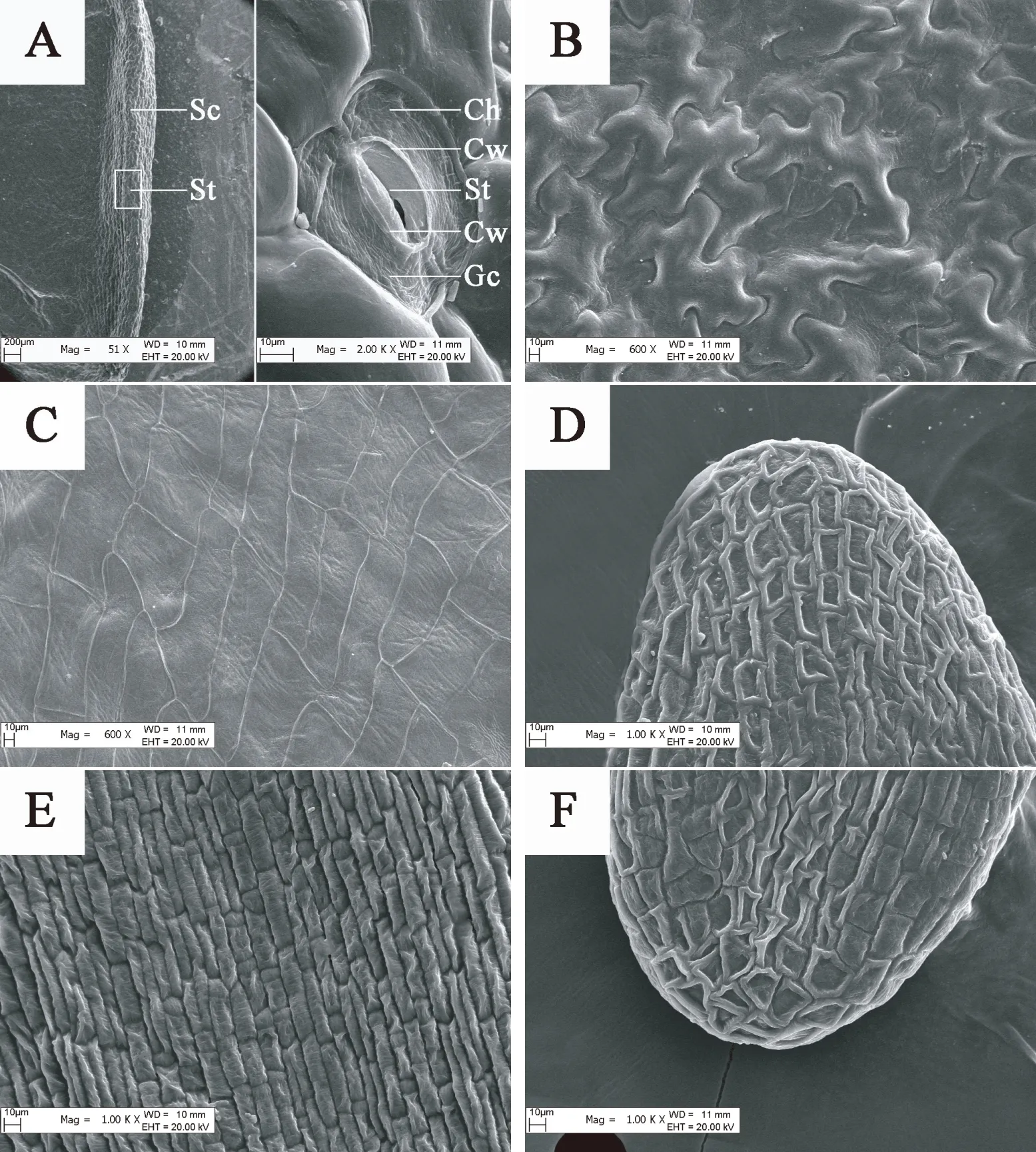
图6 裕民贝母种子亚微结构Fig. 6 Submicrostructure of seeds in F. yuminensisA-气孔器;B-种皮;C-胚乳;D-胚顶部;E-胚中部;F-胚基部。Note: A-Stoma; B-Seed coat; C-Endosperm; D-Top embryo; E-Middle embryo; F-Basic embryo.注: Sc-种皮;St-气孔器;Ch-叶绿体;Cw-细胞壁;Gc-保卫细胞。Note: Sc-Seed coat; St-Stoma; Ch-Chloroplast; Cw-Cell wall; Gc-Guard cell.
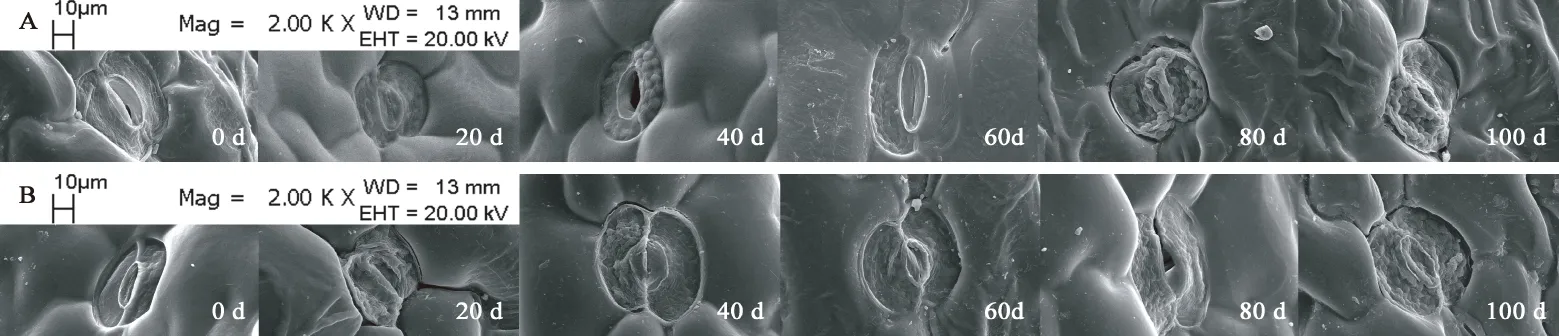
图7 裕民贝母种皮中气孔器亚微结构的变化Fig. 7 Submicrostructure changes of stoma in F. yuminensis seed coat注:A-CK;B-GA3 30 mg/L。Note: A-CK; B-GA3 30 mg/L.
2.2.3 表皮细胞亚微结构的变化
两处理种皮的不规则表皮细胞变化不明显并且无破损,呈龙骨状,光滑且无附属物,网脊明显,另外网眼突出,并且细胞界限清晰,深波形的表皮细胞垂周壁相互交错呈网状(见图8)。胚乳的条纹状表面纹饰有显著变化,由于淀粉粒吸水期间会肿胀并且水解期间会干瘪,导致胚乳表皮细胞所受的支撑力不足而发生破裂现象,因此胚乳表皮细胞数目锐减,GA3:30 mg/L胚乳表皮细胞破损程度比CK更为严重,说明外源GA3可以加速淀粉粒的水解(见图9)。两处理的胚顶部和胚基部均呈半椭圆形,而胚中部则呈长方形;胚表皮细胞具三种形态,其中顶部和基部多为四边形或多边形,中部为长矩形;胚表皮细胞光滑且界限明显,呈凹陷或凸出两种状态,凹陷细胞的网眼下陷且网脊凸出,凸出细胞的网眼稍鼓并且网脊平滑又或者是网眼和网脊均急剧皱缩呈线状(见图10、11、12)。综上,裕民贝母种子解除形态休眠过程中,种皮和胚的表皮细胞变化不明显,仅胚乳表皮细胞变化明显。
2.3 种子形态休眠解除过程中亚微结构的方差分析
2.3.1气孔器亚微结构的方差分析
表1数据显示,在种胚生长过程中,气孔器密度以及气孔器指数均没有显著变化,仅气孔器长度、宽度以及叶绿体数量存在显著差异;其中气孔器长度、宽度变化无规律,气孔器多呈宽卵圆形或长椭圆形;而叶绿体数量随时间变化规律性递增,CK处理0-20 d与40-60 d、80-100 d存在显著差异,GA3:30 mg/L处理0-20 d与40 d、60-100 d存在显著差异。另外,GA3:30 mg/L处理60 d、CK处理80 d后叶绿体数量基本稳定,关于叶绿体在种子休眠中的作用尚不清楚。
2.3.2 表皮细胞亚微结构的方差分析
表2数据显示,裕民贝母种子解除形态休眠过程中,种皮和胚各部位的表皮细胞在长度和宽度上均无差异,虽然密度存在些许差异,但是这种差异并无规律可寻。胚发育过程中,胚乳表皮细胞宽度无差异;胚乳表皮细胞长度略有不同,主要是0 d和80 d的CK处理与其他时间段存在显著性差异;胚乳表皮细胞密度显著降低,种子经CK处理80 d或GA3:30 mg/L处理60 d后,胚乳表皮细胞数量约减少一半。

图8 裕民贝母种皮亚微结构的变化Fig. 8 Submicrostructure changes of seed coat in F. yuminensis注:A-CK;B-GA3 30 mg/L。Note: A-CK; B-GA3 30 mg/L.

图9 胚乳亚微结构的变化Fig. 9 Submicrostructure changes of endosperm in F. yuminensis注:A-CK;B-GA3 30 mg/L。Note: A-CK; B-GA3 30 mg/L.
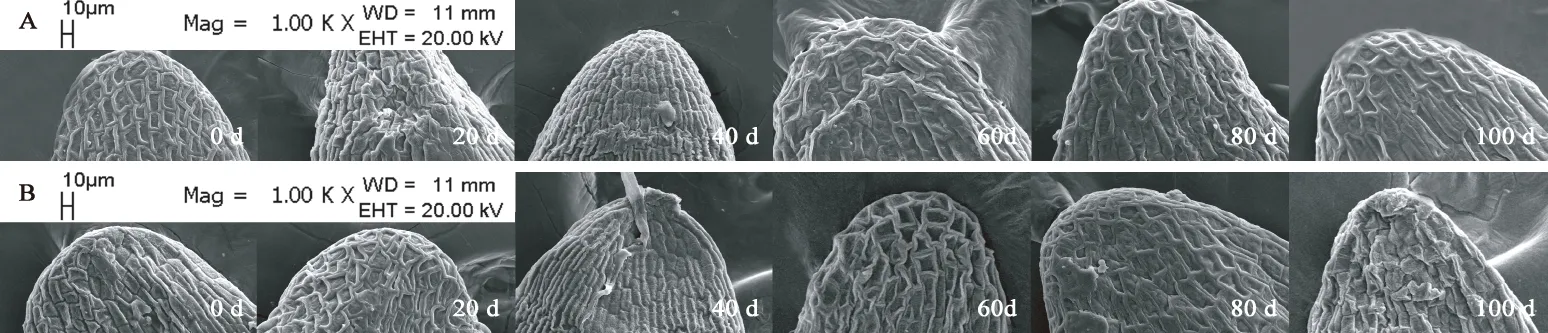
图10 胚顶部亚微结构的变化Fig. 10 Submicrostructure changes of top embryo in F. yuminensis注:A-CK;B-GA3 30 mg/L。Note: A-CK; B-GA3 30 mg/L.
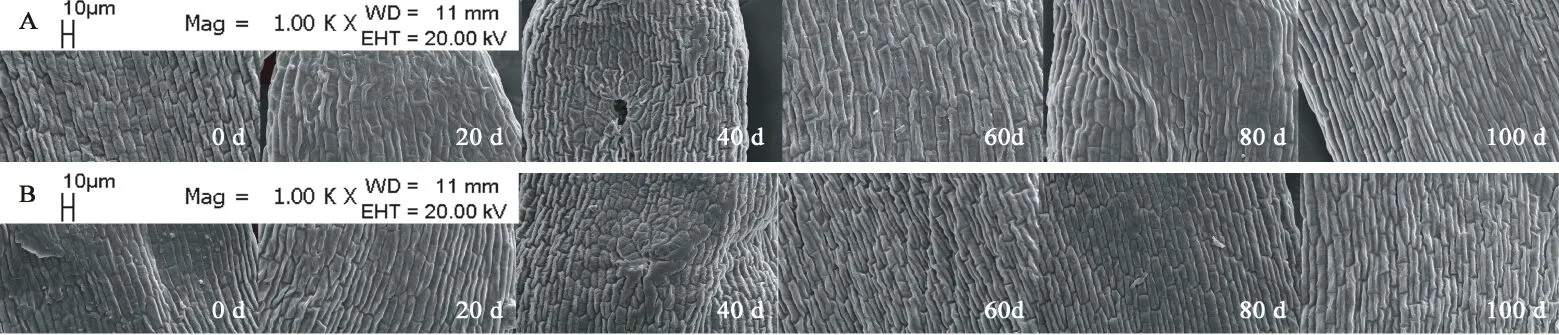
图11 胚中部亚微结构的变化Fig. 11 Submicrostructure changes of middle embryo in F. yuminensis注:A-CK;B-GA3 30 mg/L。Note: A-CK; B-GA3 30 mg/L.
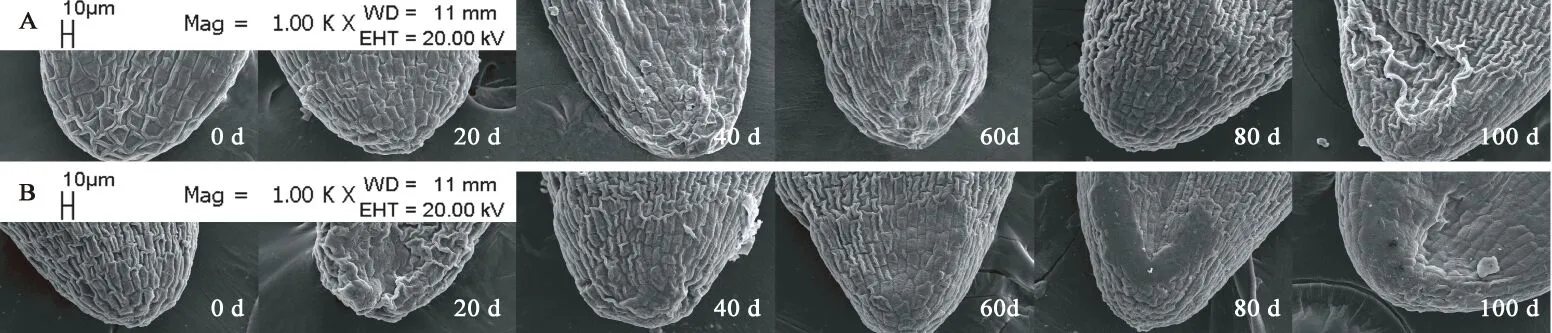
图12 胚基部亚微结构的变化Fig. 12 Submicrostructure changes of basic embryo in F. yuminensis注:A-CK;B-GA3 30 mg/L。Note: A-CK; B-GA3 30 mg/L.
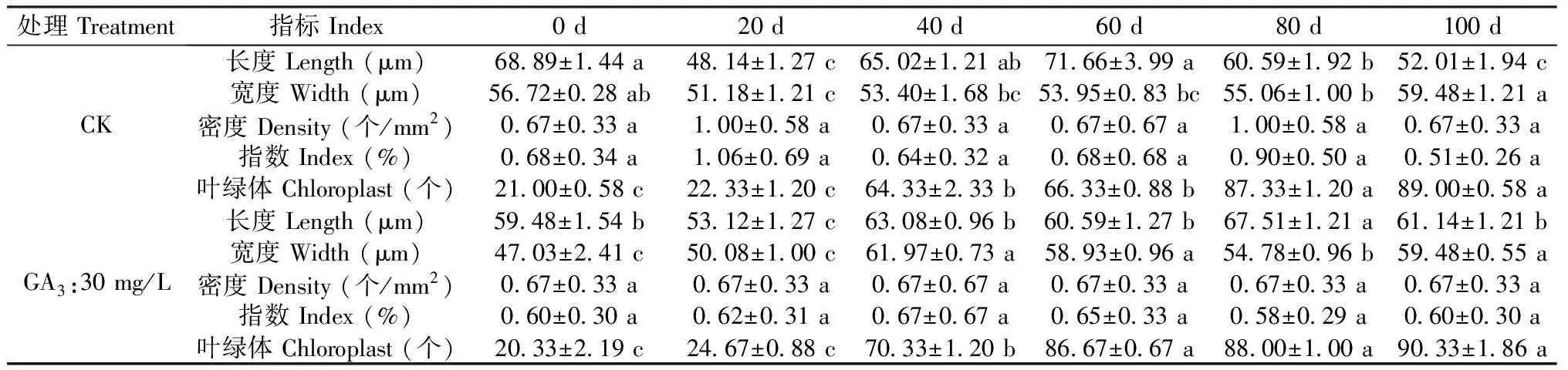
处理 Treatment指标 Index0 d20 d40 d60 d80 d100 dCK长度 Length (μm)68.89±1.44 a48.14±1.27 c65.02±1.21 ab71.66±3.99 a60.59±1.92 b52.01±1.94 c宽度 Width (μm)56.72±0.28 ab51.18±1.21 c53.40±1.68 bc53.95±0.83 bc55.06±1.00 b59.48±1.21 a密度 Density (个/mm2)0.67±0.33 a1.00±0.58 a0.67±0.33 a0.67±0.67 a1.00±0.58 a0.67±0.33 a指数 Index (%)0.68±0.34 a1.06±0.69 a0.64±0.32 a0.68±0.68 a0.90±0.50 a0.51±0.26 a叶绿体 Chloroplast (个)21.00±0.58 c22.33±1.20 c64.33±2.33 b66.33±0.88 b87.33±1.20 a89.00±0.58 aGA3:30 mg/L长度 Length (μm)59.48±1.54 b53.12±1.27 c63.08±0.96 b60.59±1.27 b67.51±1.21 a61.14±1.21 b宽度 Width (μm)47.03±2.41 c50.08±1.00 c61.97±0.73 a58.93±0.96 a54.78±0.96 b59.48±0.55 a密度 Density (个/mm2)0.67±0.33 a0.67±0.33 a0.67±0.67 a0.67±0.33 a0.67±0.33 a0.67±0.33 a指数 Index (%)0.60±0.30 a0.62±0.31 a0.67±0.67 a0.65±0.33 a0.58±0.29 a0.60±0.30 a叶绿体 Chloroplast (个)20.33±2.19 c24.67±0.88 c70.33±1.20 b86.67±0.67 a88.00±1.00 a90.33±1.86 a
注:每行标以不同小写字母代表5%水平差异显著。
Note: Each line with different lowercase letters represents significant difference at 5% level.

表2 裕民贝母表皮细胞亚微结构的方差分析
续表2

部位 Part时间 Time长度 Length (μm)CKGA3:30 mg/L宽度 Width (μm)CKGA3:30 mg/L密度 Density (个/mm2)CKGA3:30 mg/L胚中部Middle embryo0 d63.54±6.00 a53.40±2.00 a18.62±0.99 a19.90±1.55 a762.33±10.99 b816.00±17.04 ab20 d71.15±3.18 a65.58±2.74 a21.13±0.71 a18.39±1.01 a745.67±10.48 b800.67±6.69 ab40 d61.25±4.57 a55.20±2.37 a19.07±1.65 a19.71±1.09 a790.33±9.91 a834.67±8.88 a60 d69.52±2.15 a66.00±5.37 a21.22±0.67 a18.49±0.89 a739.00±8.50 b798.00±20.78 ab80 d64.23±3.35 a64.44±3.05 a22.53±3.01 a19.14±1.61 a745.33±5.04 b770.00±18.72 b100 d70.96±5.76 a65.42±6.11 a18.54±0.75 a18.60±1.04 a793.00±4.36 a815.67±10.41 ab胚基部Basic embryo0 d46.68±2.93 a59.94±1.40 a26.36±0.64 a23.47±1.99 a437.33±15.03 ab444.33±11.32 ab20 d49.24±1.52 a55.21±1.40 a24.73±1.01 a26.93±0.75 a440.33±10.27 ab417.00±3.46 b40 d51.05±1.61 a64.48±1.88 a26.03±2.28 a25.92±1.82 a442.33±12.77 ab442.00±8.08 ab60 d48.93±3.23 a55.21±1.47 a25.33±1.51 a25.07±2.26 a464.33±11.05 a431.33±11.46 ab80 d52.08±2.32 a58.96±6.56 a25.18±1.43 a23.67±0.85 a471.67±9.21 a444.67±4.67 ab100 d54.58±2.11 a65.34±2.80 a29.10±1.64 a27.82±1.45 a419.67±7.62 b449.33±10.41 a
注:每列标以不同小写字母代表5%水平差异显著。
Note: Each column with different lowercase letters represents significant difference at 5% level.
3 讨论
3.1种子形态结构与种子形态休眠的关系
裕民贝母种子由黄褐色种皮、透明状胚乳及点状原胚组成,胚率仅为22.33%,种子存在形态休眠。种皮是保护胚的第一道生物屏障[10],并能限制种子的最终大小[11]。裕民贝母种皮轻薄且无机械束缚,与胚乳结合紧密,不易剥离。Beeckman等[12]认为植物成熟种皮会经过珠被细胞分化、营养积累和色素沉淀等阶段,例如单子叶植物羊草[13]在种子成熟过程中种皮从浅绿色过渡为黄色最终呈现棕黑色。本试验结果显示裕民贝母黄褐色种皮随处理时间增长颜色加深至红褐色,可知种子刚采收时种皮未完全成熟,此后种子才逐渐发育完善。胚乳是多数单子叶植物种子的重要短命结构[14],内含丰富的淀粉粒,淀粉粒经水解成为可供幼胚吸收利用的简单营养物质。裕民贝母种子在形态破眠期间可观察到淀粉粒数量减少,可见胚乳在胚生长发育过程中扮演着重要角色。Blumenthal等[15]认为胚乳机械阻力是导致种子萌发受抑的重要因素。本研究发现裕民贝母胚乳细胞壁较厚,淀粉粒等内含物排列紧密,导致胚乳组织异常坚硬,胚根不易突破种皮进行正常萌发,但随处理时间的增加,胚乳械强度不断减弱从而变得柔软且干瘪,这种弱化现象有利于幼苗突破种皮,所以胚乳机械强度不是导致种子休眠的物理因素。Otegui和Staehelin[16]认为单子叶植物胚完善的标志表现为子叶仅一枚有效,并且胚芽、胚轴和胚根容易被辨别。刚获取的裕民贝母种胚结构不完善,分化程度极低,这与其生长环境寒冷、生命周期短暂有关,因为种子没有足够的时间供胚生长发育[17],因此胚发育不全是诱发种子形态休眠的关键因子。裕民贝母胚最终解除形态休眠时,仅分化出明显的子叶结构,后期还能观察到吸器和子叶联结,但无法从形态上区别胚芽、胚轴和胚根。裕民贝母种子整个形态破眠过程中,胚主要通过吸器汲取胚腔中的降解物进行生长,CK需80 d才能观察到胚基本充斥整个胚腔,胚率逐渐稳定,子叶联结泛绿,而GA3:30 mg/L仅需60 d,此外GA3:30 mg/L最终胚率高于CK,体现了外源GA3能诱导胚体加速生长的特点。种子始终无萌发迹象,还存在生理休眠现象,这一特性与百合科植物黄精[18]相似。
3.2种子亚微结构与种子形态休眠的关系
气孔器是植物气体交换、水分运输的重要通道,对碳水调控具重要意义,具气孔器的植物对生境变化表现出更强适应性[19]。裕民贝母生于灌木林下,由于光照不足导致光合作用减弱,为保证种子萌发前营养物质充足,种皮进化出数量少、结构独特、富含叶绿体的气孔器,这些气孔器随机分布于种翅附近。本研究显示裕民贝母种子刚采收时,种皮上的气孔器结构虽然完整,但是叶绿体含量较少,后期随种子形态破眠叶绿体数量激增,这有利于种子光合作用积累更多的营养物质,改善种子呼吸作用从而调节碳水平衡,减少种子蒸腾作用防止水分流失后种子失活。Stebbine和Khusk[20]指出进化植物的气孔器所含副卫细胞数量不超过两个,本研究显示裕民贝母气孔器无副卫细胞,这意味着该种是较进化的植物。种皮表面纹饰与生活力、吸水性及萌发率密切相关[21],小种子植物具复杂种皮纹饰是进化的标志[10],复杂种皮纹饰利于种子吸收水分加快萌发进程。裕民贝母种皮的表皮细胞较大,网脊明显,网眼突出,且网底具精细网状结构,种皮表面纹饰属于复杂型,进一步证明该种是进化植物。另外,Wilkinson[22]认为深波状垂周壁表皮细胞为进化植物,而裕民贝母种皮则为此类型,再次证实该种非原始植物。进化植物通常采取种子休眠策略来适应环境变更[23],因此推断裕民贝母种子具休眠特性是为了积极响应种子传播扩散和种群繁衍的重大使命。裕民贝母种子破除形态休眠时,种皮表面始终呈网状结构,两处理的表皮细胞长度、宽度差异不显著,此外GA3:30 mg/L的表皮细胞密度也无差异,但是CK的表皮细胞密度有所变化。胚乳细胞最先经过平周分裂形成具保护作用的表皮细胞[24],其后才逐渐分化出其它功能细胞,简单的长矩形皮层细胞构成了裕民贝母胚乳条纹状表面纹饰。在种子形态休眠解除期间,胚乳内外细胞受内含物降解影响受力不均,导致胚乳表皮局部断裂,因此胚乳表皮细胞数目严重锐减,两处理的胚乳表皮细胞密度发生变化。裕民贝母胚中部的表皮细胞为长矩形,延伸至两端时会慢慢过渡为四边形或多边形,网眼存在凹陷或凸出两种状态,不同状态可能与吸水程度或生长趋势有关,两处理随时间推移胚各部位的表皮细胞在尺寸方面差异不显著,仅表皮细胞密度存在些许变化。CK处理80 d后叶绿体数量增至恒定,胚乳表皮细胞数量约减少一半,GA3:30 mg/L仅需60 d,反映出外源GA3可以刺激叶绿体生成并加速胚乳水解。
4结论
分析裕民贝母种子形态结构及亚微结构可知,种皮颜色加深、胚率恒定、子叶发绿、叶绿体数量恒定、胚乳表皮细胞数量约减少一半是判定种子形态休眠解除的重要依据。种子形态休眠自然解除需80 d,而GA3:30 mg/L可将时间缩短20 d,表明外源GA3能促进种子的形态建成。种皮作为种子形态休眠破除的重要标志,体现在色素沉着度以及气孔器中叶绿体完善度两方面。随时间推移种皮变深,气孔器中的叶绿体数量升至恒定,种皮日渐发育成熟。胚发育不全是诱发种子形态休眠的主要原因,表现在胚结构不完整且分化程度低。随种子形态休眠解除,胚变长加粗,胚率日趋稳定,子叶分化出明显的吸器和子叶联结,胚芽、胚根以及胚轴呈短缩状态。胚乳作为解除种子形态休眠的启动因子,通过水解相关内含物为胚的生长提供营养。胚乳随时间变化淀粉粒数量减少,机械强度减弱,表皮细胞数量锐减,表皮破损严重。
