肺炎克雷伯菌产CTX-M-14型超广谱β-内酰胺酶的基因环境研究
2019-11-05刘保光汪保英栗俞程苗明三许二平
刘保光,汪保英,栗俞程,白 明,苗明三,许二平
肺炎克雷伯菌作为一种人兽共患条件病原菌,可引起人和多种动物感染,危害人和畜禽健康[1]。近年来,随着抗菌药物的广泛应用,肺炎克雷伯菌对抗生素的耐药情况日趋严重,携带β-内酰胺酶是该菌产生耐药的主要机制之一[2]。ESBLs主要由肠杆菌科细菌产生,肺炎克雷伯菌和大肠杆菌是其代表菌种[3]。而CTX-M型酶分布广泛,是一组逐渐被认识且成员日益庞大的ESBLs,以对头孢噻肟高水平耐药为主要特征[4]。该酶目前已经成为亚洲国家如日本、韩国主要的ESBLs类型,我国也是CTX-M型酶的高发区,有研究表明,CTX-M型ESBLs可能是我国华南地区,乃至全国常见的ESBLs类型之一[5]。其中,华北地区流行的CTX-M型ESBLs主要为CTX-M-14型[6]。据报道,CTX-M型ESBLs编码基因常位于质粒上,该质粒大多可以接合,还常与周围可移动基因元件(如插入序列ISEcp1或IS903、转座子)相关[7-8]。研究发现,位于CTX-M基因周围的可移动元件对耐药基因的传播起重要作用[9-10]。
目前,肺炎克雷伯菌耐药表型和分子分型报道较为多见[11-16],但肺炎克雷伯菌产CTX-M型β-内酰胺酶报道鲜见[17-19]。本试验在前期研究基础上,开展产CTX-M-14型ESBL基因的遗传背景研究,这对控制该型ESBLs的传播具有重要意义。
1 材料与方法
1.1 材 料
1.1.1菌株来源 郑州某鸡场分离、经过VITEK-32全自动鉴定仪证实、基因型鉴定的一株产CTX-M-14型ESBL肺炎克雷伯菌(耐药表型及基因型鉴定另文发表[20],标号为F1),E.coliC600受体菌由河南省人民医院检验科惠赠。质控菌株为大肠埃希菌ATCC25922(购自中国普通微生物菌种保存中心,阴性对照菌);肺炎克雷伯菌ATCC700603(购自北京大学医学部,阳性对照菌)。
1.1.2培养基 LB琼脂、LB肉汤购自广东环凯微生物科技公司。
1.1.3药物 试验用抗生素为标准品或对照品,均购自中国兽医药品监察所,均在有效期内。
1.1.4试剂 普通质粒小提试剂盒(TIANGEN,北京),PBR322载体、Taq酶等购自大连宝生物公司。
1.1.5仪器 Vitek-32全自动细菌鉴定仪购自法国生物-梅里埃公司,凝胶成象系统购自Alpha Innotech Corporation,PCR扩增仪购自美国Thermocycler2720。
1.2 方 法
1.2.1CTX-M-14型ESBL基因的质粒接合传递试验
1.2.1.1供体菌(标号F1)与受体菌(E.coliC600)接合 用LB平板分离培养F1菌株和E.coliC600(受体菌对利福平耐药),37 ℃过夜培养,挑培养的供体菌和受体菌的单菌落分别接种入5 mL的LB肉汤中,37 ℃过夜培养,取培养的供体菌和受体菌各50 μL同时加到5 mL LB肉汤中混匀,37 ℃过夜培养。
1.2.1.2阳性接合子的筛选与确认 1)取100 μL接合菌液(剩余菌液4 ℃保存)及只含受体菌、供体菌的对照菌液分别接种于LB平板(含160 μg/mL利福平和20 μg/mL头孢噻肟),37 ℃过夜培养;2)接合菌液在利福平和头孢噻肟上述浓度耐受的平板上能生长,生长的菌落即为阳性接合子;而对照菌液在利福平和头孢噻肟上述浓度耐受的平板上不生长。
1.2.1.3阳性接合子的的MIC值检测 根据美国临床实验室标准化协会(CLSI)推荐的微量肉汤稀释法[21],分别测定阿莫西林(AMX)等20种药物对接合子及E.coliC600的最小抑菌浓度(MIC)。
1.2.1.4阳性接合子的PCR检测 对筛选出的阳性接合子进行质粒抽提,分别用以下blaCTX-M、blaTEM、blaSHV及blaACT特异性引物,PCR反应体系和条件参考文献[20],PCR扩增后分别取8 μL产物进行1%琼脂糖电泳,凝胶成像观察结果。
1.2.2 CTX-M-14型ESBL的基因环境
1.2.2.1接合子质粒双酶切 对筛选出的含有CTX-M-14基因的阳性接合子用质粒小提试剂盒进行抽提,经0.8%琼脂糖电泳(溴化乙锭染色),紫外投射仪下观察结果,确认接合子质粒存在后用BamHI和SalI双酶切。双酶切反应体积为25 μL,反应体系为接合子质粒7 μL,水8 μL,10×Buffer 4 μL,BamHI 3 μL,SalI 3 μL,混匀并离心,37 ℃水浴酶切3~4 h,经0.6%琼脂糖电泳(溴化乙锭染色),用凝胶成像摄相。
1.2.2.2PBR322克隆载体双酶切 PBR322载体用BamH I和SalI2个限制性内切酶进行双酶切。双酶切反应体积为25 μL,反应体系为载体质粒8 μL,水7 μL,10×Buffer 4 μL,BamH I 3 μL,SalI 3 μL,混匀并离心,37 ℃水浴酶切3~4 h,获得载体质粒酶切片段,经0.6%琼脂糖凝胶电泳,紫外投射仪下观察结果并摄相。
1.2.2.3连接转化 酶切后的接合子质粒片段与酶切后的PBR322载体连接,体系为:接合子质粒片段6 μL,PBR322载体2 μL,10×Buffer 1 μL,T4 DNA连接酶1 μL,16 ℃连接过夜。将连接产物转入大肠杆菌DH5α感受态细胞中然后涂于含头孢噻肟钠(20 μg/mL)、氨苄西林(50 μg/mL) 及各含42 μL X-gal、IPTG及的LB固体培养板上过夜培养筛选。
1.2.2.4阳性转化子的筛选及双酶切鉴定 无菌条件下,用牙签挑取白色的单个菌落(即阳性转化子)接种于相应的培养基,经培养,再次抽提重组质粒,所提质粒用BamH I和SalI进行双酶切鉴定,酶切产物经0.6%琼脂糖凝胶电泳(溴化乙锭染色),紫外投射仪下观察结果并摄相。
1.2.2.5阳性转化子的MIC值检测 根据CLSI推荐的方法[21],分别测定阿莫西林(AMX)等20种药物对阳性转化子的最小抑菌浓度(MIC)。
1.2.2.6核苷酸序列测定与分析 接合子质粒经转化克隆及鉴定后得到转化子,培养后其菌液送大连宝生物公司用M13通用引物Primer Walking测序(包括CTX-M-14基因,并向其上下游连续测序),把测的3段基因序列拼为一段完整序列,结果用BioXM 2.6软件分析,并在NCBI数据库中用BLAST工具进行同源序列比较。
1.2.2.7CTX-M-14型基因上下游分析 根据测序结果,分析CTX-M-14基因的上游序列及下游序列,对比CTX-M-14基因片段与原菌株测序结果有无差异。
2 结 果
2.1质粒接合传递试验结果 接合子PCR扩增显示,blaCTX-M及blaTEM基因呈现阳性,结果见图1,而受体菌表现为阴性,说明blaCTX-M及blaTEM基因能通过接合试验传递;用blaACT型特异性引物扩增接合菌表现为阴性,说明该基因不能与blaCTX-M及blaTEM等基因同时被接合。
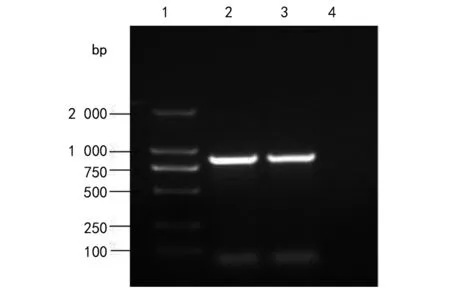
注: 1为Marker 2000; 2为TEM型PCR产物; 3为CTX-M型PCR产物; 4为阴性对照。图1 接合菌PCR产物凝胶电泳 Fig.1 Gel electrophoresis of the zygomycetes PCR products
2.2接合子质粒及PBR322载体双酶切结果 阳性接合子及PBR322克隆载体抽提质粒后用BamH I和SalI双酶切获得相应的质粒酶切片段,酶切后结果如图2。

注: 1为Marker 19329; 2为接合子质粒双酶切图; 3为PBR322载体双酶切图。图2 接合子质粒及PBR322载体质粒双酶切电泳图Fig.2 Electrophoresis picture of the conjugal and PBR322 plasmids digested by two restriction enzymes
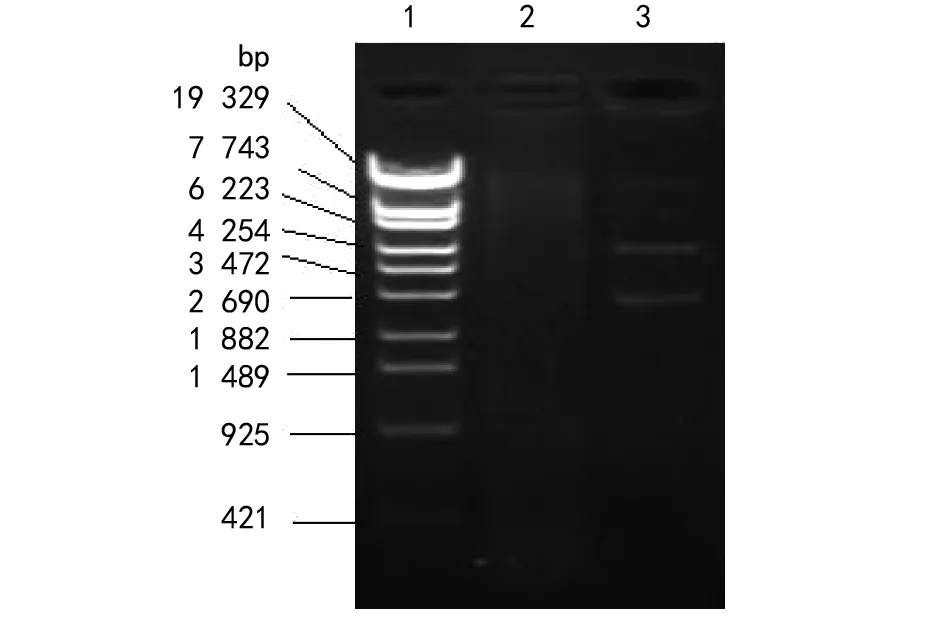
注: 1为Marker 19329; 2为阴性对照; 3为阳性转化子双酶切图。图3 阳性转化子双酶切电泳图Fig.3 Electrophoresis picture of the transformant plasmids digested by two restriction enzymes
2.3阳性转化子双酶切鉴定结果 筛选的阳性转化子抽提重组质粒用BamH I和SalI进行双酶切鉴定,结果见图3。
2.4耐药表型的测定结果 通过测定供体菌、含CTX-M-14基因片段的阳性接合子及筛选的阳性转化子对阿莫西林、阿莫西林+克拉维酸、头孢噻肟、环丙沙星及阿米卡星等药物的耐药表型,分析各菌株对各种药物的敏感性,见表1。供体菌对利福平敏感,而接合子对利福平耐药,原因在于接合子具有受体菌对利福平耐药的特性。接合子的其余耐药表型与供体菌保持一致,具有供体菌相似的耐药表型。在含头孢噻肟平板上筛选的含CTX-M-14基因片段的阳性转化子对头孢噻肟耐药,而对其余的大多数药物表现敏感。
表1 供体菌、阳性接合子及转化子对多种抗菌药物的敏感性
Tab.1 Susceptibility of the various types of strains to varieties of antimicrobial agents

抗菌药物MIC/(μg/mL)F1C600F1阳性接合子含CTX-M-14基因的转化子阿莫西林AMX>1284>128128 阿莫西林/克拉拉酸(4:1)无412832氨苄西林AM>1288>128128氨苄西林+舒巴坦AM/SU(2:1)12883232头孢噻肟钠CTX64<0.06256464头孢曲松CRO64<0.062564<0.0625头孢噻呋CTF16无无0.5亚胺培南IMI<0.0625无无无头孢吡肟CPM1无无无粘菌素COM<0.06250.1250.25<0.0625恩诺沙星ENF16无无无环丙沙星CIP16132<0.0625左氟沙星LVF32116<0.0625氟苯尼考FLO321640.5多西环素DOX320.25321阿米卡星 AK640.5128<0.0625磷霉素FOS>1282>128<0.0625新霉素NEO320.1250.5<0.0625庆大霉素GM1280.25128无利福平 RIF8>1281284
2.5转化子核苷酸序列测定结果 经测序,通过DNASTAR软件把所得CTX-M-14及其上下游序列进行拼接,拼接出2 637 bp的基因序列,将序列在NCBI数据库进行Blast比对,包含上游序列ISEcp1、下游序列IS903及完整的CTX-M-14基因开放阅读框等移动元件,序列号为HQ650134,其基因序列如图4。
2.6含CTX-M-14型ESBL的基因上下游分析 测序结果经比对,测出2 637 bp的基因序列,其中包括上游序列ISEcp1tnpA、-35区和-10区、重复序列IRR、876 bp的CTX-M-14基因开放阅读框及下游序列IS903和IRL,见图5。
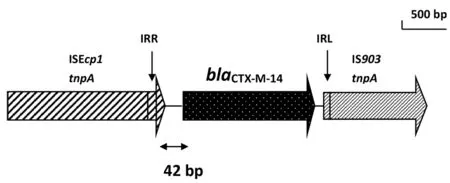
图5 CTX-M-14型ESBL基因的基因环境结构图Fig.5 Genetic environment structure picture of CTX-M-14 gene β-lactamase

Sbjct 1TTATCAGCTTTTATGACTCGATATATGGTAAAATAATAGTAAGAAAAGTAGTAAAAAGGG60Sbjct 61GTTCTAATTATGATTAATAAAATTGATTTCAAAGCTACGAATCTAACATCAAATGCAGGT120→ISEcp1(70-1332 bp)Sbjct 121………………………………………………………………………………………………………………1320Sbjct 1321TGTCTGGTATAATAAGAATATCATCAATAAAATTGAGTGTTGCTCTGTGGATAACTTGCA1380ISEcp1←Sbjct 1381GAGTTTATTAAGTATCATTGCAGCAAAGATGAAATCAATGATTTATCAAAAATGATTGAA1440-35区Sbjct 1441AGGTGGTTGTAAATAATGTTACAATGTGTGAGAAGCAGTCTAAATTCTTCGTGAAATAGT1500-10区Sbjct 1501GATATTTGAAGCTAATAAAAAACACACGTGGAATTTAGGGAATACTGATGTAACACGGAT1560IRRSbjct 1561TGACCGTATTGGGAGTTTGAGATGGTGACAAAGAGAGTGCAACGGATGATGTTCGCGGCG1620→blaCTX-M-14 ORF(876 bp)Sbjct 1621………………………………………………………………………………………………………………2400Sbjct 2401GAGAGCCGCCGCGATGTGCTGGCTTCAGCGGCGAGAATCATCGCCGAAGGGCTGTAACTG2460blaCTX-M-14 ORF←→IS903Sbjct 2461GTTTTGTTGAATAAATCGAACTTTTGCTGAGTTGAAGGATCAGATCACGTATCTTCCCGA2520 IRLSbjct 2521CAACGCAGACCGTTCCGTGGCAAAGCAATAGTTCAAAATCACCAACTGGCCCACCTACAA2580Sbjct 2581TAAAGCCCTCATCAAGCGTGGCTCCATAACTTTCTGGCTGGATGATGAAGCTATTCA ?2637IS903(2460->2637 bp)←
图4 基因序列
Fig.4 Gene sequence
3 讨 论
据报道,肺炎克雷伯菌容易把耐药质粒转移给大肠埃希菌C600,表明介导质粒的转移在不同种属的细菌之间具有一定的通用性[22]。据报道,携带CTX-M-14基因的质粒大多含有多重耐药基因,表现出对多种抗生素的耐药特征,具有更多的传播机会[20]。本研究发现供体菌同时含CTX-M-14、SHV-11、TEM-1及ACT-like等基因,但质粒接合试验及接合菌PCR扩增表明这些基因并不同时存在1个质粒上。该试验中CTX-M和TEM基因可以通过质粒在细菌间转移,但是ACT基因不能和CTX-M及TEM基因同时转移,这说明ACT基因可能存在于不同质粒或转座子上,有些质粒能通过质粒接合试验进行转移,有些质粒不能进行转移,说明这些细菌的耐药基因存在于不可转移的质粒上,细菌之间可以通过质粒接合传递耐药基因及耐药性,这是导致细菌产生多重耐药的重要原因之一。
药物敏感性试验表明,供体菌对青霉素类、三代头孢菌素类、氨基糖苷类及阿米卡星均耐药,而只对碳青酶烯类的亚胺培南和四代头孢菌素类头孢吡肟表现敏感,这体现了ESBLs和AmpC酶结合的效果,这与管希周等[23]研究报道一致。供体菌还表现对利福平敏感,而接合子对利福平耐药,原因在于接合子具有受体菌对利福平耐药的特性。接合子的其余耐药表型与供体菌基本一致,具有与供体菌相似的耐药表型,仅有个别药物的MIC值较供体菌降低。另外,具有临床意义的是供体菌把对三代头孢菌素的耐药性,转移给了受体菌E.coliC600,预示耐药性的横向传播以及暴发流行的可能。含CTX-M-14基因的阳性转化子对头孢噻肟耐药,而对其余的大多数药物表现敏感,这与朱恒乾等[24]报道一致。本试验中,接合子均具有ESBLs的表型,这显示该接合子在产生TEM型基因的同时一定产生其它类型的ESBLs(如SHV型、CTX-M型等),因为受体菌E.coliC600本身不存在对β-内酰胺类耐药的其它机制。另外,该接合子PCR检测结果也支持了这点。接合子中的TEM型和CTX-M型基因是由产ESBLs供体菌通过接合传递而来,揭示临床菌株通过接合试验在编码ESBLs基因的水平传播,导致了ESBLs菌株的流行。因此,临床应加强细菌耐药性监测、深入研究其耐药机制,对于减缓耐药性的产生和传播具有重要意义。
本研究发现,在blaCTX-M-14基因的上游存在插入序列ISEcp1,据有关研究,该插入序列已在肺炎克雷伯菌、变形菌和沙门菌等多种肠杆菌科细菌中发现[25]。Eckert等[26]发现,产blaCTX-M-14基因的上游均存在插入序列ISEcp1,同时其余CTX-M型ESBLs基因的上游也大多发现插入序列ISEcp1。本研究还发现,在blaCTX-M-14基因的下游存在插入序列IS903,在blaCTX-M-14基因的上游和下游均存在反向重复序列IRR和IRL,且在blaCTX-M-14基因的上游与反向重复序列IRR间有42 bp的间隔,在blaCTX-M-14基因下游的反向重复序列IRL中发现了公认的启动元件-35区,推测可能是对其下游基因表达的一种机制。Eckert等[26]发现,5株产blaCTX-M-14基因的下游有4株显示存在插入序列IS903。据Diestra等[27]发现,含blaCTX-M-14基因的周围环境区域高度保守,发现blaCTX-M-14基因的上下游分别出现插入序列ISEcp1和IS903。据Lartigue等[28]报道,在blaCTX-M-14基因的上下游也分别出现ISEcp1和IS903,但在blaCTX-M-14基因的上游与反向重复序列IRR间有43 bp的间隔,这与本研究发现的42 bp间隔有差异。可见,ISEcpl和IS903在blaCTX-M-14基因的传播中具有重要作用,除了能介导blaCTX-M-14基因从染色体转移到质粒外,也可使blaCTX-M-14基因在不同的质粒之间进行传播。
利益冲突:无
