PP2对C6神经胶质瘤细胞增殖和迁移的影响
2019-09-10唐宁宁杨艳艳张杰刘少燕于涛
唐宁宁 杨艳艳 张杰 刘少燕 于涛


[摘要]目的探究PP2对C6神经胶质瘤细胞增殖和迁移的影响及其机制。方法根据处理情况将C6神经胶质瘤细胞分为空白对照组、50 μg/L成纤维细胞生长因子2(FGF2)处理组(简称FGF2处理组)、50 μg/L FGF2和0.02 mol/L PP2共处理组(简称共处理组)。采用Transwell小室和EdU实验检测PP2对C6神经胶质瘤细胞增殖和迁移的影响,采用蛋白质印迹方法检测酪氨酸蛋白激酶(Src)通路相关蛋白及核蛋白的表达。结果不同浓度PP2处理均可抑制C6神经胶质瘤细胞的存活(F=10.25~56.18,P<0.05、0.01)。与FGF2处理组相比,共处理组细胞增殖率明显降低(F=32.23,P<0.01),细胞迁移数量显著减少(F=22.15,P<0.01)。共处理组磷酸化成纤维细胞生长因子受体1(FGFR1)表达水平较FGF2处理组明显降低,差异有统计学意义(F=20.21,P<0.01)。在相同处理时间,FGF2处理组Src通路相关蛋白及核蛋白表达水平与共处理组比较差异均有显著性(F=10.17~278.11,P<0.05、0.01)。结论PP2可通过靶向FGFR1和Src发挥抗肿瘤作用,这可能为研发神经胶质瘤的新型治疗药物提供一个新思路。
[关键词]神经胶质瘤;蛋白酪氨酸激酶类;受体,成纤维细胞生长因子;细胞增殖;细胞运动
[中图分类号]R730.264;R329.25[文献标志码]A[文章编号] 2096-5532(2019)04-0383-05
[ABSTRACT]ObjectiveTo explore the effect of PP2 on the proliferation and migration of C6 glioma cells and its mechanism. MethodsAccording to the treatment, C6 glioma cells were divided into blank control group, 50 g/L fibroblast growth factor 2 (FGF2) treatment group (FGF2 treatment group for short) and 50 g/L FGF2 with 0.02 mol/L PP2 co-treatment group (co-treatment group for short). Transwell chamber assay and EdU assay were used to evaluate the effect of PP2 on the proliferation and migration of C6 glioma cells. Western blotting was used to measure the expression levels of proteins involved in the tyrosine protein kinase (Src) pathway and nucleoproteins. ResultsPP2 treatment at different concentrations inhibited the survival of C6 glioma cells (F=10.25-56.18,P<0.05,0.01). Compared with the FGF2 treatment group, the co-treatment group showed a significant decrease in cell proliferation rate (F=32.23,P<0.01) and a significant decrease in the number of migrating cells (F=22.15,P<0.01). The expression level of phosphorylated fibroblast factor receptor 1 (FGFR1) was significantly lower in the co-treatment group than in the FGF2 treatment group (F=20.21,P<0.01). During the same treatment time, the expression levels of Src pathway-related proteins and nucleoproteins were significantly different between the FGF2 treatment group and the co-treatment group (F=10.17-278.11,P<0.05,0.01). ConclusionPP2 can exert an anti-tumor effect by targeting FGFR1 and Src, which may provide a new idea for the development of novel therapeutic drugs for glioma.
[KEY WORDS]glioma; protein-tyrosine kinases; receptor, fibroblast growth factor; cell proliferation; cell movement
神經胶质瘤是大脑中最常见的原发性肿瘤,占所有恶性脑肿瘤的80%[1]。目前,综合疗法已被广泛用于治疗神经胶质瘤,但是疗效不佳,病人存活率较低,所以需要进一步探究神经胶质瘤发生和发展的调节机制,寻找潜在的治疗靶点。有文献报道,成纤维细胞生长因子受体1(FGFR1)在神经胶质瘤细胞中高表达,而且FGFR1 是酪氨酸蛋白激酶(Src)的上游调节因子,可以激活Src通路[2]。PP2是Src家族激酶信号通路的抑制剂,可以通过调节不同类型细胞的迁移和增殖来调节各种疾病[3-5]。然而,PP2在神经胶质瘤细胞中的作用尚不清楚。本研究旨在探讨PP2对C6神经胶质瘤细胞增殖和迁移的影响及其分子机制。
1材料和方法
1.1主要材料
PP2购自美国Selleckchem公司;成纤维细胞生长因子2(FGF2)购自美国Peprotech公司;胎牛血清(FBS)购自美国ExCell Bio公司;DMEM培养液购自美国Gibco公司;EdU试剂盒购自美国RiboBio公司;Transwell小室购自BD Biosciences公司;MTT试剂盒购自Sigma公司;RIPA缓冲液购自北京索莱宝公司;磷酸化Src(p-Src)、FGFR1、磷酸化FGFR1(p-FGFR1)、P65、c-jun、磷酸化蛋白激酶B(p-AKT)、磷酸化细胞外调节激酶(p-ERK)、磷酸化信号转导和转录激活因子1(p-STAT1)一抗及二抗购自美国Cell Signaling Technology公司。
1.2细胞培养
C6大鼠神经胶质瘤细胞购上海中国科学院细胞库,用含体积分数0.10 BSA的DMEM培养液在培养箱(37 ℃,含体积分数0.05 CO2)中培养。
1.3细胞存活率测定
将C6神经胶质瘤细胞以每孔108/L的密度接种于96孔板,37 ℃培养12 h后,分别用0、0.002 5、0.005 0、0.010 0、0.030 0、0.040 0 mol/L的PP2进行处理(均设3个平行复孔)。分别在孵育48、72和96 h时,按MTT試剂盒说明书,使用酶标仪(Biohit,Helsinki,Finland)在595 nm波长处检测吸光度(A)值。实验重复3次。
1.4EdU实验检测细胞增殖
将C6神经胶质瘤细胞以每孔108/L的密度接种于96孔板,37 ℃培养12 h。将细胞分为空白对照组(A组)、50 μg/L FGF2处理组(简称FGF2处理组,B组)、50 μg/L FGF2和0.02 mol/L PP2共处理组(简称共处理组,C组),并进行相应处理。处理24 h后,根据EdU试剂盒说明书对细胞进行染色,使用荧光显微镜(Zeiss,LSM510,META)拍照并用图像处理工具ImageJ v1.8.0分析数据。实验重复3次。
1.5Transwell小室实验检测细胞迁移
将200 μL含有2.5×108/L细胞的无血清细胞悬液接种于Transwell小室的上室,下室加500 μL 含体积分数0.10 FBS的DMEM培养液。将细胞按1.4所述进行分组并处理。处理后24 h,弃上清,用磷酸盐缓冲液湿润的棉棒轻轻擦去残留在膜上侧的细胞。然后用40 g/L多聚甲醛固定细胞30 min,在室温下用1 g/L结晶紫染色30 min。使用荧光显微镜(Zeiss,LSM510,META)拍照,选择5个随机区域来计数细胞。实验重复3次。
1.6蛋白质印迹方法检测Src通路相关蛋白表达
取含有108/L C6神经胶质瘤细胞的细胞悬液2 mL接种于6孔板中,将细胞按1.4所述进行分组并处理,在处理后5、10、20、30、60 min时快速收集细胞。将收集的细胞沉淀置于含有0.1 mmo/L苯基甲基磺酰氟和10 g/L蛋白酶抑制剂混合物的RIPA缓冲液中,在冰上裂解10 min,4 ℃温度下以12 000 r/min离心15 min。采用蛋白质印迹方法[6]检测FGFR1、p-FGFR1、p-Src、p-Akt、p-ERK和p-STAT1蛋白的表达水平。实验重复3次。
1.7蛋白质印迹方法检测核蛋白表达
将神经胶质瘤细胞按照1.4所述进行分组并处理,快速收集细胞,将其重悬于300 μL细胞裂解缓冲液中,在冰上裂解30 min,4 ℃下以1 000 r/min离心20 min。将收集的细胞沉淀重悬于200 μL核裂解缓冲液中,在冰上裂解30 min(每5 min振荡1次)。4 ℃下以12 000 r/min离心10 min,所得上清即为核蛋白。采用蛋白质印迹方法[6]检测核蛋白P65、c-jun的表达水平。实验重复3次。
1.8统计学处理
使用GraphPad Prism 5软件进行统计学处理,计量资料数据以±s表示,多组比较采用one way ANOVA检验,组间两两比较采用t检验。以P<0.05为差异有统计学意义。
2结果
2.1PP2对神经胶质瘤细胞存活率的影响
在相同处理时间,C6神经胶质瘤细胞存活率随着PP2浓度的升高而降低;相同浓度 PP2处理,C6神经胶质瘤细胞存活率随着处理时间延长而降低,差异均有统计学意义(F=10.25~56.18,P<0.05、0.01)。见图1。
2.2PP2对神经胶质瘤细胞增殖的影响
EdU实验结果显示,FGF2处理组细胞增殖率较空白对照组明显增加,而共处理组细胞增殖率较FGF2处理组明显降低,差异具有统计学意义(F=32.23,P<0.01)。见表1。
2.3PP2对神经胶质瘤细胞迁移的影响
Transwell实验结果显示,FGF2处理组细胞迁移数量较空白对照组明显增加,而共处理组细胞迁移数量较FGF2处理组明显降低,差异具有统计学意义(F=22.15,P<0.01)。见表1。
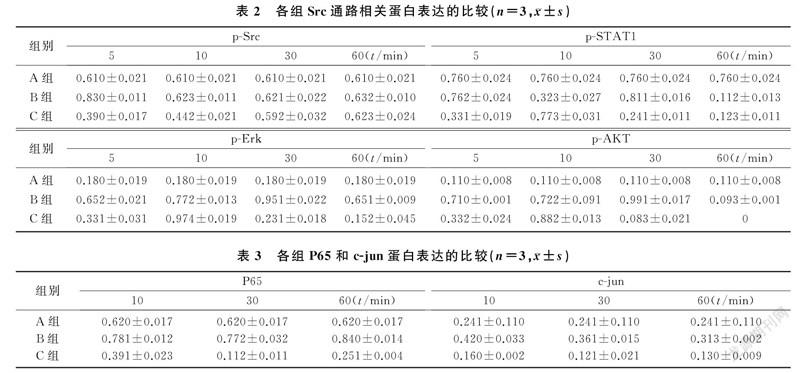
2.4PP2对神经胶质瘤细胞中Src通路相关蛋白表达的影响
空白对照组、FGF2处理组和共处理组细胞p-FGFR1/FGFR1分别为0、0.632±0.029和0.133±0.015,FGF2处理组较空白对照组明显升高,而共处理组较FGF2处理组明显降低,差异具有统计学意义(F=20.21,P<0.05)。在药物处理5 min时,共处理组p-Src、p-AKT、p-ERK和p-STAT1蛋白表达水平较FGF2处理组均降低;药物处理10 min时,共处理组p-AKT、p-ERK和p-STAT1蛋白表达水平较FGF2处理组升高;药物处理30、60 min时,共处理组p-AKT、p-ERK和p-STAT1蛋白表达水平较FGF2处理组降低,差异均具有显著性(F=15.33~156.38,P<0.05、0.01)。见表2。
2.5PP2对神经胶质瘤细胞中核蛋白表达的影响
在相同处理时间,与FGF2处理组相比,共处理组细胞P65和c-jun蛋白表达水平降低,差异具有显著意义(F=10.17~278.11,P<0.05、0.01)。在不同处理时间中,以药物处理60 min时FGF2处理组与共处理组P65和c-jun蛋白表达水平差异最明显。见表3。
3讨论
神经胶质瘤没有明显的边界,难以完整手术切除。化疗和放疗对神经胶质瘤细胞的特异性低而且具有许多副作用和明显的毒性反应,治疗效果较差。但目前化疗仍是最常用的治疗方法[1,7]。传统抗癌药物(如替莫唑胺、洛莫司汀和替尼泊苷)存在很多缺点,如选择性差、副作用严重、血-脑脊液屏障穿越等[8-9]。因此,神经胶质瘤的治疗迫切需要基于分子生物学和基因疗法的新型治疗策略。
文献报道,FGFRs属于跨膜受体酪氨酸蛋白激酶,包括FGFR1、FGFR2、FGFR3和FGFR4[10]。其中,FGFR1是αFGF、βFGF和FGF5的高亲和力受体[11]。FGFs/FGFRs的异常诱导和持续活化可导致神经胶质瘤等多种肿瘤的发生[9,12-13]。有研究表明,FGFR1在C6神经胶质瘤细胞中高表达[2]。在病理状态下神经胶质瘤细胞FGFR1的磷酸化水平较高,FGF2刺激也可以使C6神经胶质瘤细胞中p-FGFR1水平升高[3,14]。因此,本研究用50 μg/LFGF2刺激C6神經胶质瘤细胞模拟病理条件。作为受体酪氨酸激酶,FGFR1包含细胞外配体结合结构域、单个跨膜区和蛋白酪氨酸激酶核。FGFR1与配体结合后其酪氨酸残基会快速自磷酸化,活化的蛋白激酶和转录因子进入细胞核会调节细胞周期和细胞转化,从而促进细胞增殖[15]。同时,FGFR1还是Src蛋白的上游调节因子,可以激活Src通路,故抑制FGFR1磷酸化可以阻止Src活化。而激活的Src可以调节多条信号途径,包括丝裂原活化蛋白激酶、PI3K/Akt、STAT和PLC途径[15-17]。本研究结果表明,PP2可显著影响Src信号通路相关蛋白(包括p-ERK、p-AKT和p-STAT1)的表达,且Src通路相关蛋白的磷酸化水平随着PP2作用时间的延长而发生变化,这符合信号通路调控的时间规律。有研究表明,FGF2刺激后,一些重要的核转录因子如NF-κB和AP-1蛋白可以转移到细胞核中[18]。文献报道,核内转录因子P65和c-jun是调节Src信号通路的重要转录因子[9]。本文研究结果显示,与FGF2处理组相比,共处理组细胞P65和c-jun蛋白表达水平降低,差异具有统计学意义,表明PP2可能是通过靶向FGFR1调节P65和c-jun信号传导途径而表现出抗癌作用。目前,一些通过激活替代信号传导途径,或者通过靶向细胞内酪氨酸激酶结构域的ATP结合位点来抑制FGFR的药物已经被开发应用,例如普纳替尼、瑞格非尼、帕唑帕尼、尼达尼布和乐伐替尼等已被美国食品和药物管理局批准用于治疗癌症[19-21]。然而,这些药物有较多的副作用,说明上述靶向抑制药物仍然存在一些问题,需要进行更深入的研究。基于此背景,应该尽快将PP2抑制剂的研究推向动物水平研究。
总之,本文结果表明,PP2可通过靶向FGFR1和Src发挥抗肿瘤作用,这可能为研发神经胶质瘤的新型治疗药物提供一个新思路。
[参考文献]
[1]LIU C A, CHANG C Y, HSUEH K W, et al. Migration/invasion of malignant gliomas and implications for therapeutic treatment[J]. International Journal of Molecular Sciences, 2018,19(4):1115.
[2]LIU L, TIAN K, ZHU Y, et al. Delta opioid receptor antagonist, ICI 174,864, is suitable for the early treatment of uncontrolled hemorrhagic shock in rats[J]. Anesthesiology, 2013,119(2):379-388.
[3]SELTANA A, GUEZGUEZ A, LEPAGE M, et al. Src family kinase inhibitor PP2 accelerates differentiation in human intestinal epithelial cells[J]. Biochemical and Biophysical Research Communications, 2013,430(4):1195-1200.
[4]BARTSCHT T, LEHNERT H, GIESELER F, et al. The Src family kinase inhibitors PP2 and PP1 effectively block TGF-beta1-induced cell migration and invasion in both established and primary carcinoma cells[J]. Cancer Chemother Pharmacol, 2012,70(2):221-230.
[5]EOM K Y, CHO B J, CHOI E J, et al. The effect of chemoradiotherapy with SRC tyrosine kinase inhibitor, PP2 and temozolomide on malignant glioma cells in vitro and in vivo[J]. Cancer Research and Treatment, 2016,48(2):687-697.
[6]WANG Jianxun, LI Qian, LI Peifeng. Apoptosis repressor with caspase recruitment domain contributes to chemotherapy resistance by abolishing mitochondrial fission mediated by dynamin-related protein-1[J]. Cancer Research, 2009,69(2):492-500.
[7]PERKINS A, LIU G. Primary brain tumors in adults:diagnosis and treatment[J]. American Family Physician, 2016,93(3):211-217.
[8]YIN J H, YANG D I, CHOU H, et al. Inducible nitric oxide synthase neutralizes carbamoylating potential of 1,3-bis (2-chloroethyl)-1-nitrosourea in c6 glioma cells[J]. Journal of Pharmacology and Experimental Therapeutics, 2001,297(1):308-315.
[9]HELSTEN T, SCHWAEDERLE M, KURZROCK R. Fibroblast growth factor receptor signaling in hereditary and neoplastic disease: biologic and clinical implications[J]. Cancer and Metastasis Reviews, 2015,34(3):479-496.
[10]TOUAT M, ILEANA E, POSTEL-VINAY S, et al. Targeting FGFR signaling in cancer[J]. Clinical Cancer Research, 2015,21(12):2684-2694.
[11]PENAULT-LLORCA F, BERTUCCI F, ADELAIDE J, et al. Expression of FGF and FGF receptor genes in human breast cancer[J]. International Journal of Cancer, 1995,61(2):170-176.
[12]NAYAK S, GOEL M M, MAKKER A, et al. Fibroblast growth factor (FGF-2) and its receptors FGFR-2 and FGFR-3 may be putative biomarkers of malignant transformation of potentially malignant oral lesions into oral squamous cell carcinoma[J]. PLoS One, 2015,10(10):e0138801.
[13]DESAI A, ADJEI A A. FGFR signaling as a target for lung cancer therapy[J]. Journal of Thoracic Oncology, 2016,11(1):9-20.
[14]REN Mingqiang, QIN Haiyan, REN Ruizhe, et al. Src activation plays an important key role in lymphomagenesis induced by FGFR1 fusion kinases[J]. Cancer Research, 2011,71(23):7312-7322.
[15]TUNG W H, LEE I T, HSIEH H L, et al. EV71 induces COX-2 expression via c-Src/PDGFR/PI3K/Akt/p42/p44 MAPK/AP-1 and NF-kappa B in rat brain astrocytes[J]. Journal of Cellular Physiology, 2010,224(2):376-386.
[16]MOON S H, KIM D K, CHA Y, et al. PI3K/Akt and Stat3 signaling regulated by PTEN control of the cancer stem cell population, proliferation and senescence in a glioblastoma cell line[J]. International Journal of Oncology, 2013,42(3):921-928.
[17]KIM H S, YUMKHAM S, CHOI J H, et al. Serotonin stimulates GnRH secretion through the c-Src-PLC gamma 1 pathway in GT1-7 hypothalamic cells[J]. Journal of Endocrinology, 2006,190(3):581-591.
[18]LEE J G, HEUR M. Interleukin-1 beta enhances cell migration through AP-1 and NF-kappa B pathway-dependent FGF2 expression in human corneal endothelial cells[J]. Biology of the Cell, 2013,105(4):175-189.
[19]KASPER B, SLEIJFER S, LITIERE S, et al. Long-term responders and survivors on pazopanib for advanced soft tissue sarcomas:subanalysis of two European Organisation for Research and Treatment of Cancer (EORTC) clinical trials 62 043 and 62 072[J]. Annals of Oncology, 2014,25(3):719-724.
[20]DEMETRI G D, REICHARDT P, KANG Y K, et al. Efficacy and safety of regorafenib for advanced gastrointestinal stromal tumours after failure of imatinib and sunitinib (GRID): an international, multicentre, randomised, placebo-controlled, phase 3 trial[J]. Lancet, 2013,381(9863):295-302.
[21]MULHALL A, COLE A, PATEL S. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. Cytisine versus nicotine for smoking cessation, and FACED score for non-cystic fibrosis bronchiectasis[J]. American Journal of Respiratory and Critical Care Medicine, 2015,192(2):249-251.
(本文編辑 马伟平)
