基于HPLC指纹图谱及UPLC-Q-TOF-MS法的3种不同来源大黄差异成分研究
2019-09-10李丹丹张慧李思雨郭泰麟
李丹丹 张慧 李思雨 郭泰麟




中图分类号 R284 文献标志码 A 文章编号 1001-0408(2019)23-3240-06
DOI 10.6039/j.issn.1001-0408.2019.23.13
摘 要 目的:建立不同来源大黄药材的高效液相色谱(HPLC)指纹图谱,并对其中差异成分进行定性鉴别。方法:采用“中药色谱指纹图谱相似度评价系统”(2012版)软件建立30批大黄药材(掌叶大黄20批、唐古特大黄和药用大黄各5批)的HPLC指纹图谱并进行相似度评价,采用偏最小二乘判别法(PLS-DA)结合超高效液相色谱(UPLC)-四极杆-飞行时间串联质谱(Q-TOF-MS)法定性鉴别3种来源大黄的差异性成分。结果:30批大黄药材样品指纹图谱的相似度在0.609~0.960之间。经PLS-DA分析,大黄药材样品按来源明显聚集为3组,3组样品间差异性成分共有18个,经UPLC-Q-TOF-MS鉴别为白藜芦醇-4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷、莲花掌苷、大黄酸-8-O-葡萄糖苷、表儿茶素没食子酸酯、4-(4′-羟苯基)-2-丁酮-4′-O-β-D-(2″-O-肉桂酰基-6″-O-没食子酰基)-葡萄糖苷等。结论:建立的方法可有效区分3种不同来源大黄药材,并对其差异成分进行鉴别,为多来源药材的鉴别和质量评价提供了参考。
关键词 大黄;指纹图谱;高效液相色谱;超高效液相色谱-四极杆-飞行时间-串联质谱法;偏最小二乘判别法;差异成分
Study on Different Components of Rhei Radix Et Rhizoma from 3 Different Origins Based on HPLC Fingerprint and UPLC-Q-TOF-MS
LI Dandan,ZHANG Hui,LI Siyu,GUO Tailin(College of Pharmacy,Liaoning University of TCM,Liaoning Dalian 116600,China)
ABSTRACT OBJECTIVE: To establish HPLC fingerprints of Rhei Radix Et Rhizoma from different origins, and identify the differential components qualitatively. METHODS: HPLC fingerprints of 30 batches of Rhei Radix Et Rhizoma (20 batches of Rheum palmatum, 5 batches of Rheum tanguticum and 5 batches of Rheum officinale) were established and similarity evaluation was performed by using Similarity Evaluation System for Chromatographic Fingerprint of TCM (2012 edition). Qualitative identification of differential components of Rhei Radix Et Rhizoma from 3 different origins were performed by using PLS-DA combined with UPLC-Q-TOF-MS. RESULTS:The fingerprint similarities of 30 batches of samples were between 0.609 and 0.960. According to PLS-DA analysis, Rhei Radix Et Rhizoma were significantly aggregated into 3 groups according to the origin. There were 18 different components among 3 groups, which were identified by UPLC-Q-TOF-MS as resveratrol-4′-O-β-D-(6″-O-gallacyl)-glucoside, lindleyin, rhein-8-O-glucoside, epicatechin gallate, 4-(4′-hydroxyphenyl)-2-butanone-4′-O-β-D-(2″-O-cinnamyl-6″-O-gallacyl)-glucoside. CONCLUSIONS: Established method can effectively identify Rhei Radix Et Rhizoma from 3 different origins, and the differential components can be distinguished, which provides a reference for the identification and quality evaluation of multi-source medicinal materials.
KEYWORDS Rhei Radix Et Rhizoma; Fingerprint; HPLC; UPLC-Q-TOF-MS; PLS-DA; Differential component
大黃为蓼科植物掌叶大黄(Rheum palmatum L.)、唐古特大黄(Rheum tanguticum Maxim.ex Balf.)或药用大黄(Rheum officinale Baill.)的干燥根和根茎,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经等功效[1],是临床常用中药,且用药历史悠久。现今,在市场上流通的3种正品大黄药材和饮片质量参差不齐,行业内公认唐古特大黄和掌叶大黄为优良品种[2]。但3者在外观性状上相似,通过性状难以实现有效区分,因此市场上常见大黄品种来源混淆的现象[3]。为此,亟需建立区分3种来源大黄的鉴别方法,同时寻找出3种大黄的差异性成分,以控制大黄药材的质量。目前,虽有大黄药材指纹图谱以及3种大黄药材预测模型构建等方面的研究[4-5],但3种来源大黄的差异性成分仍不清楚。基于此,本研究结合化学计量学的方法[偏最小二乘判别法(PLS-DA法)],对3种不同来源大黄的全成分指纹图谱进行对比分析,筛选出差异成分峰,并利用超高效液相色谱(UPLC)-四极杆-飞行时间串联质谱(Q-TOF-MS)法对差异成分峰进行定性识别,从而明确并识别3种来源大黄的差异成分,为大黄药材的质量控制和综合利用提供科学依据。
1 材料
1.1 仪器
CP225D电子天平(德国赛多利斯科学仪器有限公司);KQ-250D数控超声波清洗器(昆山超声仪器有限公司);FW-80小型中药高速粉碎机(天津泰斯特仪器有限公司);TDZ4-WS低速台式离心机(湖南湘仪实验室仪器开发有限公司);6550 Q-TOF-MS仪、1260高效液相色谱仪、1290 UPLC仪、G4212B 1260二极管阵列检测器(DAD)(美国安捷伦公司)。
1.2 药品与试剂
30批药材收集于四川、甘肃、青海等省,经辽宁中医药大学药学院张慧教授鉴定为蓼科植物掌叶大黄(R. palmatum L.)、唐古特大黄(R. tangguticum Maxim.ex Balf.)和药用大黄(R. officinale Balf.)的干燥根和根茎;芦荟大黄素-8-O-葡萄糖苷对照品(批号:CHB190115,纯度:≥98%)、大黄酚-8-O-葡萄糖苷对照品(批号:CHB180726,纯度:≥98%)、大黄素-8-O-葡萄糖苷对照品(批号:CHB180727,纯度:≥98%)、大黄酸-8-O-葡萄糖苷对照品(批号:CHB180726,纯度:≥98%)、番泻苷A对照品(批号:CHB180729,纯度:≥98%)均由成都克洛玛生物科技有限公司提供;没食子酸对照品(上海源叶生物科技有限公司,批号:Y19M8C36143,纯度:≥98%);大黄素对照品(批号:110756-200110,纯度:≥98.6%)、大黄素甲醚对照品(批号:110758-201013,纯度:≥99.8%)、大黄酸对照品(批号:110757-200206,纯度:≥99.8%)、芦荟大黄素对照品(批号:110795- 200806,纯度:≥98.6%)均由中国食品药品检定研究院提供;甲醇、甲酸为色谱纯,水为纯净水。大黄样品来源信息见表1。
2 方法与结果
2.1 色谱条件
色谱柱:Phenomenex C18(250 mm ×4.6 mm,5 μm);流动相:甲醇(A)-0.4%甲酸水(B),梯度洗脱(0~8 min,5%→30%A;8~15 min,30%→33%A;15~25 min,33%→35%A;25~30 min,35%→37%A;30~35 min,37%→40%A;35~47 min,40%→45%A;47~64 min,45%→50%A;64~80 min,50%→55%A;80~83 min,55%→60%A;83~93 min,60%→100%A);流速:1.0 mL/min;检测波长:254 nm;柱温:30 ℃;进样量:10 μL。
2.2 供试品溶液的制备
将大黄药材粉碎过80目筛,取粉末0.5 g,精密称定,置于具塞锥形瓶中,精密加入甲醇25 mL,称定质量,室温超声(频率:40 kHz,功率:200 W)30 min,取出放冷,再称定质量,用甲醇补足减失的质量,离心 (4 000 r/min) 5 min,取上清液过0.22 μm微孔滤膜,即得。
2.3 对照品贮备液的制备
精密称取没食子酸、芦荟大黄素-8-O-葡萄糖苷、大黄酸-8-O-葡萄糖苷、番泻苷A、大黄酚-8-O-葡萄糖苷、大黄素-8-O-葡萄糖苷、芦荟大黄素、大黄酸、大黄素、大黄素甲醚对照品适量,分别置于不同的10 mL量瓶中,用甲醇稀释至刻度,制备成质量浓度分别为0.146、0.600、0.506、0.556、0.600、0.407、0.130、0.353、0.103、1.066 mg/mL的對照品贮备液,4 ℃保存,备用。
2.3 方法学考察
2.3.1 精密度试验 取S9号样品,按“2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件连续进样6次,记录色谱图。以峰4(芦荟大黄素-8-O-葡萄糖苷峰)为参照峰,计算得各共有峰相对保留时间的RSD均小于1.5%(n=6)、相对峰面积的RSD均小于3.0%(n=6),表明仪器的精密度良好。
2.3.2 稳定性试验 取S9号样品,按“2.2”项下方法制备供试品溶液,在室温放置0、3、6、9、12、24 h后,分别按“2.1”项下色谱条件进样,记录色谱图。以峰4(芦荟大黄素-8-O-葡萄糖苷)为参照峰,计算得各共有峰相对保留时间的RSD均小于1.5%(n=6)、相对峰面积的RSD均小于5.0%(n=6),表明样品在室温条件下24 h内稳定性良好。
2.3.3 重复性试验 取S9号样品,按“2.2”项下方法平行制备6份供试品溶液,分别按“2.1”项下色谱条件进样,每份样品进样2次,记录色谱图。以峰4(芦荟大黄素-8-O-葡萄糖苷)为参照峰,计算得各共有峰相对保留时间的RSD均小于1.5%(n=6)、相对峰面积的RSD均小于5.0%(n=6),表明该方法重复性良好。
2.4 指纹图谱的建立及分析
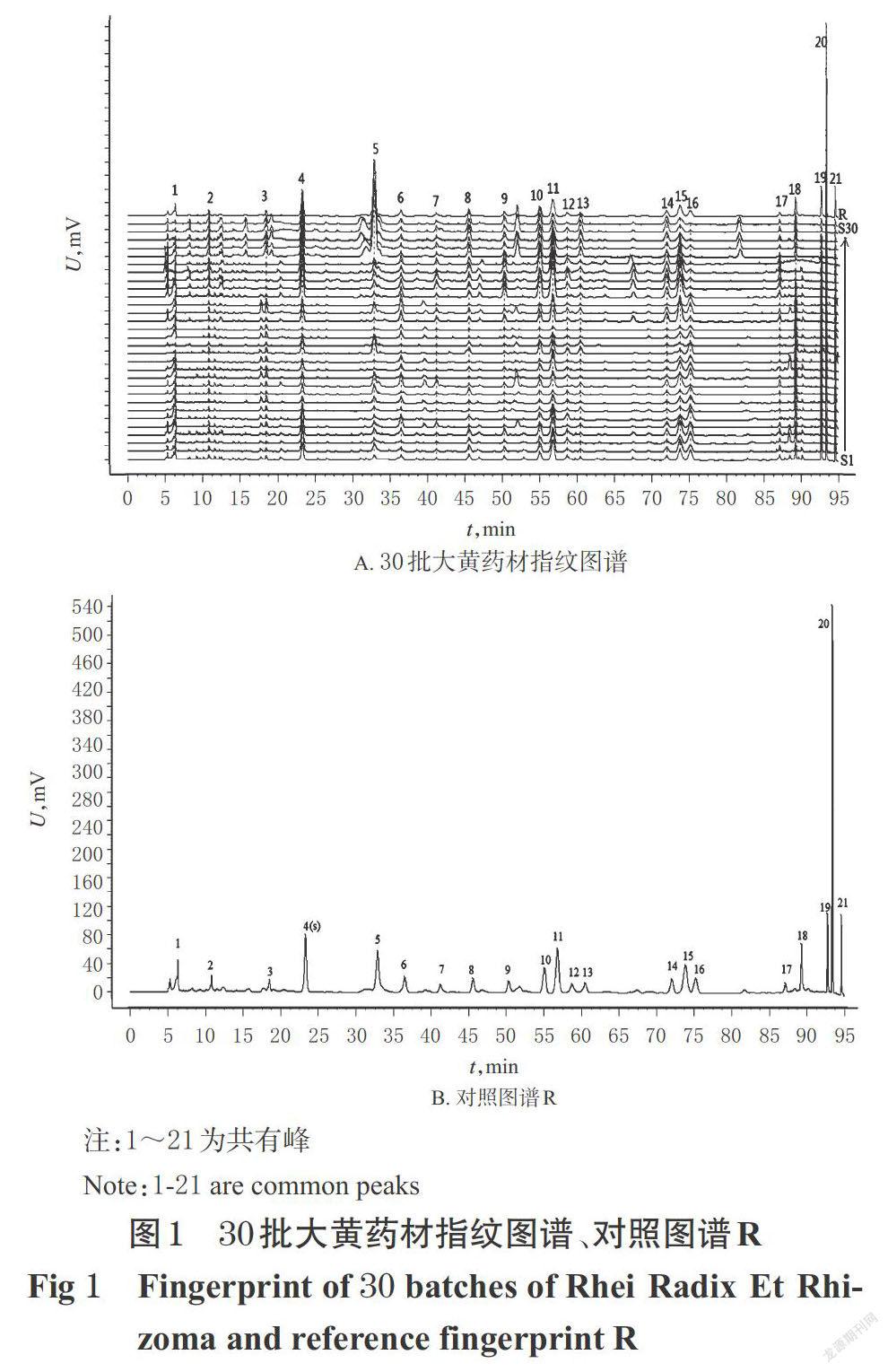
2.4.1 30批大黄指纹图谱的建立及相似度评价 按“2.2”项下方法制备30批大黄的供试品溶液,按“2.1”项色谱条件下进样,记录色谱图。采用“中药色谱指纹图谱相似度评价系统”(2012版)软件对30批大黄的HPLC图谱进行分析。以S1号图谱作为参照图谱(S1号图谱中各峰信号强度大、分离完全),设置时间窗宽度为0.1 min,通过多点校正及自动匹配生成30批大黄样品的共有模式,采用中位数法生成对照图谱R,并以生成的对照图谱R为参照进行整体相似度评价。结果,共标定出了21个共有峰。以峰4(芦荟大黄素-8-O-葡萄糖苷)作为参照峰(S)计算得到的30批大黄样品中各共有峰相对保留时间的RSD小于1.78%(n=30),重现性较好;但其相对峰面积的RSD在31.76%~153.20%之间(n=30),波动较大,这表明不同来源大黄样品中共有成分的含量差异较大。相似度分析结果显示,各指纹图谱与对照图谱R的相似度在0.609~0.960之间,其中掌叶大黄的相似度在0.778~0.960之间,药用大黄的相似度在0.745~0.792之间,唐古特大黄的相似度在0.609~0.690之间。30批大黄药材指纹图谱的共有模式、对照图谱R见图1,各共有峰的相对保留时间、相对峰面积分别见表2、表3,相似度分析结果见表4。
2.4.2 3种不同来源大黄对照图谱的建立及特征成分差异峰的分析 按“2.4.1”项下指纹图谱生成方法,分别得到20批掌叶大黄、5批药用大黄和5批唐古特大黄样品的指纹图谱,并得到其相应的对照图谱。结果显示,3种来源大黄的对照图谱中共有峰在数量和含量上均存在一定的差异,掌叶大黄对照图谱中标定的共有峰为21个,药用大黄对照图谱中标定的共有峰为24个,而唐古特大黄对照图谱中标定的共有峰为30个。与掌叶大黄对照图谱相比,药用大黄对照图谱上增加了22~24号3个特征峰,唐古特大黄对照图谱上增加了22号和24~31号共9个特征峰。3种不同来源大黄的对照图谱见图2。
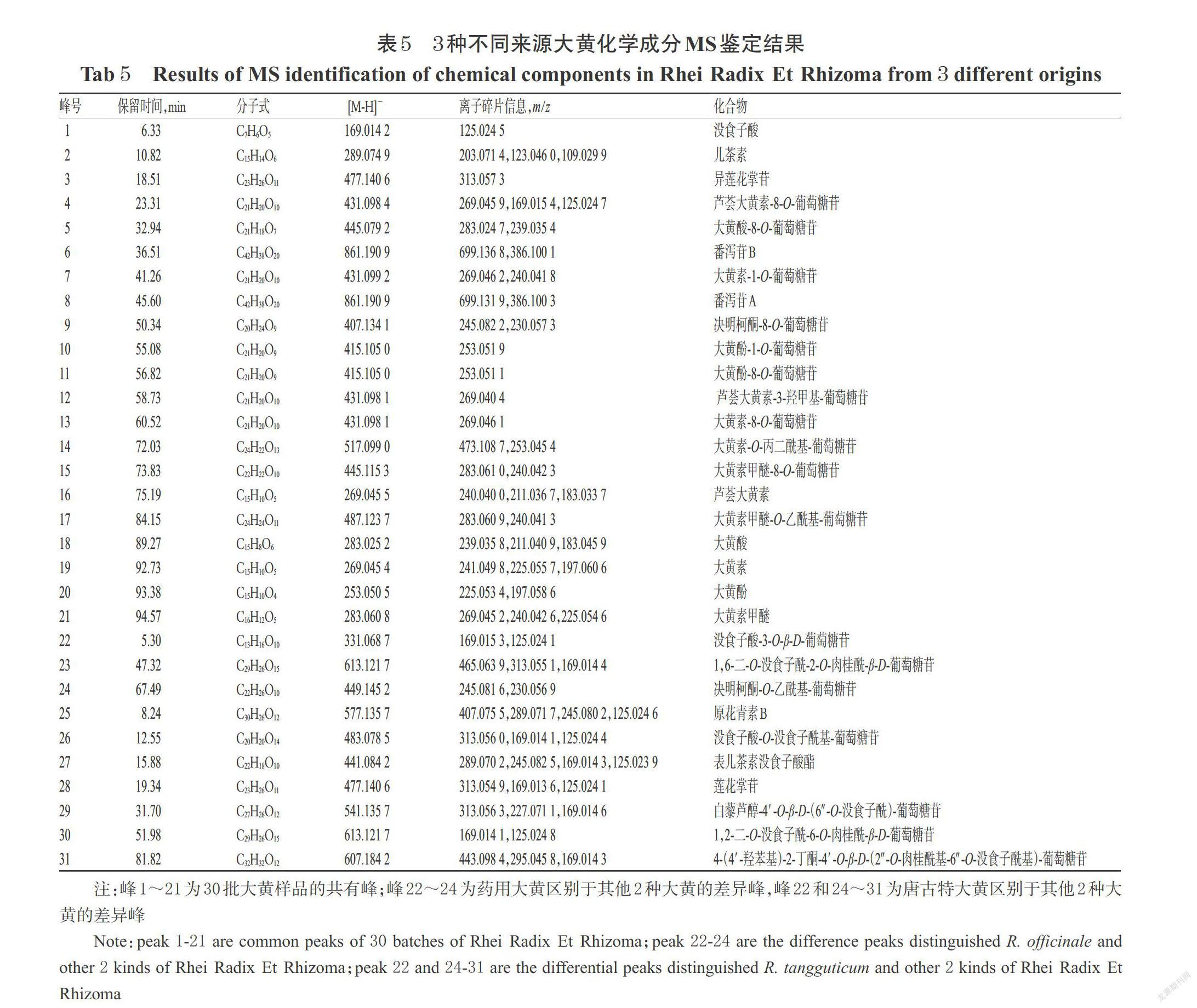
2.4.3 共有峰和特征成分差异峰的鉴定 分别按“2.1”项下方法制备3种不同来源大黄样品(S9、S23、S28)的供试品溶液,并取“2.3”项下对照品贮备液,通过UPLC-Q-TOF-MS法对其进行检测分析。色谱条件同“2.1”项下。MS条件为采用Dual AJS 电喷雾离子源(ESI),在负离子下模式检测;干燥气温度为200 ℃,干燥气流速为14 L/min;雾化气压为35 psi;鞘气温度为400 ℃,鞘气流速为11 L/min;毛细管电压为3 500 V;母离子扫描范围為质荷比(m/z)100~1 700;二级质谱子离子扫描范围为m/z 100~1 000;碰撞能量为-30 eV。结合对照品图谱、样品质谱裂解信息以及相关文献数据[6-8],初步鉴定了21个共有成分峰和“2.4.2”中确定的3种大黄指纹图谱之间的10个特征差异成分峰。其中,21个共有成分多为结合蒽醌、游离蒽醌及蒽酮类成分,药用大黄区别于掌叶大黄的特征成分(22~24号峰)为鞣质和蒽酮类成分,而唐古特大黄区别于其他两种来源大黄的特征成分(25~31号峰)包含了鞣质、苯丁酮苷和二苯乙烯类成分。3种不同来源大黄化学成分MS鉴定结果见表5。
2.4.4 PLS-DA法分析差异性成分 PLS-DA是一种集主成分分析(PCA)、典型相关分析(CCA)和多元回归分析的基本功能为一体的具有监督模式的识别方法,可以消除众多化学信息中相互重叠的部分,使分析数据更加准确可靠[9]。以鉴定出的30批大黄样品的21个共有峰和10个特征差异成分峰的峰面积为变量,将其导入SIMCA-P 12.0软件中进行PLS-DA分析,获取PLS-DA得分图[PLS-DA模型中,当R2Y(累积解释能力参数)、Q2(模型预测能力参数)均大于0.5时,可认为该模型的稳定性和预测能力较好]和变量权重重要性排序(VIP)图(当VIP>1时,表明该成分是具有统计学意义的差异标志物)[10-11]。结果显示,建立的PLS-DA模型中R2Y和Q2分别为0.886和0.859,表明该模型稳定性及预测能力较好,可用于鉴别和区分3种来源大黄样品。根据PLS-DA得分图可知,大黄样品按来源可区分为3组,能直观显示出各组间的差异。根据VIP图可知,共有18个峰的VIP>1,按权重重要性排序依次为峰29>峰28>峰5>峰27>峰31>峰24>峰9>峰22>峰14>峰2>峰13>峰4>峰17>峰3>峰8>峰15>峰10>峰26,即筛选出的差异性成分分别是白藜芦醇-4′-O-β-D-(6″-O-没食子酰)-葡萄糖苷、莲花掌苷、大黄酸-8-O-葡萄糖苷、表儿茶素没食子酸酯、4-(4′-羟苯基)-2-丁酮-4′-O-β-D-(2″-O-肉桂酰基-6″-O-没食子酰基)-葡萄糖苷、决明柯酮-O-乙酰基-葡萄糖苷、决明柯酮-8-O-葡萄糖苷、没食子酸-3-O-β-D-葡萄糖苷、大黄素-O-丙二酰基-葡萄糖苷、儿茶素、大黄素-8-O-葡萄糖苷、芦荟大黄素-8-O-葡萄糖苷、大黄素甲醚-O-乙酰基-葡萄糖苷、异莲花掌苷、番泻苷A、大黄素甲醚-8-O-葡萄糖苷、大黄酚-1-O-葡萄糖苷和没食子酸-O-没食子酰基-葡萄糖苷。PLS-DA得分图和VIP得分图分别见图3、图4。
3 讨论
3.1 色谱条件的选择
在前期预试验中,笔者分别对检测波长、流动相、柱温等色谱条件进行了筛选:(1)检测波长的选择。据文献报道[12-14],大黄中蒽醌类成分多在254、280 和430 nm波长处检测,故本研究分别考察了在254、280、430 nm波长处大黄样品的色谱行为,结果发现波长在254 nm时色谱峰数较多、基线最平稳、峰形较好,故本研究的检测波长最终确定为254 nm。(2)流动相的选择。笔者前期分别比较了以甲醇-水、乙腈-水、甲醇-0.2%甲酸水、甲醇-0.4%甲酸水为流动相体系的分离效果,结果发现以甲醇-0.4%甲酸水为流动相时,所得色谱图基线更平稳,故本研究流动相体系选择甲醇-0.4%甲酸水溶液。(3)柱温的选择。笔者前期分别考察了25、30、35 ℃柱温对结果的影响,结果柱温为30 ℃时峰形最佳且分离度良好,故本研究中柱温选择30 ℃。
3.2 样品提取条件的考察
笔者在前期分别比较了不同提取溶剂(甲醇、75%甲醇、乙醇、75%乙醇)、不同提取方法(超声、回流)以及不同提取时间(10、30、60 min)对样品的提取效果。结果发现:以甲醇作为提取溶剂时提取得到的各成分含量最高;样品经回流和超声提取后色谱峰种类和面积均无明显差异;在30 min提取效果最佳。为使试验操作简便,故选择以甲醇为提取溶剂、超声提取30 min的方式进行样品处理。
3.3 大黄药材差异成分的比较分析
据30批大黄药材相似度分析结果显示:仅S2、S4、S15和S19样品的相似度达到0.9以上,其均为掌叶大黄;而药用大黄与唐古特大黄的相似度较差,均低于0.8。通过比较3种来源大黄的对照指纹图谱进一步发现,唐古特大黄和药用大黄的共有峰数量较多,且鞣质类和结合蒽醌类成分显著高于掌叶大黄(峰面积较大),而掌叶大黄中的游离蒽醌类成分含量显著高于其他2种来源大黄(16,18~21号峰面积明显较大)。PLS-DA分析将30批大黄分为3组,该分类趋势可能与其来源、生长年限、生态环境具有一定的相关性,但不绝对相关。进一步通过PLS-DA模型中的VIP排序筛选出可区分不同来源大黄的18个差异性成分,这些成分可以作为快速区分不同来源大黄药材的指标,这为大黄的质量评价以及多来源药材的质量控制提供了参考。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:23-24.
[ 2 ] 桂镜生.中药商品学[M].昆明:云南大学出版社,2015:73-77.
[ 3 ] 逄瑜,孙磊,金红宇,等.指纹图谱结合化学计量学分析用于多种大黄的鉴别及质量评价[J].中国药学杂志,2014,49(4):287-293.
[ 4 ] 杜清涛,温金莲,严优芍,等.不同品種不同产地大黄UPLC指纹图谱研究[J].中药材,2013,36(5):725-731.
[ 5 ] 陈安珍,蒋万枫,袁航,等.基于超高效液相色谱偏最小二乘判别分析法建立鉴别大黄真伪及种属预测模型的方法[J].中国药学杂志,2016,51(3):197-202.
[ 6 ] 赵倩,陈育鹏,崔旭盛,等.掌叶大黄UPLC多指标成分测定及指纹图谱研究[J].药物分析杂志,2018,38(10):1697- 1710.
[ 7 ] 曹瑞,窦志华,倪丽丽,等. HPLC指纹图谱、Q-TOF/MS定性及多成分定量相结合的大黄饮片质量评价研究[J].中草药,2019,50(5):1100-1110.
[ 8 ] 高亮亮.唐古特大黄、药用大黄和掌叶大黄的化学成分和生物活性研究[D].北京:北京协和医学院,2012.
[ 9 ] 蒋万枫,杨钊,张凤艳.应用化学计量学和顶空-气相色谱质谱联用技术对7 种植物油进行类别分析[J].分析试验室,2017,36 (6):732-737.
[10] 周欣,张琳,毛婵,等.基于化学计量学方法结合正交偏最小二乘判别分析的陈皮饮片HPLC指纹图谱研究[J].中草药,2019,50(9):2194-2200.
[11] 罗益远,刘娟秀,刘训红,等.基于UPLC-Triple TOF MS/MS技术分析不同产地何首乌的差异化学成分[J].质谱学报,2017,38(6):678-689.
[12] 陆文瑾,窦志华,曹瑞,等. HPLC法同时测定大黄药材中8个非蒽醌类成分的含量[J].中国药房,2019,30(14):1975-1980.
[13] 冯素香,王哲,郝蕊,等. HPLC法同时测定不同产地掌叶大黄中10个蒽醌类化合物[J].药物分析杂志,2017,37(5):783-788.
[14] 窦志华,曹瑞,卞理,等.正交试验法优选大黄中蒽醌类成分提取工艺[J].中草药,2018,49(14):3279-3286.
(收稿日期:2019-07-18 修回日期:2019-09-06)
(编辑:林 静)