蒲桃不同药用部位乙醇提取物对α-葡萄糖苷酶和α-淀粉酶活性的抑制作用研究
2019-09-10温正辉凌梅娣余思萍庄远杯罗晓东潘增烽林大都张声源
温正辉 凌梅娣 余思萍 庄远杯 罗晓东 潘增烽 林大都 张声源


中圖分类号 R284.2 文献标志码 A 文章编号 1001-0408(2019)23-3246-06
DOI 10.6039/j.issn.1001-0408.2019.23.14
摘 要 目的:比较蒲桃不同药用部位(根、茎、叶、种子、花和果肉)乙醇提取物对α-葡萄糖苷酶、α-淀粉酶活性的抑制作用。方法:以半数抑制浓度(IC50)为评价指标,阿卡波糖为阳性对照,采用体外抑制模型方法评价蒲桃不同药用部位乙醇提取物对α-葡萄糖苷酶(酵母菌源和小鼠小肠源)和α-淀粉酶活性的抑制作用,并采用酶促动力学与Lineweaver-Burk双倒数法分析作用最强的药用部位对α-葡萄糖苷酶和α-淀粉酶活性的抑制类型。结果:蒲桃不同药用部位乙醇提取物对酵母菌源α-葡萄糖苷酶活性抑制作用的强弱顺序为蒲桃种子>蒲桃茎>蒲桃叶>蒲桃根>蒲桃花>蒲桃果肉>阿卡波糖,对小鼠小肠源α-葡萄糖苷酶活性抑制作用的强弱顺序为蒲桃种子>蒲桃茎>蒲桃根>蒲桃叶>蒲桃花>蒲桃果肉>阿卡波糖,对α-淀粉酶活性抑制作用的强弱顺序为阿卡波糖>蒲桃种子>蒲桃茎>蒲桃根>蒲桃叶>蒲桃果肉>蒲桃花。其中,蒲桃种子乙醇提取物对酵母菌源α-葡萄糖苷酶、小鼠小肠源α-葡萄糖苷酶和α-淀粉酶活性的抑制作用[IC50分别为(6.64±0.24)、(32.77±2.46)和(41.18±1.63) μg/mL]显著强于其他药用部位,并且对α-葡萄糖苷酶活性的抑制作用显著强于阿卡波糖[对酵母菌源α-葡萄糖苷酶和小鼠小肠源α-葡萄糖苷酶的IC50分别为(2 833.33±5.48)、(1 304.21±6.45) μg/mL](P<0.05),但其对α-淀粉酶活性的抑制作用不及阿卡波糖[IC50为(27.27±1.24) μg/mL](P<0.05)。酶促动力学研究结果表明,蒲桃种子乙醇提取物对α-葡萄糖苷酶、α-淀粉酶的抑制作用均为可逆竞争性抑制类型。结论:在蒲桃根、茎、叶、种子、花和果肉等不同部位中,以蒲桃种子对α-葡萄糖苷酶、α-淀粉酶活性的抑制作用最强,具有开发成辅助降糖的药品或保健食品的价值。
关键词 蒲桃;药用部位;乙醇提取物;α-葡萄糖苷酶;α-淀粉酶;酶促动力学
Study on Inhibitory Effects of Ethanol Extract of Different Medicinal Parts from Syzygium jambos on the Activities of α-Glycosidase and α-Amylase
WEN Zhenghui1,LING Meidi2,YU Siping2,ZHUANG Yuanbei2,3,LUO Xiaodong2,PAN Zengfeng2,LIN Dadu2,ZHANG Shengyuan2,3(1.Dept. of Pharmacy, the Affiliated Hospital of Medical College, Jiaying University, Guangdong Meizhou 514031, China;2.Medical College, Jiaying University, Guangdong Meizhou 514031, China;3.Institute of Hakka Medicinal Bio-resources, Medical College, Jiaying University, Guangdong Meizhou 514031, China)
ABSTRACT OBJECTIVE: To compare inhibitory effects of ethanol extract of different medicinal parts (root, stem, leaf, seed, flower and flesh) from Syzygium jambos on the activities of α-glycosidase and α-amylase. METHODS: Using half-inhibitory concentration value (IC50) as evaluation index, acarbose as positive control, inhibitory effects of ethanol extract of different medicinal parts from S. jambos on the activities of α-glycosidase (from yeast and small instestine in mice) and α-amylase were evaluated with in vitro inhibition model. The enzymatic dynamics and Lineweaver-Burk methods were used to analyze the inhibitory type of the best medicinal part on the activities of α-glycosidase and α-amylase. RESULTS: In the yeast α-glucosidase inhibitory activity test, the order of inhibitory activity was S. jambos seed>S. jambos stem>S. jambos leaf>S. jambos root>S. jambos flower>S. jambos flesh>acarbose. In the mice intestine α-glucosidase inhibitory activity test, the order of inhibitory activity was S. jambos seed>S. jambos stem>S. jambos root>S. jambos leaf>S. jambos flower>S. jambos flesh>acarbose. In the α-amylase inhibitory activity test, the order of inhibitory activity was acarbose>S. jambos seed>S. jambos stem>S. jambos root>S. jambos leaf>S. jambos flesh>S. jambos flower. Ethanol extract of S. jambos seed had the stronger inhibition activity against α-glucosidase from yeast,α-glucosidase from small intestine in mice and α-amylase than other medicinal parts [IC50 were(6.64±0.24), (32.77±2.46) and (41.18±1.63) μg/mL]. Ethanol extract of S. jambos seed had the stronger inhibition activity against α-glucosidase than acarbose [IC50 to α-glucosidase from yeast and α-glucosidase from small intestine in mice were (2 833.33±5.48), (1 304.21±6.45) μg/mL] (P<0.05). The inhibitory effect of ethanol extract from S. jambos on the activity of α-amylase was less than that of acarbose [IC50 was (27.27±1.24) μg/mL] (P<0.05). Enzymatic dynamics showed that the inhibitory type of ethanol extract from S. jambos seed on α-glucosidase and α-amylase were both reversible competitive inhibition. CONCLUSIONS: Among different parts of S. jambos such as root, stem, leaf, seed, flower and flesh, S. jambos seed shows the strongest inhibitory effects on the activities of α-glucosidase and α-amylase, which has the value of being developed for the treatment of diabetes or health food.
KEYWORDS Syzygium jambos; Medicinal part; Ethanol extract; α-glucosidase; α-amylase; Enzymatic dynamics
糖尿病(Diabetes mellitus,DM)在臨床上主要有胰岛素依赖型(1型,T1DM) 和非胰岛素依赖型(2型,T2DM),其中 T2DM 患者胰岛素分泌不足及分泌高峰延迟,餐后血糖持续升高,是引起肾病、视网膜病变等并发症的主要原因,有效控制餐后血糖上升有利于防治糖尿病及其并发症的发生[1]。α-葡萄糖苷酶和α-淀粉酶是碳水化合物消化为葡萄糖的关键酶,为降低餐后血糖的有效分子靶标[2-3]。已上市的α-葡萄糖苷酶抑制剂,如阿卡波糖、伏格列波糖等已被推荐为临床降低餐后血糖的首选药物,但长期服药会引发肠胃胀气、腹部不适等不良反应,并且有可能使机体产生依赖性[4-5]。从中草药资源中寻找新型、高效、低毒的α-葡萄糖苷酶抑制剂已成为糖尿病治疗药物的研究热点和开发方向。
蒲桃[Syzygium jambos (L.) Alston]为桃金娘科(Myrtaceae)蒲桃属常绿乔木,在我国主产于广东、海南等省区,为岭南地区民间习用药材,已收载于《广东省中药材标准》中[6]。蒲桃药用历史悠久,据《中华本草》[7]记载,蒲桃根皮具有凉血解毒功效,主治泄泻、外伤出血;蒲桃茎具有温中散寒、温肺止咳等功效,用于胃寒呃逆、肺虚寒咳;蒲桃叶可以清热解毒,主治疮疡、痘疮;蒲桃种子可以健脾止泻,主治脾虚泄泻、糖尿病;蒲桃壳可以暖胃健脾、补肺止嗽,主治胃寒呃逆、肺虚寒嗽。本课题组前期对蒲桃枝叶开展了降血糖活性成分研究,发现蒲桃枝叶的乙酸乙酯和正丁醇提取物及从中分离得到的多个成分具有良好的体外α-葡萄糖苷酶抑制活性[8]。为进一步全面比较蒲桃不同药用部分在降血糖方面的药效作用,本研究拟对蒲桃的根、茎、叶、种子、花和果肉6个药用部位的乙醇提取物对α-葡萄糖苷酶和α-淀粉酶活性的体外抑制作用进行评价,并对活性最强药用部位进行酶促动力学分析,为扩大蒲桃药用部位及其资源的综合利用提供更充分的依据。
1 材料
1.1 仪器
Alliance 2695型高效液相色谱(HPLC)仪(美国Waters公司);UV-1800型紫外-可见分光光度计(日本岛津公司);Q-Gard A2型超纯水仪(德国Millipore公司);BT125D型电子分析天平、BS110s 型电子分析天平(德国Sartorius公司);TG16-WS 型高速离心机(长沙维尔康湘鹰离心机有限公司);JP-100S型超声波清洗器(深圳市洁盟清洗设备有限公司);PHSJ-3F型pH计(上海精科仪器有限公司)。
1.2 药品与试剂
蒲桃的种子、茎、叶、根、花、果肉于2017年5月采自广东省梅州市梅江区,经嘉应学院医学院药学系聂华副教授鉴定为真品;α-葡萄糖苷酶(面包酵母,批号:SLBT8587,活性:≥10 U/mg)、α-淀粉酶(批号:SLBV0705,活性:≥10 U/mg)均购自美国Sigma 公司;对硝基苯基-α-D-吡喃葡萄糖苷(pNPG,上海源叶科技有限公司,批号:K04F8B28175,纯度:99%,生物技术级);阿卡波糖片(德国拜耳公司,批号:BJ41706,规格:50 mg);3,5二硝基水杨酸(DNS,国药集团化学试剂有限公司,批号:20170904,分析纯);可溶性淀粉(天津市大茂化学试剂厂,批号:20180501,分析纯);甲醇和乙腈(美国Fisher Scientific公司,色谱纯);其他试剂均为分析纯。
1.3 动物
健康昆明种小鼠80只,♂,体质量18~22 g,由广东省医学实验动物中心提供,动物生产合格证号:SCXK-(粤)2018-0002。实验前将小鼠饲养于相对湿度为45%~75%、室温为25 ℃的动物室内,饲养期间自由饮食。适应性喂养1周后用于实验。本研究得到嘉应学院医学院伦理委员会批准,在整个实验中遵守《实验动物管理条例》,做到减轻小鼠痛苦,增加其舒适度。
2 方法与结果
2.1 蒲桃不同药用部位乙醇提取物的制备
分别取蒲桃种子、茎、叶、根、花和果肉各2.0 kg,干燥,粉碎过40目,分别用2倍量的95%乙醇超声(45 ℃,200 W,40 kHz,30 min)提取3次,合并提取液,减压浓缩得浸膏,即得到种子浸膏169 g(得率为8.5%)、茎浸膏217 g(得率为10.9%)、叶浸膏324 g(得率为16.2%)、根浸膏224 g(得率为11.2%)、花浸膏198 g(得率为9.9%)、果肉浸膏248 g(得率为12.4%),将各部位浸膏放置于4 ℃冷藏,备用。样品使用前加磷酸盐缓冲液(PBS,0.067 mol/L、pH 6.8)溶解,制备成不同质量浓度的溶液(质量浓度均以提取物计)。
2.2 对酵母菌来源α-葡萄糖苷酶抑制活性的测定
采用pNPG法进行试验,检测方法采用HPLC法。色谱条件:色谱柱为XBridge Peptide BEH C18(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱(0~8 min,20%→30%A;8~13 min,30%→80%A;13~15 min,80%→20% A;15~25 min,20%A);流速为1.0 mL/min;进样量为10 μL;柱温为35 ℃;检测波长为315 nm。
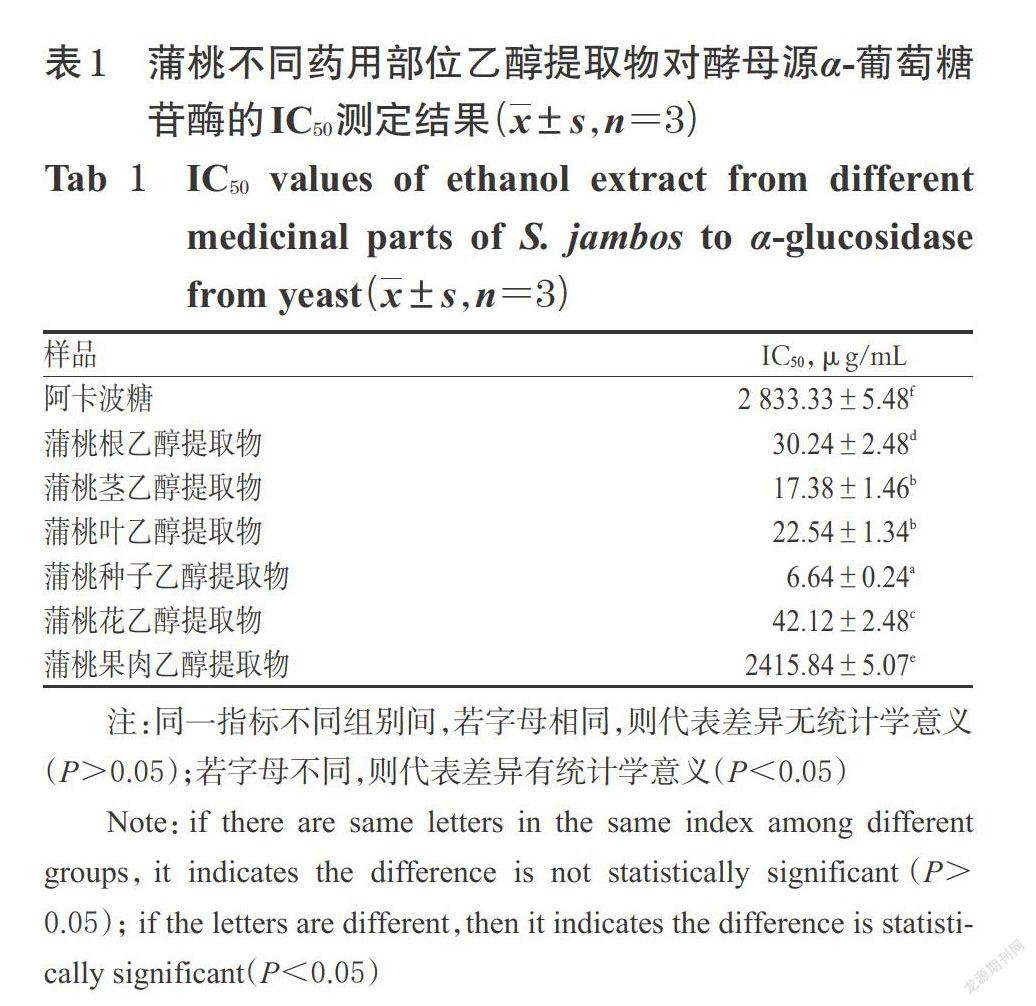
试验以pNPG为底物,通过HPLC检测产物对硝基苯酚 (pNP) 的变化,确定α-葡萄糖苷酶的活性。参考文献方法[8]并作适当调整,具体如下:将蒲桃各部位样品(根、茎、叶、种子、花和果肉的乙醇提取物浸膏)分别制备成不同质量浓度的溶液,其中,根部位样品为18、24、30、36、42 μg/mL,茎部位样品为14、17.5、21、24.5、28 μg/mL,叶部位样品为10、15、25、35、45 μg/mL,种子部位样品为3.5、5.25、7、10.5、12.25 μg/mL,花部位样品为10、20、30、50、70 μg/mL,果肉部位样品为2 400、2 800、 3 200、3 600、4 000 μg/mL;将阿卡波糖(阳性对照)制备成质量浓度分别为500、1 000、2 000、3 000、4 000 μg/mL的溶液。将0.067 mol/L pH 6.8的PBS 500 μL、待测样品100 μL和0.1 U/mL的α-葡萄糖苷酶(0.067 mol/L pH 6.8的PBS溶解)600 μL,振荡混匀,37 ℃恒温孵育20 min,加入4.0 mmol/L的pNPG 400 μL,振荡混匀,在37 ℃恒温反应30 min后,加入甲醇1 600 μL终止反应;样品经0.45 μm膜过滤后,用HPLC法检测pNP峰面积(A)。按以下公式计算抑制率:抑制率(%)=[1-(A样品-A样品对照)/A阴性]×100%,式中,A阴性表示在相同条件下以等体积PBS代替样品测得的pNP峰面积,A样品对照表示在相同条件下以等体积PBS代替α-葡萄糖苷酶测得的pNP峰面积。试验重复3次,采用SPSS 19.0统计学软件进行数据分析。计量资料以x±s表示,使用PROBIT法对数据进行回归分析、处理,得到相应的酶半数抑制浓度 (IC50);多组间数据比较采用单因素方差分析,两组间比较采用LSD检验。P<0.05表示差异具有统计学意义。蒲桃不同药用部位乙醇提取物对酵母菌来源α-葡萄糖苷酶的IC50测定结果见表1。
表1結果显示,蒲桃各药用部位乙醇提取物对α-葡萄糖苷酶均具有一定的抑制作用。蒲桃不同药用部位对酵母菌源α-葡萄糖苷酶抑制作用强弱依次为:种子>茎>叶>根>花>果肉,各药用部位的IC50均显著低于阳性对照阿卡波糖[IC50=(2 833.33±5.48) μg/mL],差异均具有统计学意义(P<0.05)。
2.3 对小鼠小肠来源α-葡萄糖苷酶抑制活性的测定
采用pNPG法进行试验。参照文献方法[9]并作适当调整,具体如下:将80只小鼠经颈椎脱位方法处死,获得小鼠小肠。采用预冷的0.9% NaCl溶液清洗肠道脂肪组织,并纵向切开洗净内容物,按体积比为1 ∶ 3加入4 ℃预冷的磷酸钠缓冲液(10 mmol/L,pH 7.0),混合物研磨后于4 ℃下以8 000 r/mim离心20 min,吸取上清液后分装,即得小鼠小肠源α-葡萄糖苷酶,-20 ℃贮存,备用。将各样品(根、茎、叶、种子、花和果肉的乙醇提取物浸膏)制备成不同质量浓度的溶液,其中,根部位样品为500、1 500、2 500、3 500、4 500 μg/mL,茎部位样品为80、240、400、560、720 μg/mL,叶部位样品为500、1 500、 2 500、3 500、4 500 μg/mL,种子部位样品为80、240、400、560、720 μg/mL,花部位样品为500、1 500、2 500、 3 500、4 500 μg/mL,果肉部位样品为500、1 500、2 500、3 500、4 500 μg/mL;另外,将阿卡波糖(阳性对照)制备成质量浓度分别为500、1 500、2 500、3 500、4 500 μg/mL的溶液。α-葡萄糖苷酶抑制活性测定及检测方法、样品的加入和处理以及抑制率的计算方式以及统计分析等均同“2.2”项下。蒲桃不同药用部位乙醇提取物对小鼠小肠源α-葡萄糖苷酶的IC50测定结果见表2。
表2结果显示,蒲桃各药用部位乙醇提取物对小鼠小肠源α-葡萄糖苷酶均具有一定的抑制作用。且在试验浓度范围内,其对小鼠小肠来源α-葡萄糖苷酶抑制作用强弱依次为:种子>茎>根>叶>花>果肉,各药用部位的IC50均显著低于阳性对照阿卡波糖[IC50= (1 304.21±6.45) μg/mL],差异均具有统计学意义(P<0.05)。
2.4 对猪胰腺α-淀粉酶抑制率的测定
采用DNS法。参考文献方法[10]并作适当调整,具体如下:将各样品(根、茎、叶、种子、花和果肉的乙醇提取物浸膏)制备成不同质量浓度的溶液,根部位样品为31、62.25、125、250、500 μg/mL,茎部位样品为31、62.25、125、250、500 μg/mL,叶部位样品为2 500、5 000、10 000、15 000、20 000 μg/mL,种子部位样品为3、12、48、192、384 μg/mL,花部位样品为2 500、5 000、10 000、15 000、20 000 μg/mL,果肉部位样品为2 500、5 000、10 000、 15 000、20 000 μg/mL;将阿卡波糖(阳性对照)制备成质量浓度分别为0.1、1、10、100、200 μg/mL的溶液。吸取不同质量浓度的样品溶液0.3 mL,分别置于10 mL试管中,取0.686 mg/mL α-淀粉酶溶液0.3 mL分别与样品混合均匀,置于37 ℃水浴中预温5 min,加入0.3 mL在 37 ℃水浴中同时预温5 min的1%可溶性淀粉溶液,混匀后反应15 min,立即加入0.5 mL DNS显色并终止反应,置于沸水中煮沸5 min,随后放置于冰水中静置20 min,磷酸缓冲溶液定容至5 mL,采用紫外-可见分光光度计在540 nm波长下测溶液吸光值(A)。并按公式计算各其对α-淀粉酶的抑制率:抑制率(%)=[1-(A样品-A样品对照)/(A阴性-A阴性对照)]×100%,式中,A阴性为在相同条件下以等体积PBS替代样品测得的吸光度值,A阴性对照为在相同条件下分别以等体积PBS替代样品和α-淀粉酶测得的吸光度值,A样品对照为在相同条件下以等体积PBS替代α-淀粉酶测得的吸光度值。试验重复3次,统计分析方法同“2.2”项下。蒲桃不同药用部位乙醇提取物对α-淀粉酶的IC50测定结果见表3。
表3结果显示,蒲桃各药用部位乙醇提取物对α-淀粉酶活性均有一定的抑制作用。其对α-淀粉酶抑制作用强弱小依次为:种子>茎>根>叶>果肉>花,各药用部位的IC50均显著高于阳性对照阿卡波糖[IC50=(27.27±1.24) μg/mL],差异均具有统计学意义(P<0.05)。
2.5 对α-葡萄糖苷酶抑制作用的动力学试验
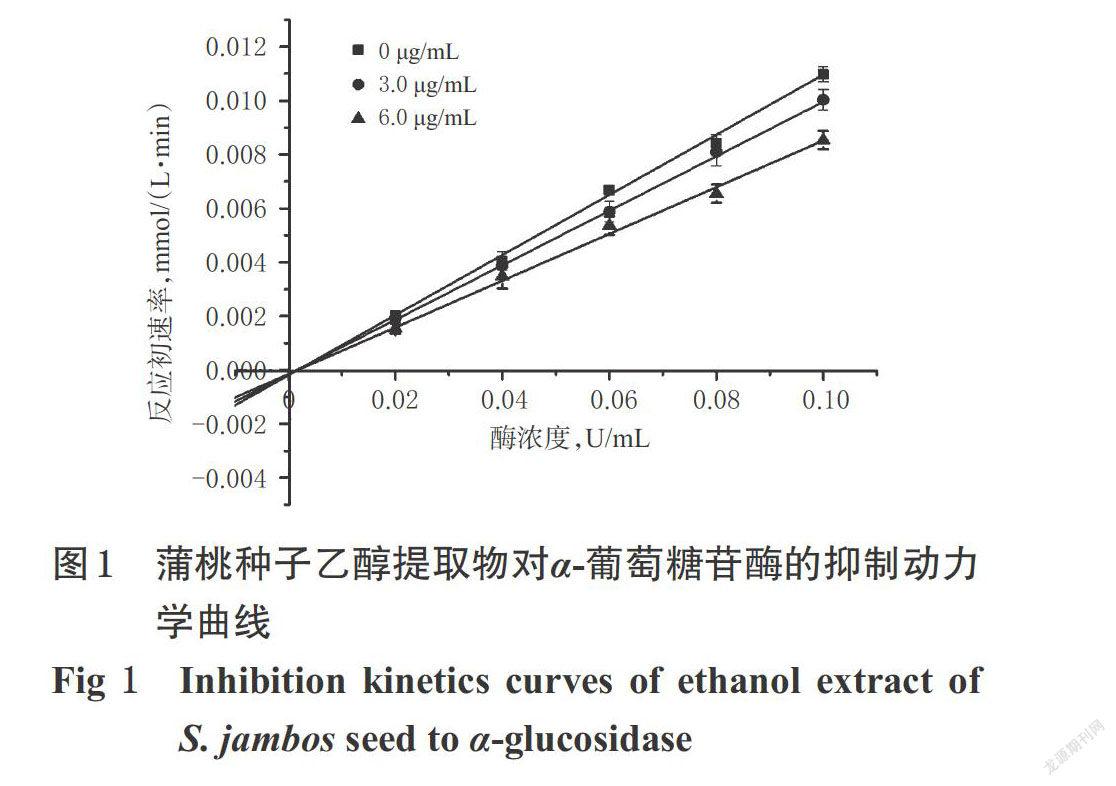
由于蒲桃种子乙醇提取物对α-葡萄糖苷酶活性的抑制作用显著强于其他药用部位,因此本研究选用蒲桃种子乙醇提取物进行α-葡萄糖苷酶抑制作用的动力学试验。参考文献方法[11-12]并作适当调整,具体如下:固定底物pNPG浓度为4.0 mmol/L,在不添加(0 μg/mL)和添加蒲桃种子乙醇提取物(质量浓度为3.0、6.0 μg/mL,以乙醇提取物计,下同)的条件下,分别测定其在不同浓度(0.02、0.04、0.06、0.08、0.10 U/mL)α-葡萄糖苷酶反应体系下的反应初速率,以酶浓度(U/mL)为横坐标、反应初速率mmol/(L·min)为纵坐标作图,判断其为可逆或不可逆抑制类型,结果见图1。
由图1可知,3组直线通过原点,且直线的斜率随蒲桃种子质量浓度的减小而减小,为典型的可逆性抑制特征图。结果表明,蒲桃种子乙醇提取物对α-葡萄糖苷酶的抑制类型为可逆性抑制。
在确定其为可逆抑制类型的情况下,固定α-葡萄糖苷酶浓度为0.1 U/mL,在不添加(0 μg/mL)和添加蒲桃种子醇提物(质量浓度为3.0、6.0 μg/mL)的条件下,测定其在不同pNPG浓度(1.0、2.0、3.0、4.0、5.0 mmol/L)反应体系下的反应初速率,以底物浓度的倒数(1/S)为横坐标和反应初速率的倒数(1/V)为纵坐标绘制Lineweaver-Burk曲线,以判断其属于竞争性抑制类型还是非竞争性抑制类型,结果详见图2。
由图2可知,3组直线均交于纵轴,即反应速率Vmax不变,为0.016 15 (L·min)/mmoL;斜率(米氏常数Km)随蒲桃种子醇提物质量浓度的增大而增大,为典型的竞争性抑制类型。结果提示,蒲桃种子乙醇提取物对α-葡萄糖苷酶抑制作用为可逆竞争性抑制。
2.6 对α-淀粉酶抑制作用的动力学试验
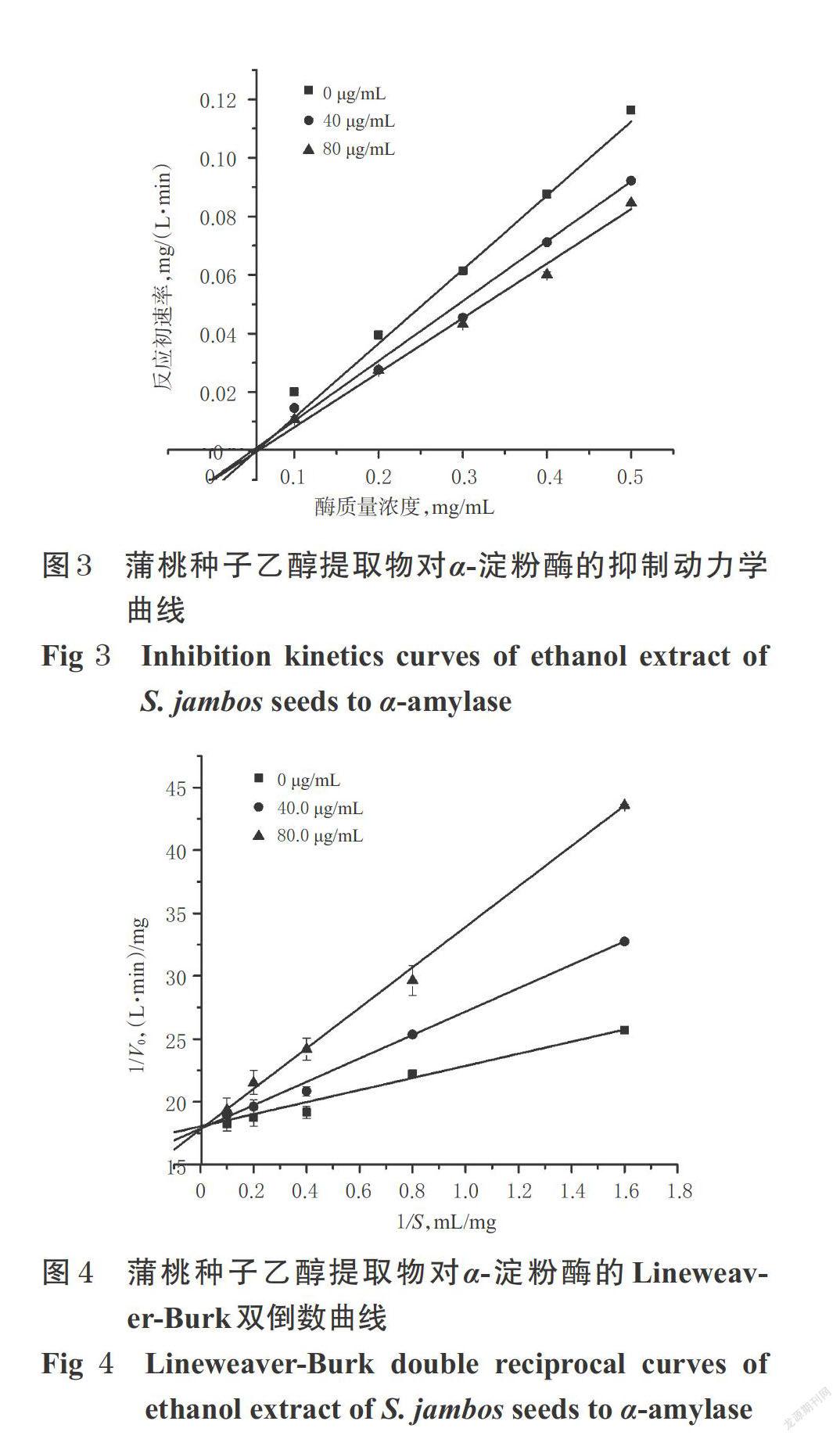
由于蒲桃种子对α-淀粉酶抑制作用顯著强于其他药用部位,因此本研究选用蒲桃种子进行α-淀粉酶抑制作用的动力学试验。参考文献方法[13]并作适当调整,具体如下:固定淀粉酶浓度为1.0%,在不添加(0 μg/mL)和添加蒲桃种子乙醇提取物(质量浓度为40.0、80.0 μg/mL)的条件下,分别测定其在不同α-淀粉酶质量浓度(0.1、0.2、0.3、0.4、0.5 mg/mL)反应体系下的反应初速率,以α-淀粉酶质量浓度(mg/mL)为横坐标、反应初速率mg/(L·min)为纵坐标作图,判断其可逆或不可逆抑制类型,结果见图3。
由图3可知,3组直线均通过原点,且直线的斜率随蒲桃种子乙醇提取物质量浓度的减小而减小,表明蒲桃种子乙醇提取物对α-淀粉酶的抑制类型为可逆性抑制。
在确定其为可逆抑制类型的情况下,固定α-淀粉酶质量浓度为0.6 mg/mL,在不添加(0 μg/mL)和添加蒲桃种子乙醇提取物(质量浓度为40.0、80.0 μg/mL)的条件下,测定其在不同α-淀粉酶溶液质量浓度(0.625、1.25、2.5、5、10 mg/mL)反应体系下的反应初速率,以底物α-淀粉酶浓度的倒数(1/S)为横坐标、反应初速率的倒数 (1/V)为纵坐标绘制Lineweaver-Burk曲线,判断其属于竞争性抑制类型还是非竞争性抑制类型,结果见图4。
由图4可知,3组直线均交于纵轴,即反应速率Vmax不变,为0.056 (L·min)/mg;斜率(米氏常数Km)随抑制剂质量浓度的增大而增大,为典型的竞争性抑制类型。结果表明,蒲桃种子乙醇提取物对α-淀粉酶抑制作用为可逆竞争性抑制。
3 讨论
我国蒲桃资源较为丰富,其中蒲桃种子民间用于防治糖尿病的药用基础深厚,但对蒲桃种子以及蒲桃其他药用部位在抗糖尿病方面的现代药学研究还处于起步阶段,其民间药用科学内涵不明确[14]。然而,国内外学者对其同属植物海南蒲桃(S. hainanense)进行了深入、系统的研究,发现海南蒲桃具有显著的降血糖活性,并从中分离得到一系列降血糖活性成分[15-16]。此外,由著名的植物药公司(意大利Indena公司)研发的一种降血糖专利药物Madeglucyi的主要成分即为海南蒲桃籽提取物[17]。以上研究均提示,蒲桃也有可能存在相似甚至更为丰富的药效物质和生理活性。此外,基于HPLC的α-葡萄糖苷酶抑制活性检测方法是一种更为有效且新颖的方法,可通过调整保留时间将酶促反应产物pNP所对应的色谱峰与药材提取物所含成分对应的色谱峰分开,有效避免药物本身对反应结果的影响,避免假阳性的发生,较于传统的紫外分光光度法,试验结果更为准确可靠[18]。
本研究采用基于HPLC的α-淀粉酶、酵母源α-葡萄糖苷酶和小鼠小肠源α-葡萄糖苷酶体外筛选模型,分别对蒲桃的根、茎、叶、种子、花和果肉6个不同药用部位乙醇提取物的酶抑制活性进行了评价。试验结果显示,蒲桃不同药用部位乙醇提取物均有不同程度的α-葡萄糖苷酶和α-淀粉酶抑制活性。从整体上看,蒲桃种子表现出较强的α-葡萄糖苷酶和α-淀粉酶抑制活性,且明显强于蒲桃其他药用部位(P<0.05),其中对α-葡萄糖苷酶抑制活性优于阳性对照阿卡波糖,对α-淀粉酶抑制活性弱于阳性对照,差异具有统计学意义(P<0.05)。同时,试验选取酶抑制活性最强的蒲桃种子乙醇提取物进行了酶促动力学分析。结果表明,蒲桃种子对α-淀粉酶和α-葡萄糖苷酶抑制类型均为可逆的竞争性抑制。
前期在对蒲桃不同药用部位乙醇提取物抑制酶活性的预试验过程中发现,不同药用部位抑制酶活性的质量浓度范围差异较大,如种子乙醇提取物在12.25 μg/mL时抑制率已达到98.46%,而果肉乙醇提取物在质量浓度为2 400 μg/mL时抑制率仅为51.19%。通过考察不同药用部位抑制率在0~100%的质量浓度范围后,最终确定本研究中各部位样品的质量浓度。另外,试验结果显示蒲桃各药用部位乙醇提取物抑制α-葡萄糖苷酶活性的作用优于阳性对照阿卡波糖,但在体内实验中蒲桃提取物是否具有同样的药效及以其具体的药效成分和作用机制还有待进一步研究。
综上所述,本研究探索性研究了蒲桃各药用部位乙醇提取物对α-葡萄糖苷酶和α-淀粉酶活性的影响,发现蒲桃各部位特别是种子具有良好的降血糖作用,这为蒲桃扩大药用部位及其资源的进一步开发利用提供了理论依据。
参考文献
[ 1 ] CHO NH,SHAW JE,KARURAGA S,et al. IDF diabetes atlas:global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Res Clin Pr,2018.DOI:10.1016/j.diabres.2018.02.023.
[ 2 ] 熊能,韦圣,胡忠策. α-葡萄糖苷酶抑制剂的研究进展和趋势[J].发酵科技通讯,2018,47(1):58-64.
[ 3 ] 许有瑞,伊辉,张可锋,等.瑶药葫芦钻中α-葡萄糖苷酶抑制活性部位的筛选[J].中国药房,2017,28(16):2235- 2237.
[ 4 ] SHOBANA S,SREERAMAY N,MALLESHI NG. Composition and enzyme inhibitory properties of finger millet (Eleusine coracana L) seed coat phenolics:mode of inhibition of α-glucosidase and pancreatic amylase[J]. Food Chem,2009,115(4):1268-1273.
[ 5 ] 賈伟平.中国2型糖尿病防治指南(2017年版)[J].中国实用内科杂志,2018,38(4):292-344.
[ 6 ] 广东省食品药品监督管理局.广东省中药材标准:第一册[M].广州:广东科技出版社,2004:200-201.
[ 7 ] 国家中医药管理局《中华本草》编委会.中华本草:第五册[M].上海:上海科学技术出版社,1999:656-657.
[ 8 ] 张声源,庄远杯,林大都,等.蒲桃枝叶抑制α-葡萄糖苷酶活性部位及其化学成分研究[J].天然产物研究与开发,2018,30(11):1950-1956.
[ 9 ] 张丙云,苏丹,郭涛,等.竹叶椒乙醇提取物对α-葡萄糖苷酶的抑制作用及其机理研究[J].食品工业科技,2015,36(21):345-348.
[10] 邵元元.五倍子没食子酸高效制备及其对α-淀粉酶的抑制作用[D].长沙:湖南农业大学,2014.
[11] 赖小燕,姜泽东,倪辉,等.茶花粉黄酮对α-葡萄糖苷酶抑制作用的研究[J].食品工业科技,2016,37(5):353-357.
[12] 董志超,何际婵,王天群,等.肉桂提取物对α-葡萄糖苷酶活性及糖尿病模型大鼠餐后高血糖的抑制作用[J].中国药房,2013,24(47):4421-4424.
[13] 李波,包怡红,高锋,等.红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用[J].食品工业科技,2015,36(1):63-65.
[14] GHAREEB MA,HAMED MM,ABDEL AH,et al. Extraction,isolation,and caracterization of bioactive compounds and essential oil from Syzygium jambos[J]. Asian J Pharm Clin Res,2017,10(8):184-200.
[15] BALIGA MS,BHAT HP,BANTWAL RVB,et al. Phytochemistry,traditional uses and pharmacology of Eugenia jambolana Lam.(black plum):a review[J]. Food Res Int,2011,44(7):1776-1789.
[16] MUNIAPPAN A,PANDURANGAN SB,SAVARIMUTHU I. Syzygium cumini,a novel therapeutic agent for diabetes:folk medicinal and pharmacological evidences[J]. Complement Ther Med,2013,21(3):232-243.
[17] 时二敏.野生蒲桃枝叶中化学成分的研究[D].贵阳:贵州大学,2015.
[18] 范莉,王业玲,唐丽.天然来源α-葡萄糖苷酶抑制剂筛选方法的研究进展[J].天然产物研究与开发,2016,28(2):313-321,306.
(收稿日期:2019-05-05 修回日期:2019-08-29)
(编辑:林 静)