血竭醇提物对大鼠穿支皮瓣模型存活及PI3K/Akt/eNOS通路的影响
2019-09-10张丽张扬王绪平黄孝闻吴人杰寿旦
张丽 张扬 王绪平 黄孝闻 吴人杰 寿旦



中圖分类号 R285 文献标志码 A 文章编号 1001-0408(2019)23-3252-06
DOI 10.6039/j.issn.1001-0408.2019.23.15
摘 要 目的:研究血竭醇提物对大鼠穿支皮瓣模型存活及PI3K/Akt/eNOS通路的影响。方法:采用只保留穿支血管切断其他血管的方法复制大鼠穿支皮瓣模型,造模成功后,将大鼠分为模型组(外敷,生理盐水)和血竭醇提取物(EESD,血竭素含量为75.08 mg/g)组(外敷,0.21 g/cm2),每组10只,连续敷药7 d,每天1次。敷药7 d后测定各组大鼠穿支皮瓣存活率、皮瓣微血管密度。将人脐静脉内皮细胞(HUVEC)缺氧缺糖16 h后复氧复糖复制HUVEC缺氧缺糖/复氧复糖细胞模型,造模成功后,将细胞分为正常组、模型组和血竭素高、中、低浓度组(2.5、1.0、0.5 μg/mL),于复氧复糖培养24 h后,采用显微镜观察各组细胞的形态,采用MTT法和比色法分别测定各组细胞的活性和细胞中一氧化氮(NO)的含量,采用逆转录-聚合酶链式反应(RT-PCR)和Western blot法检测丝氨酸/苏氨酸激酶(Akt)、磷脂酰肌醇-3-激酶(PI3K)、内皮型一氧化氮合酶(eNOS)mRNA的表达水平,PI3K蛋白的表达以及Akt、eNOS蛋白的磷酸化程度。结果:在大鼠实验中,与模型组比较,EESD组大鼠穿支皮瓣存活率、微血管密度均显著增加(P<0.01)。在细胞试验中,与正常组比较,模型组HUVEC细胞存活率、NO含量,PI3K、Akt、eNOS mRNA的表达水平,PI3K蛋白的表达以及Akt、eNOS蛋白的磷酸化程度均显著降低(P<0.05或P<0.01);与模型组比较,血竭素高、中、低浓度组HUVEC细胞的存活率、NO含量,PI3K、Akt、eNOS mRNA的表达水平,PI3K蛋白的表达以及Akt、eNOS蛋白的磷酸化程度均显著升高(P<0.05或P<0.01)。结论:EESD可提高大鼠穿支皮瓣模型的存活率,其机制可能与激活PI3K/Akt/eNOS通路保护内皮细胞有关。
关键词 血竭醇提物;血竭素;穿支皮瓣;丝氨酸/苏氨酸激酶;磷脂酰肌醇-3-激酶;内皮型一氧化氮合酶
Study on the Effects of Ethanol Extract of Sanguis Draconis on the Survival of Perforating Flap Model in Rats and PI3K/Akt/eNOS Pathway
ZHANG Li1,ZHANG Yang2,WANG Xuping2,HUANG Xiaowen2,WU Renjie2,SHOU Dan1(1.College of Pharmacy, Zhejiang University of TCM, Hangzhou 310053, China;2.Zhejiang Academy of TCM/TCM Research Center, Hangzhou 310007, China)
ABSTRACT OBJECTIVE: To study the effects of ethanol extract of Sanguis Draconis on the survival of perforating flap model in rats and PI3K/Akt/eNOS pathway. METHODS: Perforating flap model was established by cutting off surrounding vessels and keeping one perforator. After modeling, the rats were divided into model group (external use, normal saline) and ethanol extract of Sanguis Draconis (EESD, the content of dracorhodin was 75.08 mg/g) group (external use, 0.21 g/cm2), with 10 rats in each group. They were given relevant medicine for consecutive 7 days, once a day. The flap survival rate and flap microvessel density were determined after given relevant medicine 7 days. Human umbilical vein endothelial cells (HUVECs) were reoxygenated and glycoconjugated 16 h after hypoxia and hypoglycemia to establish oxygen-glucose deprivation/oxygen-glucose recovery model of HUVECs. After modeling, model cells were divided into normal group, model group, dracorhodin high-concentration, medium- concentration and high-concentration groups (2.5, 1.0, 0.5 μg/mL). After reoxygenated and glycoconjugated for 24 h, cells morphology was observed by microscope; cell viability and the content of NO were detected by MTT assay and colorimetry. mRNA expression of Akt, PI3K and eNOS, PI3K protein expression, the phosphorylation of Akt and eNOS protein were determined by RT-PCR and Western blot assay. RESULTS: In rat experiment, compared with model group, flap survival rate and microvessel density of rats were increased significantly in EESD group (P<0.01). In cell experiment, compared with normal group, the survival rate of HUVEC, NO content, mRNA expression of PI3K, Akt, eNOS,PI3K protein expression, the phosphorylation of Akt and eNOS protein were decreased significantly (P<0.05 or P<0.01). Compared with model group, dracorhodin high-concentration, medium-concentration and high-concentration groups survival rate of HUVEC cells, NO content, mRNA expression of PI3K, Akt and eNOS, PI3K protein expression, the phosphorylation of Akt and eNOS protein were increased significantly (P<0.05 or P<0.01). CONCLUSIONS: The survival rate of perforating flap model in rat can be increased by treating with EESD, the mechanism of which may be associated with the activation of PI3K/Akt/eNOS pathway to protect endothelial cells.
KEYWORDS Ethanol extract of Sanguis Draconis; Dracorhodin; Perforating flap; Akt; PI3K; eNOS
小腿远端及足踝部创面缺损常使得骨骼、肌腱外露,常采用植皮进行处理,但是植皮不易成活,因此临床上常应用皮瓣移植修复,一般来说术后功能恢复良好。穿支皮瓣是指仅以管径细小的皮肤穿支血管供血的皮瓣,是皮瓣移植修复中的一种方法,具有切取范围小,不切断肌肉、神经,不损伤主干血管,安全性高等优点,广泛应用于创伤修复、烧伤、软组织缺损重建等[1]。然而,穿支血管一般管径细小,供区面积有限,使其在体表大面积缺损修复中的应用受到限制,皮瓣远端易发生缺血性坏死[2],导致患者需要再次手术,延长住院时间、增加治疗费用[3-4]。因此,提高患者皮瓣存活率,对改善穿支皮瓣临床应用具有重要意义。相关研究表明,穿支皮瓣远端组织血液灌注不充分及缺血再灌注损伤是导致皮瓣坏死的主要原因[5]。缺血再灌注时,释放过多的氧自由基,导致脂质过氧化,进而引起细胞损伤,导致皮瓣缺血区域持续性损伤[6]。因此,抑制氧自由基是促进穿支皮瓣存活的主要策略。中药血竭在活血散瘀、止血、止痛和生肌敛疮等方面具有确切疗效,血竭素是其中主要有效成分;现代研究证实,血竭具有改善局部血循环、清除氧自由基、抑制血小板聚集等多种药理活性[7-8]。血竭素可通过促进血管内皮生长因子表达,诱导血管生成,提高组织供氧,加快创面愈合[9]。
目前,血竭及血竭素对穿支皮瓣作用的研究较少,本研究通过复制大鼠穿支皮瓣模型,术后给予血竭醇提物(EESD),研究其对大鼠穿支皮瓣存活以及微血管密度的影响。在血管内壁的形成过程中,覆盖在血管内腔表面的血管内皮细胞具有血管收缩和舒张以及血管生成等生物学功能,而人脐静脉内皮细胞(HUVEC)是在进行血管内皮细胞试验时常选用的细胞模型[10]。因此,本研究也复制HUVEC缺氧缺糖/复氧复糖细胞模型,并给予血竭素,然后检测HUVEC细胞活性、一氧化氮(NO)含量和丝氨酸/苏氨酸激酶(Akt)、磷脂酰肌醇-3-激酶(PI3K)、内皮型一氧化氮合酶(eNOS)mRNA表达以及PI3K、Akt、磷酸化Akt(p-Akt)、eNOS、磷酸化eNOS(p-eNOS)蛋白表达,探究血竭中主要有效成分血竭素对PI3K/Akt/eNOS通路的影响,以期为血竭的临床应用提供参考。
1 材料
1.1 仪器
CO2培养箱(美国Thermo Scientific公司);ECLIPSE TS100-F倒置显微镜 (日本Nikon公司);MRZ14M010高速冷冻离心机(美国Beckman公司);SpectraMax190多功能酶标仪(上海美谷分子仪器有限公司);ChemiDoc XRS凝胶成像仪(美国Bio-Rad公司);ABI7500实时荧光定量聚合酶链式反应(PCR)仪(美国Applied Biosystems公司);Periflux System 5000激光多普勒仪(瑞典Perimed公司)。
1.2 药品与试剂
血竭(杭州华东医药有限公司,批号:20180314)经浙江省中医药研究院俞忠明副研究员鉴定为棕榈科植物麒麟竭(Daemonorops draco Bl.)果实的树脂;EESD(浙江省中医药研究院自制,其中血竭素含量为75.08 mg/g);血竭素高氯酸盐(天然血竭素的一种人工合成替代品,中国食品药品检定研究院,批号:180922,纯度:≥99%);NO试剂盒(南京建成生物科技有限公司,批号:20190122);MTT(安徽Biosharp公司,批号:KGA312);BCA蛋白定量试剂盒(江苏凯基生物技术股份有限公司,批号:KGP902);Trizol试剂(美国Ambion公司,批号:213408);二甲基亚砜(DMSO,美国Sigma-Aldrich公司,批号:WXBC1590V);定量PCR试剂盒 (杭州博日科技有限公司,批号:BSB03L1);PCR引物(上海生工生物公司); 甘油醛-3-磷酸脱氢酶(GAPDH)抗体(批号:ab6721)、PI3K(批号:ab32089)、Akt(批号:ab32089)、p-Akt (批号:ab32505)、p-eNOS(批号:ab184154)、eNOS(批号:ab199956)、辣根过氧化物酶标记的山羊抗兔免疫球蛋白G(批号:ab6721)抗体均购自英国Abcam公司。
1.3 动物
SD大鼠,♂,体质量(250±20) g,购于浙江省动物实验中心,动物实验许可证号:SYXK(浙)2019-0010。
1.4 细胞
HUVEC細胞由中国科学院上海细胞库提供。
2 方法
2.1 大鼠实验
2.1.1 造模、给药与分组 取20只SD大鼠,腹腔注射40 mg/kg戊巴比妥钠进行麻醉处理,于大鼠腹部剑突下方1 cm处,在下缘连接两个髂前上棘处设计三角形皮瓣,掀起皮瓣后保留上腹血管和穿支血管,切断其他血管,原位缝合皮瓣。采用激光多普勒仪检测皮瓣血流,当切断血管位置的灌流量≤10 PU,上腹血管和穿支血管灌流量≥30 PU表明大鼠穿支皮瓣模型造模成功[11]。造模后,将大鼠分为模型组(外敷,生理盐水)和EESD组(外敷,0.21 g/cm2,根据临床外用剂量换算而得),每组10只,连续敷药7 d,每天1次。
2.1.2 大鼠穿支皮瓣存活率测定 敷药后,肉眼观察各组大鼠穿支皮瓣的成活情况,包括皮瓣的颜色、肿胀程度及坏死面积等。在敷药后第3 d和第7 d,拍摄各组大鼠穿支皮瓣的图片,并用Image-Pro Plus 6.0 软件计算各组大鼠穿支皮瓣存活率,穿支皮瓣成活率(%)=穿支皮瓣存活面积/皮瓣总面积×100%。
2.1.3 穿支皮瓣病理学检查和微血管密度检测 敷药7 d后,各组大鼠腹腔注射过量戊巴比妥钠处死。取各组大鼠腹部穿支皮瓣组织于4%多聚甲醛中固定24 h后,常规石蜡包埋,切片,苏木精-伊红(HE)染色,然后于光学显微镜下(×200)分别观察各组大鼠穿支皮瓣的成纤维细胞增生、中性粒细胞浸润、肉芽组织生长的情况;每张切片随机选取3个不同视野进行微血管断面计数,以微血管断面平均数作为微血管密度。
2.2 细胞试验
2.2.1 HUVEC细胞缺氧缺糖/复氧复糖模型的建立及分组 当HUVEC细胞生长密度达80%~85%时,更换成DMEM无糖培养基,放入厌氧盒内进行缺氧培养16 h后,加入正常细胞培养液,放入37℃ 5%CO2培养箱中培养24 h后,即建立HUVEC细胞缺氧缺糖/复氧复糖模型[12]。本研究将细胞分为正常组、模型组和血竭素高、中、低浓度组(2.5、1.0、0.5 μg/mL);正常组不加药正常培养,模型组缺糖缺氧培养16 h后,复糖复氧培养24 h,血竭素高、中、低浓度组细胞缺糖缺氧培养16 h后,按上述剂量给药,再复糖复氧培养24 h。
2.2.2 MTT法检测HUVEC细胞存活率 各组细胞(每组平行6孔)复糖复氧培养24 h后,每孔加入10 μL MTT溶液,置于CO2培养箱中继续培养4 h后,弃去MTT及培养基,再加入200 μL DMSO,振荡 10 min后,置于酶标仪,在490 nm波长下测定吸光度,并计算细胞存活率,细胞存活率(%)=(试验组吸光度/正常组吸光度)×100%。
2.2.3 血竭素对HUVEC细胞中NO含量的影响 取对数生长期的HUVEC细胞,以每孔5×105 mL-1接种于96孔培养板中,分为正常组、模型组和血竭素高、中、低剂量组,每组平行6孔,按“2.2.1”项下方法进行缺氧缺糖/复氧复糖处理,然后取各组细胞培养液于1.5 mL离心管中,根据NO试剂盒说明书操作方法检测细胞上清液中的NO含量。
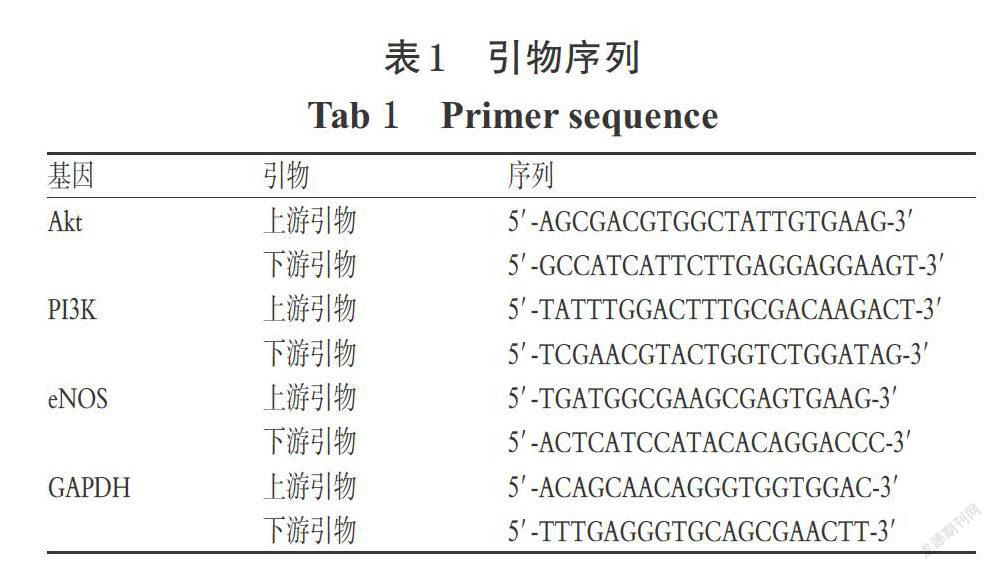
2.2.4 Akt、PI3K、eNOS的mRNA表达检测 取对数生长期的HUVEC细胞,以每孔5×105 mL-1接种于6孔培养板中,分为正常组、模型组和血竭素高、中、低浓度组,每组平行6孔,按“2.2.1”项下方法进行缺氧缺糖/复氧复糖处理后,按Trizol说明书提取各组细胞的总RNA,再按照逆转录试剂盒说明书进行反转录。荧光定量PCR反应扩增程序为94 ℃ 2 min;94 ℃ 10 s,60 ℃ 15 s,72 ℃ 30 s;共40个循环。循环结束后绘制熔融曲线,并用2-ΔΔct法分析数据。引物序列见表1。
2.2.5 Western blot法检测Akt、PI3K、eNOS、p-Akt、p- eNOS蛋白的表达 取對数生长期的HUVEC细胞,以每孔5×105 mL-1接种于6孔培养板中,分为正常组、模型组和血竭素高、中、低浓度组,每组平行6孔,按“2.4”项下方法进行缺氧缺糖/复氧复糖处理后,收集各组细胞,裂解,提取细胞总蛋白,BCA法测定蛋白浓度,变性5 min,每组取蛋白20 μg,于10%聚丙烯酰胺凝胶电泳中分离蛋白,再转移至聚偏二氟乙烯膜,室温下,5%BSA封闭0.5 h,分别加入Akt、p-Akt、PI3K、eNOS、p-eNOS一抗 (1 ∶ 1 000稀释),4 ℃孵育过夜,次日加二抗(1 ∶ 2 000稀释)室温孵育1 h,PBS洗涤3次,用化学发光底物试剂检测,采用Image Lab软件测定蛋白灰度值对蛋白进行定量分析,并以p-Akt/Akt、p-eNOS/eNOS表示相应蛋白的磷酸化程度。
2.3 统计学方法
采用SPSS 22.0软件对数据进行分析。所有数据均以x±s的形式表示,采用单因素方差分析进行组间比较。P<0.05表示差异有统计学意义。
3 结果
3.1 大鼠实验结果
3.1.1 EESD对大鼠穿支皮瓣模型存活的影响结果 敷药后第1 d,2组大鼠穿支皮瓣均有不同程度的肿胀,皮瓣远端区域呈深紫色,无明显坏死;敷药后第3 d,2组大鼠穿支皮瓣出现局灶性坏死伴充血,且颜色发黑;敷药后第 7 d,2组大鼠的穿支皮瓣坏死部位开始融合、结痂和硬化,针刺无流血,坏死和存活部位之间的界限稳定,存活部位毛发开始生长。与模型组比较,敷药后第3、7 d,EESD组的穿支皮瓣存活率显著升高(P<0.01)。各组大鼠穿支皮瓣存活率测定结果见表2。
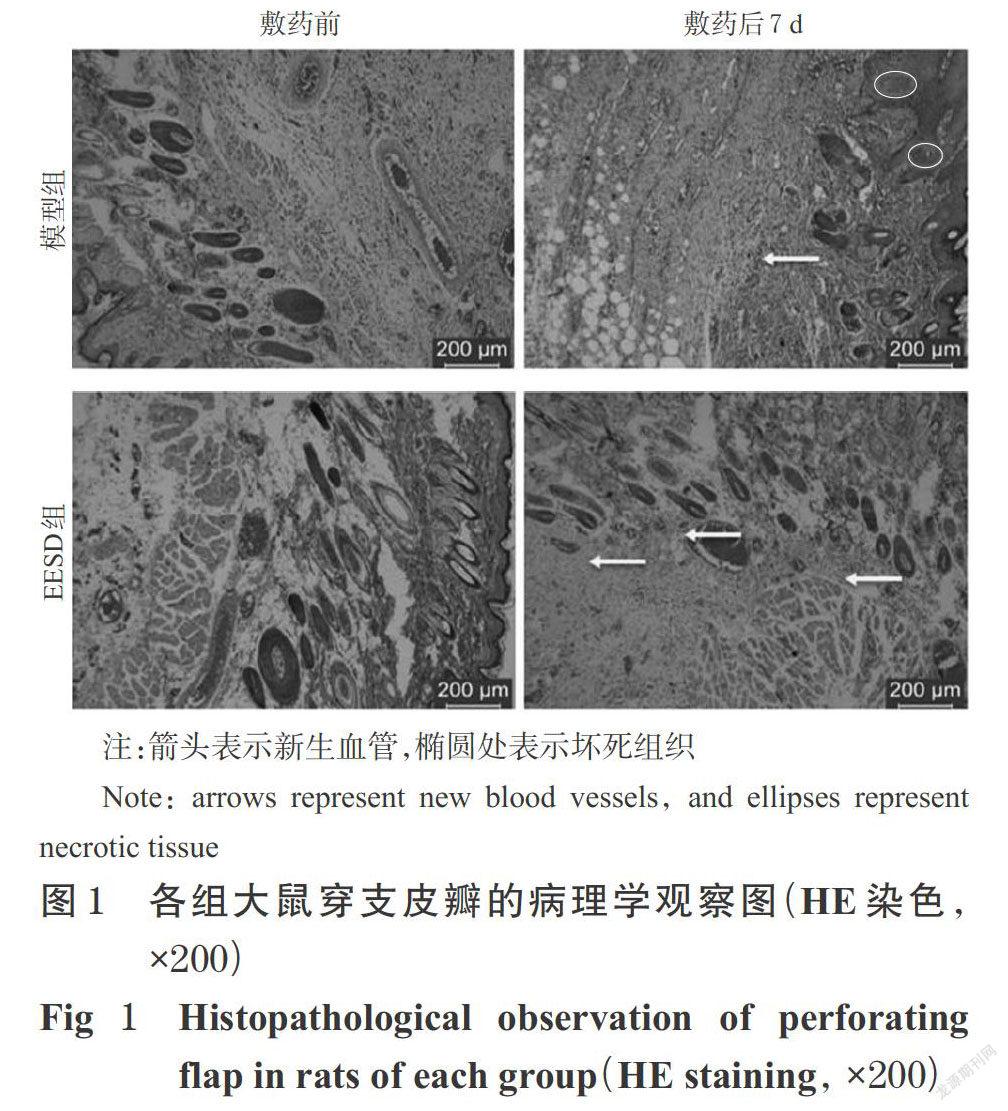
3.1.2 各组大鼠穿支皮瓣病理学检查及微血管密度检测 各组大鼠穿支皮瓣病理学敷药后第7 d,观察各组大鼠穿支皮瓣的HE染色切片结果发现,与模型组[微血管密度为(12.09±2.30)个/mm2]比较,EESD组[微血管密度为(28.56±2.33)个/mm2]成纤维细胞增多,肉芽组织较薄,弥漫性中性粒细胞浸润减少,毛细血管扩张,组织水肿和炎性细胞减少,微血管密度显著增加(P<0.05)。各组大鼠穿支皮瓣病理学观察图见图1。
3.2 细胞试验结果
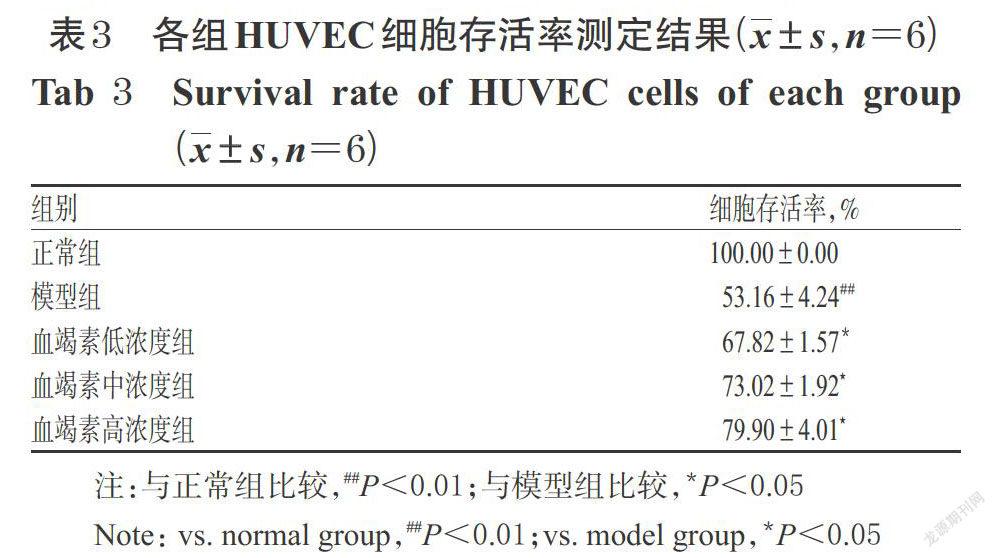
3.2.1 各组HUVEC细胞存活率检测结果 与正常组比较,模型组HUVEC细胞存活率显著降低(P<0.01);与模型组比较,血竭素高、中、低浓度组HUVEC细胞存活率显著升高(P<0.05),且随着给药浓度的增加,细胞存活率增加。各组HUVEC细胞存活率测定结果见表3。
3.2.2 各组HUVEC细胞中NO含量的检测结果 与正常组比较,模型组HUVEC细胞中的NO含量显著降低 (P<0.01);与模型组比较,血竭素高、中、低浓度组HUVEC细胞中NO含量显著升高(P<0.01),且随给药浓度的增加,NO含量增加。各组HUVEC细胞中NO含量的测定结果见表4。
3.2.3 各组HUVEC细胞中PI3K、Akt和eNOS mRNA表达的检测结果 与正常组比较,模型组HUVEC细胞中PI3K、Akt、eNOS mRNA的表达水平显著降低(P<0. 05);与模型组比较,血竭素高、中、低浓度组HUVEC细胞中PI3K、Akt、eNOS mRNA的表达水平均显著升高(P<0.05)。各组HUVEC细胞中PI3K、Akt、eNOS mRNA的表达水平检测结果见图2。
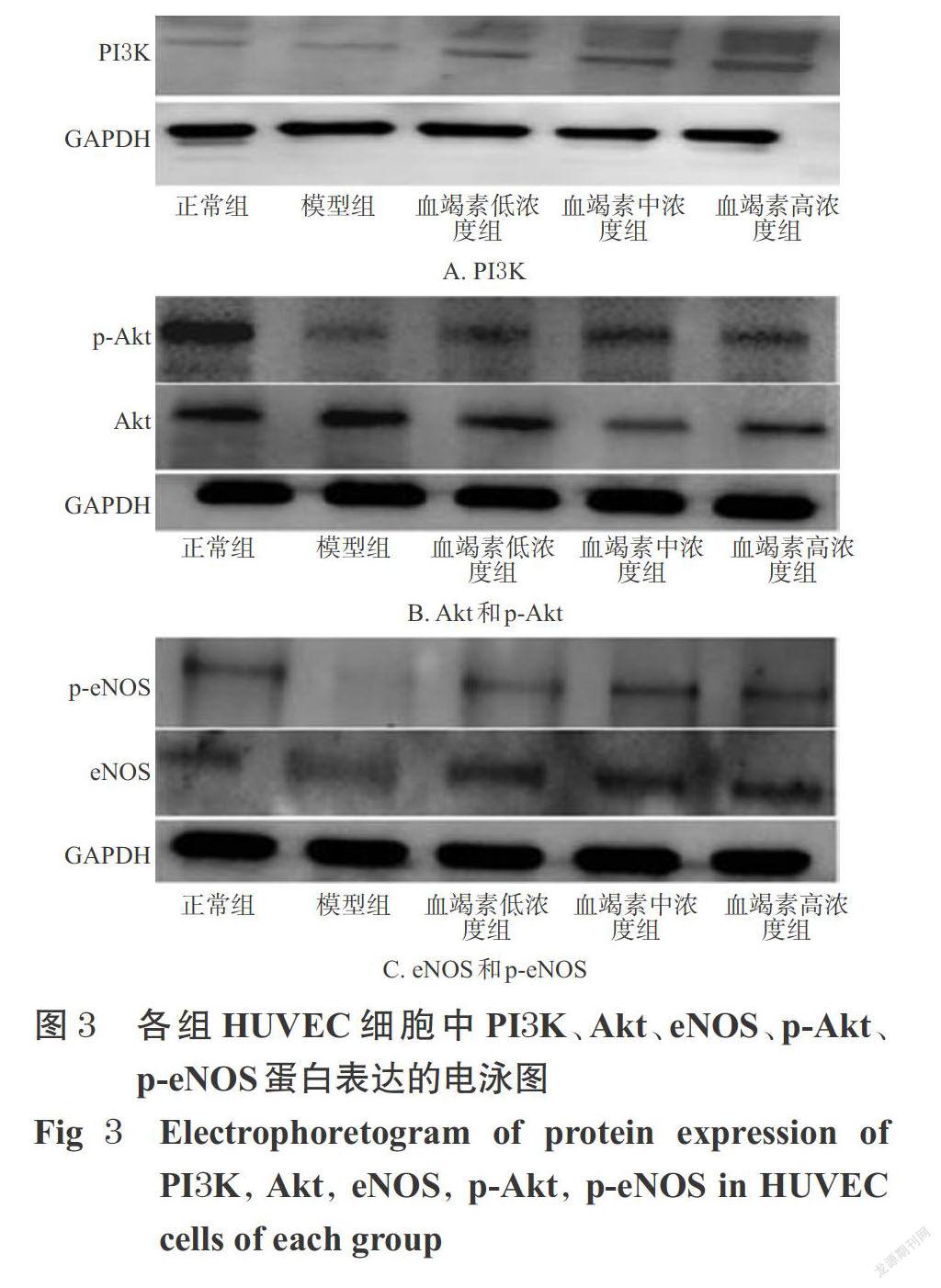
3.2.4 各组HUVEC细胞中PI3K、Akt、eNOS、p-Akt、p-eNOS蛋白表达结果 与正常组比较,模型组HUVEC细胞中PI3K蛋白的表达以及Akt、eNOS蛋白的磷酸化程度均显著降低(P<0.05);与模型组比较,血竭素高、中、低浓度组HUVEC细胞PI3K蛋白的表达以及Akt、eNOS蛋白的磷酸化程度均显著升高(P<0.05)。各组HUVEC细胞中PI3K、Akt、eNOS、p-Akt、p-eNOS蛋白表达的电泳图见图3,定量分析结果见图4。
4 讨论
血竭是由棕榈科植物麒麟竭的树脂经加工制成的,主要成分为血竭素[13-14]。本试验前期采用95%乙醇提取、浓缩,制备EESD,并采用血竭素作为质控指标,经检测血竭醇提物中血竭素的含量为75.08 mg/g。作为血竭中的主要活性成分,血竭素具有改善血液循环,促进血管增生等作用[15],但血竭素单体的存在形式不稳定,易被还原,通常以盐的形式存在,血竭素高氯酸盐为血竭中活性成分血竭素的稳定态,因此,在研究血竭素对内皮细胞的保护作用时,选取血竭素高氯酸盐作为细胞试验的受试药物。
穿支皮瓣坏死主要发生在远端潜在区,远端皮瓣无法获得足够的氧气和营养物质,进而引起皮瓣坏死[16]。本研究动物实验中模型组和EESD组在给药前期均发生穿支皮瓣远端坏死的情况,但EESD给药7 d后,EESD组穿支皮瓣存活率显著高于模型组。缺血再灌注损伤和微循环功能障碍是阻碍穿支皮瓣存活的主要原因,缺血再灌注后产生大量活性氧(ROS),破坏微循环,从而引起内皮细胞肿胀[17]。本研究提示,EESD可通过加速血管形成来改善穿支皮瓣的存活。
血管内皮细胞是血流和血管之间的单层扁平细胞,受损后内皮性NO释放减少[18]。NO是细胞和细胞间重要的信号传导因子,内皮性NO可减少ROS的产生,抑制脂质过氧化。此外,NO也可抑制血小板黏附和聚集,抑制黏附分子和趋化因子的表达以及减少炎症细胞浸润[19-20],对内皮细胞起保护作用。相关研究表明,抑制eNOS可消除NO对缺血再灌注损伤的保护作用,且该保护作用与PI3K/Akt信号通路引起的eNOS上调相关[21-22]。本研究细胞试验结果显示,HUVEC细胞缺氧缺糖后NO含量明显减少,给予血竭素后,HUVEC细胞中的NO含量增加;提示血竭素能够通过抗氧化作用,发挥其对HUVEC缺氧缺糖损伤细胞的保护作用。Western blot结果也显示,HUVEC缺氧缺糖后PI3K蛋白表达下降,Akt、eNOS蛋白的磷酸化程度降低,而给予血竭素后Akt,eNOS磷酸化程度显著升高(P<0.05)。
综上所述,EESD可有效促进穿支皮瓣新生血管形成,改善穿支皮瓣的活存率。该过程可能与其中的有效成分血竭素激活PI3K/Akt/eNOS信号通路,促進NO生成,进而维持内皮细胞正常功能密切相关。本研究可为中药血竭促进皮瓣移植存活的临床应用提供新的思路和治疗策略。
参考文献
[ 1 ] MACIEL-MIRANDA A,MORRIS SF,HALLOCK GG. Local flaps,including pedicled perforator flaps:anatomy,technique,and applications[J]. Plast Reconstr Surg,2013,131(6):896-911.
[ 2 ] SHI YN,LIN H,CAO JK,et al. Botulinum toxin type A attenuates apoptosis in human dermal microvascular endothelial cells exposed to an in vitro model of ischemia/reperfusion injury[J]. Transplant Proc,2019,51(3):966- 971.
[ 3 ] QING L,WU P,LIANG J,et al. Use of flow-through anterolateral thigh perforator flaps in reconstruction of complex extremity defects[J]. J Reconstr Microsurg,2015,31(8):571-578.
[ 4 ] 芮永军.丹参酮ⅡA对大鼠背部穿支皮瓣成活影响的实验研究[D].苏州:苏州大学,2018.
[ 5 ] LIN R,CHEN H,CALLOW D,et al. Multifaceted effects of astragal loside Ⅳ on promotion of random pattern skin flap survival in rats[J]. Am J Transl Res,2017,9(9):4161-4172.
[ 6 ] WANG L,ZHOU ZW,YANG LH,et al. Vasculature characterization of a multiterritory perforator flap:an experimental study[J]. J Reconstr Microsurg,2017,33(4):292-297.
[ 7 ] HAO HZ,HE AD,WANG DC,et al. Antiplatelet activity of loureirin A by attenuating Akt phosphorylation:in vitro studies[J]. Eur J Pharmacol,2015,746(32):63-69.
[ 8 ] LI C,ZHANG Y,WANG Q,et al. Dragon’s blood exerts cardio-protection against myocardial injury through PI3K- Akt-mTOR signaling pathway in acute myocardial infarction mice model[J]. J Ethnopharmacol,2018,227(5):279-289.
[ 9 ] JIANG W,QIAO L,LIU L,et al. Dracorhodin perchlorate accelerates cutaneous wound healing in wistar rats[J]. Evid Based Complement Alternat Med,2017.DOI:10.1155/2017/8950516.
[10] 李宏力,李玉文,刘天龙,等. Z-没药甾酮对急性血瘀模型大鼠凝血和血管内皮功能的改善作用及其机制研究[J].中国药房,2016,27(19):2615-2617.
[11] 魏建伟,董忠根.穿支皮瓣的动物模型及实验研究进展[J].中国临床解剖学杂志,2016,34(6):713-715.
[12] 王海燕,周惠芬,何昱,等.脑心通胶囊对缺糖缺氧损伤脑微血管内皮细胞的保护作用及其机制[J].中草药,2018,49(14):3318-3325.
[13] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:142.
[14] 梁伟玲,张钦德,吴君.正交试验优化麒麟血竭中血竭素的超声提取工艺[J].中国生化药物杂志,2015,35(4):158-160.
[15] LI F,JIANG T,LIU W,et al. The angiogenic effect of dracorhodin perchlorate on human umbilical vein endothelial cells and its potential mechanism of action[J]. Mol Med Rep,2016,14(2):1667-1672.
[16] 李文波.一氧化氮对大鼠背部跨区皮瓣ChokeⅡ区影响因素的实验研究[D].兰州:甘肃中医药大学,2018.
[17] 王彦进.磁性前列地尔脂微球靶向治疗大鼠腹部皮瓣缺血灌注的基础研究[D].青岛:青岛大学,2017.
[18] JENSEN HA,MEHTA JL. Endothelial cell dysfunction as a novel therapeutic target in atherosclerosis[J]. Expert Rev Cardiovasc Ther,2016,14(9):1021-1033.
[19] SAINI V,BHATNAGAR MK,BHATTACHARIEE J. Endothelial nitricoxide synthase Glu298Asp (G894T) gene polymorphism in coronary artery disease patients with type 2 diabetes mellitus[J]. Diabetes Metab Syndr,2012,6(2):106-109.
[20] 周彬,余舒杰,劉定辉,等.人参皂苷Rb1通过Caveolin-1/e-NOS/NO通路抗人脐静脉内皮细胞衰老[J].中药材,2019,42(1):190-196.
[21] BEJAOUI M,PANATAZI E,FOLCH-PUY E,et al. Protective effect of intravenous high molecular weight polyethylene glycol on fatty liver preservation[J]. Biomed Res Int,2015:794287.
[22] ZHANG X,HUANG LF,HUA L,et al. Resveratrol protects myocardial apoptosis induced by ischemia-reperfusion in rats with acute myocardial infarction via blocking P13K/AKT/e-NOS pathway[J]. Eur Rev Med Pharmacol Sci,2019,23(4):1789-1796.
(收稿日期:2019-07-10 修回日期:2019-08-15)
(编辑:唐晓莲)