婴幼儿舌甲状舌管囊肿44例临床特点和治疗效果分析
2019-08-06秦凤花谭乐恬倪祎华许政敏
秦凤花 谭乐恬 倪祎华 许政敏
(复旦大学附属儿科医院耳鼻咽喉头颈外科 上海 201102)
甲状舌管囊肿(thyroglossal duct cysts,TGDC)是一种先天性、发育性囊肿,源于甲状舌管的残余上皮,由于胚胎期甲状腺形成过程中的甲状舌管退化不全所致。一般发生在颈部,通常表现为颈部舌甲膜处可压缩性包块。位于舌部(舌盲孔处)的TGDC极为少见,称为舌甲状舌管囊肿(lingual TGDC,LTGDC),发生率为0.6%~3%[1],多发生于小儿[2]。囊肿位于舌根后方,常突出于喉咽腔,可导致喉阻塞,出现吸气性呼吸困难,伴有喉软化可反复出现喉鸣,易误诊为先天性喉喘鸣。现将我院近6年诊治的44例小儿LTGDC的临床特点和治疗效果进行总结分析,报道如下。
1 资料与方法
1.1 资料 回顾分析2010年1月~2016年12月我院耳鼻喉科、新生儿科、新生儿监护病房(NICU)、儿科重症监护病房(PICU)收治的经手术治疗的44例LTGDC患儿的临床资料。其中男性26例、女性18例;新生儿4例,年龄0.73~319 d,平均(84.38±75.78)d。临床症状以就诊时患儿家属的第一主诉为主。44例LTGDC患儿中,22例(50%)表现为喉鸣、喉中有音;8例(18.2%)表现为明显饮水、饮奶呛咳、误吸,导致反复吸入性肺炎,肺吸入检查阳性7例;4例(9.1%)表现为明显的喂养困难,如反复吐奶、吞咽困难、体重不增或下降等;6例(13.6%)表现为不同程度的吸气性呼吸困难、发绀,哭闹或哺乳时加重,严重时有呼吸暂停甚至窒息,或哭声较弱,但均无声音嘶哑,其中2例因呼吸困难、窒息行气管插管时发现舌根新生物,当地紧急喉镜下作舌根囊肿穿刺后转入我院,1例入NICU,1例入耳鼻喉科普通病房;另伴有打呼2例;声嘶1例(心脏彩超发现卵圆孔未闭);无任何症状体检发现1例。
1.2 方法
1.2.1 治疗前检查 在患儿清醒状态下行电子纤维喉镜检查。常规表面麻醉,使用电子鼻咽喉镜经鼻腔进入,见囊肿位于舌根,光滑、苍白。排除会厌囊肿、劈裂囊肿、口咽囊肿等病变。观察会厌、劈裂的结构、活动度,有无喉软化。
所有患儿均行喉部CT、放射性核素检查,喉部CT检查为边界清楚的类圆形低密度影,对于未完全突出至喉咽腔的、喉镜下容易漏诊的LTGDC非常重要(图1);放射性核素检查排除异位甲状腺。反复误吸患儿予以核素肺吸入检查,辅助评估误吸。
1.2.2 治疗方法 非手术治疗。所有误吸患儿,术前、术后为防止反复误吸和肺炎的发作,给予患儿足够的营养支持,包括抗反流治疗,使用质子泵抑制剂;鼻饲喂养;饮食指导。杓间隙修补术后予以严格的抗胃食管反流处理。
手术治疗。全身麻醉,44例LTGDC均经口切除,术中切除游离面囊壁,开放基底部至舌骨软骨膜。囊肿切除后常规行纤维喉气管镜(microlaryngeal bronchoscope,MLB)检查。静脉复合全身麻醉,保留自主呼吸,局部使用1%利多卡因表面麻醉,麻醉喉镜辅助下行MLB检查,发现喉软化35例,均予以声门上成形术。

图1. LTGDC喉部CT平扫,舌根后方可见类圆形低密度影(箭头),边界光滑、清楚
患儿使用艾克松0/2.7 mm/145 mm 0°鼻内镜检查,通过探针探查杓间隙的深度,判断有无杓间隙深、喉裂等。
LTGDC经口切除后常规行气管内插管(endotracheal tube,ETT)透气试验,根据Cotton-Myer分级进行声门下狭窄的评估。术中杓间隙深予以手术修补。
1.3 治疗后评估和检查 疗效判定标准:术后根据误吸、喘鸣、呼吸困难等症状改善情况进行临床评估。主观评分为0~3分。0分:症状无改善(无效);1分:症状略改善(有效);2分:症状明显改善(显著有效);3分:症状消失(治愈),其中1或2分合并为有效。
随访评估:所有患儿术后1周、1个月、3个月、1年常规行电子纤维喉镜检查,观察术腔情况,有无囊肿复发,有无再次喉软化表现等;另包括病史询问、生长发育评估等。
2 结果
2.1 术中所见和处理 术中发现9例单纯LTGDC,予以手术切除。35例伴喉软化,其中Ⅰ型喉软化5例,合并1例杓间隙深、1例声门下狭窄(subglottic stenosis, SGS);Ⅱ型喉软化25例,合并2例Ⅰ度SGS、1例Ⅱ度SGS和4例杓间隙深;Ⅲ型喉软化5例,合并1例Ⅰ度SGS和1例杓间隙深。气管镜检查未发现明显的气管软化。所有44例囊肿均予以切除,喉软化均予以声门上成形术,其中双侧声门上成形术20例,单侧15例。杓间隙深予以手术修补,SGS未予特殊处理。术中情况详见表1。
术后3例拔管后直接回病房,整夜注意呼吸,37例带气管插管入PICU,4例入NICU。术后拔管时间为2~144 h,平均(38.21±26.99)h。

表1 35例LTGDC伴有喉软化的喉气管镜检查和ETT透气试验结果(n)
术后12~72 h内并发术腔出血3例,均返回手术室止血,未再出现二次出血。
2.2 术后病理 44例囊肿切除术后,囊内容物19例为黏液性,25例为浆液性。病理学检查可见囊肿内壁衬以复层鳞状或柱状上皮细胞,间质黏液样变,可有少量炎细胞浸润,囊内含有淡黄色液体。结合病史、体征及病理结果基本诊断为LTGDC。
2.3 治疗效果 22例喉喘鸣患儿,19例术后喉喘鸣完全消失,3例喘鸣减轻,治愈率达86.4%。8例误吸、呛咳患儿中肺吸入阳性7例,均有杓间隙深,予以手术修补、抗酸治疗后,6例误吸、呛咳完全消失;1例抗反流治疗半年,呛咳明显减轻;1例因合并神经肌肉疾病,术后仍有顽固性呛咳。6例喉梗阻(呼吸急促、发绀、吸凹征)患儿,术中发现1例Ⅱ度获得性SGS,术后抗反流治疗2周后,呼吸不适明显减轻,顺利拔管,其余5例术后呼吸基本恢复正常。4例喂养困难患儿,术前予以鼻饲喂养,术后3例拔管,吞咽不适、呕奶症状明显减轻,饮食基本正常;1例因神经肌肉疾病,喂养困难无改善,未拔管。2例打鼾患儿,术后1例打鼾症状基本消失,1例未见明显改善,鼻内镜检查发现变应性鼻炎伴腺样体肥大。卵圆孔未闭患儿心脏手术后声嘶稍有好转,未影响呼吸。治疗效果详见表2。图2为1例患者治疗前后的电子喉镜下表现。
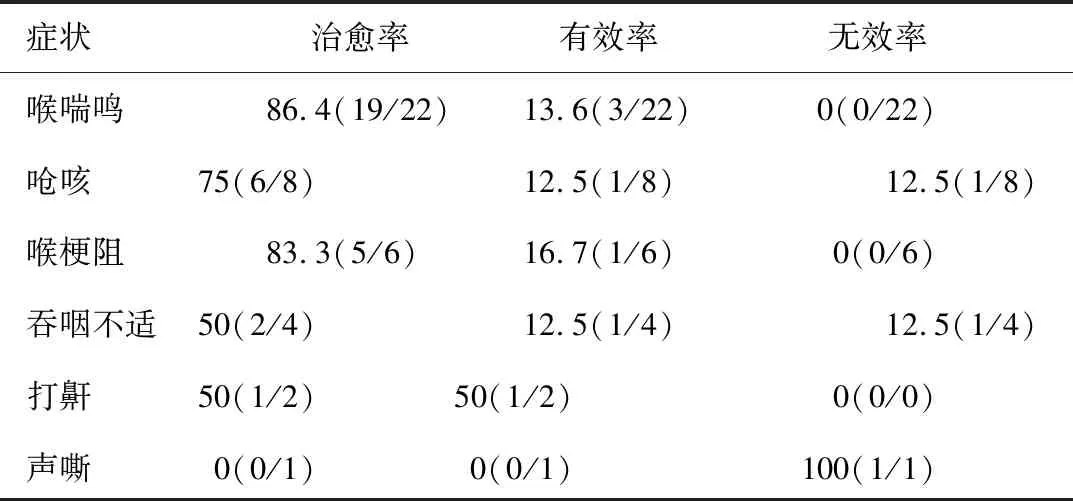
表2 44例LTGDC治疗效果[n(%)]

图2. 患儿男性,4月龄时因出生后反复喉喘鸣2月余就诊,电子喉镜发现LTGDC,行手术切除 A.术前;B.术后1周;C.术后1个月
3 讨论
舌根病变根据来源可分为先天性血管来源和非血管来源、感染和良恶性肿瘤。非血管来源包括舌甲状腺、甲状舌管囊肿,皮样、表皮样囊肿,脂肪瘤等;血管来源包括淋巴管、血管畸形等[3]。新生儿LTGDC又称为先天性舌根囊肿,为甲状舌管发育异常(囊肿样变)所致。胚胎发育过程中,甲状腺移行而甲状舌管残留可产生TGDC。囊肿可出现在移行过程的任何部位,60%~80%位于舌骨附近,只有2%~3%位于舌根旁[4-5]。
3.1 LTGDC的临床表现 LTGDC多由舌盲孔突向咽腔,像活瓣一样阻塞喉部,可导致会厌向声门区推压,产生极为严重的呼吸及进食困难。临床检查可见舌根正中薄壁囊肿突出。囊肿较小时,可无任何临床症状或仅表现为单纯性喉喘鸣;囊肿较大时可引起患儿喂养困难、呼吸窘迫甚至窒息死亡[6-7]。之前文献报道均是小样本,本研究44例婴幼儿LTGDC作为一个相对大的样本量,发现就诊患儿临床特点大部分表现为喉喘鸣(50%)、反复吸入性肺炎(18.2%)、呼吸困难(13.6%)等呼吸道症状和喂养困难(9.1%)等消化道症状,其他如打鼾等,临床表现与之前文献报道类似。
3.2 LTGDC的诊断与鉴别 新生儿先天性LTGDC与成人因炎症或机械刺激使黏液腺管阻塞导致黏液潴留而形成的舌根囊肿不一样。突入喉咽腔的TGDC需术前行纤维喉镜明确,颈部彩超排除位于喉前正中的异位甲状腺,颈部 CT 明确颈部占位的性质并起源于舌骨,术后病理诊断明确病变性质。
因婴幼儿LTGDC较低的发病率和复杂的临床表现,导致初步诊断有一定困难。本组病例仅有1例因体积巨大是经口压舌板发现,其余均是辅助检查发现。因此对出生后反复出现喉喘鸣,伴有呼吸或喂养困难的患儿,首先应做喉镜检查排除或明确LTGDC,同时辅助CT、B超或放射性核素等检查。伴有反复呛咳、误吸的患儿,应常规行放射性核素肺吸入检查,排除杓间隙深等喉裂畸形。
3.3 LTGDC的治疗 1920年介绍的Sistrunk技术仍是TGDC手术治疗的金标准,完整的切除可有效减少复发。目前比较常见的手术方式包括低温等离子射频消融、机器人辅助囊肿切除、动力系统切除、细针穿刺、造袋治疗等[8]。本组44例LTGDC均采用喉镜下经口切除,术中切除游离面囊壁,开放基底部至舌骨软骨膜。术后随访1年,复发1例,复发率为2.3%,低于文献报道的3%[9]。复发原因考虑为囊壁或瘘管及其分支断裂致部分残留所致,外院再次手术后未再复发。
3.4 LTGDC合并疾病的发现和处理 50%的患儿因喉喘鸣就诊,导致临床中多误诊为先天性喉喘鸣,并忽略了与喉喘鸣有关的器质性疾病,如先天性喉软骨发育不良、先天性SGS、气管狭窄、后鼻孔闭锁、LTGDC、会厌囊肿等,可有一个或多个层面的喉气管畸形引起的喉喘鸣。先天性喉软骨发育不良或喉软化症是新生儿、婴幼儿发生喉喘鸣最常见的原因,占75%左右[10]。2014年Yagasaki等[11]报道1例因上呼吸道梗阻就诊的患儿,喉镜检查发现喉软化合并LTGDC,术中予以同步治疗,术后上呼吸道梗阻症状完全消失。大样本LTGDC合并先天性喉软化症文献报道相对少见。依据Mc Swiney分型,先天性喉软化症分为3型:Ⅰ型为omega型,Ⅱ型为杓会厌皱襞短缩型,Ⅲ型杓状黏膜肥厚型。本组LTGDC合并Ⅰ、Ⅱ和Ⅲ型喉软化分别为5、25和5例,共35例,发生率高达80%。考虑舌根囊肿使喉部尤其是会厌发育不稳定,可加重或导致喉软化[10];针对不同程度的喉软化症,均予以声门上成形术,其中双侧声门上成形术20例,单侧15例,术后随访1年均未发生声门上狭窄,术后喉喘鸣治愈率达86.4%。13.6%的患儿仍有喉喘鸣,可能与随访时间过短有关;或与母亲妊娠期营养不良,造成胎儿钙和其他电解质缺少或不平衡所致;或与局部神经肌肉发育不成熟有关,也可能与胃食管反流有关。
LTGDC合并喉裂(laryngeal clefts,LC)报道少见。喉裂是婴幼儿先天性喉部畸形中少见的一种,是指喉后部中线处的缺损。有文献[13]报道新生儿喉裂的发病率为1/20 000~1/10 000。有喂养困难、反复吸入性肺炎和喉鸣三联征的患儿,应重视喉裂的诊断[12-13]。喉裂的分型比较常用的为Benjamin等[14]提出的分型。8例反复呛咳患儿,肺吸入阳性7例,术中检查均有杓间隙深伴喉软化。因裂隙深度未达到诊断喉裂水平,粗称之为杓间隙深。因患儿反复呛咳,多次肺炎发作,按照Ⅰ型喉裂予以修补,同时术后予以抗反流治疗。6例患儿未再出现呛咳、误吸,1例抗反流治疗半年,呛咳明显减轻;1例脑部发育不良患儿,术后仍有呛咳,考虑可能是神经肌肉疾病导致。因此,当LTGDC合并杓间隙深畸形时,应根据患儿的实际临床情况予以适当的手术修补,提高临床治疗效果。
SGS主要导致婴幼儿喘鸣及吸气性呼吸困难,是婴幼儿进行气管切开的首位原因。目前关于SGS比较一致的诊断标准为,足月新生儿声门下内直径<4 mm、早产儿<3.5 mm 即诊断为 SGS。Myer等[15]应用气管内插管的大小测量气管直径。SGS 按发生时间可分为先天性SGS和获得性SGS。前者归因于胚胎期的喉发育不良,常合并其他先天性畸形或综合征的部分病变;后者通常由医源性损伤或喉外伤所致,婴幼儿尤以气管插管后损伤常见。LTGDC合并SGS报道少见。本文44例LTGDC中合并Ⅰ度SGS 4例、Ⅱ度SGS 1例。5例SGS均合并喉软化,其中Ⅱ度SGS患儿因心脏手术,外院全身麻醉插管半月余,导致获得性SGS,术后拔管困难,转入我院,喉镜检查发现舌根囊肿,手术切除囊肿和声门上成形术后,予以抗反流治疗半月,术后顺利拔管,未出现喉梗阻,SGS未处理。另4例Ⅰ度SGS患儿因术前未出现呼吸不畅,未予治疗。因此,当LTGDC合并喉梗阻导致拔管困难,尤其当伴有气管插管病史时,应常规行硬性气管镜检查,排除可能的SGS,明确诊断可予以积极处理,如球囊扩张、抗反流治疗等。
LTGDC是小儿咽喉部相对少见的疾病,尤其当合并喉软化、SGS、杓间隙深等多层面喉气管畸形时,易导致患儿的临床表现复杂多变,出现误诊。因此当患儿出现喉喘鸣、呼吸不畅、呛咳不适等症状时,应在行内科治疗的同时,积极完善电子纤维喉镜、喉部CT等检查,提高诊断率。另外在切除囊肿的同时,应该行气管镜检查,评估喉、气管发育情况,必要时配合抗反流等综合治疗,提高治愈率。
