miR-98-5p与靶基因HMGA2相关调控机制抑制喉鳞癌的作用及临床意义
2019-08-06张晓莹吴锋
张晓莹 吴锋
(江苏省南通市第二人民医院耳鼻咽喉科 南通 226002)
喉鳞癌是常见的头颈部恶性肿瘤之一,恶性程度高,易出现转移和复发。喉鳞癌的发病机制目前尚不明确,多数研究[1-4]认为恶性肿瘤的发生、发展是一个多因素、多基因、多步骤的复杂过程。非组蛋白染色体蛋白HMGA2在多种肿瘤中都呈现较高的表达水平,是新癌基因之一,在多种肿瘤的发生、侵袭和转移过程中都有着调控功能。近年来关于高迁移率族蛋白HMGA2在肿瘤中的研究越来越多,其最早在胚胎组织中被发现,而在成熟分化的组织中几乎检测不到,但在许多恶性肿瘤中却可以检测出来。HMGA2虽然分子量小,却可以作为“构筑转录因子”参与多种基因的调控表达,进而通过多条分子通路参与细胞的增殖、分化、侵袭与转移,被认为具有癌基因的特征。因此,许多研究都认为HMGA2在喉鳞癌发生过程中起重要作用,可能成为喉鳞癌的治疗靶点[5-6]。众多研究也同时显示,miRNAs在调控喉鳞癌发生、转移的信号通路中也有至关重要的作用,并具有成为喉鳞癌诊断指标及治疗靶点的潜力。本实验研究miR-98-5p通过靶向调控HMGA2在喉鳞癌中的相关作用及意义,为诊断及治疗喉鳞癌提供新的研究方向。
1 材料与方法
1.1 标本采集 本研究中纳入120例喉鳞癌患者,均于2016年 1月~2017年12月在本科接受全喉或部分喉切除手术。患者之前均未经任何治疗,平均年龄为(49.81±7.57)岁。喉鳞癌组织和癌旁组织(距癌组织边缘2 cm内区域)在5 min内被切除,立即投入液氮内,并长期保存在-80 ℃冰箱。
1.2 外周血采集 针对纳入研究的喉鳞癌患者,均于清晨空腹状况下抽取外周静脉血。具体操作如下:采用一次性血清分离胶管,抽取外周静脉血约3 mL;待血清析出后以1 000 g离心10 min,取上层血清保存至-80 ℃冰箱待检测。
1.3 定量反转录聚合酶链反应(qRT-PCR)检测外周血miR-98-5p和HMGA2的表达 取0.5 mL血清标本,采用Trizol 法提取血清总RNA。实验步骤按照Trizol试剂盒说明书中步骤进行。将提取到的总RNA按照反转录试剂盒的说明书进行RNA反转录,合成cDNA。按照qRT-PCR 试剂盒说明书进行PCR:采用50 μL反应体系,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 45 s,72 ℃ 2 min, 共40个循环。miR-98-5p计算采用U6作为内参,HMGA2采用GAPDH作为内参。
1.4 细胞培养和转染
1.4.1 细胞培养 Hep-2细胞以含10%胎牛血清的培养基在37 ℃、5% CO2的培养箱中常规培养,再用2.5% 的胰蛋白酶每2 d进行消化,传代,并取对数生长期细胞用于实验。
1.4.2 细胞转染 取对数生长期Hep-2细胞(1~1.5)×106个分板,接种于6孔板中,置于37 ℃、5% CO2的培养箱中培养至细胞密度60%~70%之后,再将细胞分为2组:miRNA对照转染组以及miR-23过表达的miRNA转染组,并将培养基换成每孔1 mL无血清无双抗的培养基;miRNA及转染试剂Lipofectamine 2000分别用100 μL OMEM稀释后,依照说明书所需比例混匀后静置20 min,逐滴加入并且轻晃混匀, 培养6 h后;再换为含完全培养基,待48 h后收集细胞进行下一步分析。
1.5 荧光素酶报告基因法检测miR-98-5p与靶基因HMGA2的结合 构建HMGA2野生型3′-UTR荧光素酶报告基因质粒pMIR-HMGA2-wt,并以pMIR-HMGA2-wt质粒为模板,利用PCR搭桥法(overlapping PCR)构建其潜在结合位点突变型报告基因质粒pMIR-HMGA2-Mut。将miR-98-5p mimics、阴性对照组miRNA mimics(miR-NC)内参海肾荧光素酶以及pMIR-HMGA2-wt和pMIR-HMGA2-Mut报告基因质粒共转染进Hep-2细胞中,在细胞培养箱中培养36 h后收取细胞液,使用双荧光素酶报告基因试剂盒测定荧光素酶活性。
1.6 Western印迹 采用含50 mmol/L Tris-HCl (pH=7.4)、150 mmol/L NaCl、0.5%脱氧胆酸钠、0.1% 十二烷基硫酸钠(SDS)和蛋白酶抑制剂及1 mmol/L苯甲基磺酰氟的RIPA裂解液分离蛋白质,通过SDS-PAGE凝胶进行电泳,按说明书进行Western印迹实验。
1.7 CCK8检测细胞增殖 制备单细胞悬液:收集对数生长期的Hep-2细胞,以1×105/mL 接种于96孔培养板,每孔培养基200 μL。经过12 h后,分别用miR-NC和miR-98-5p转染Hep-2细胞,每组6个复孔。在37 ℃条件下培养,经过48 h后每孔加入200 μL CCK-8 再持续培养2 h。使用酶标仪检测各孔在450 nm处吸光度(optical density,OD)值。
1.8 流式细胞法检测细胞周期 悬浮并收集不同时间点细胞,生理盐水冲洗细胞2遍,70%乙醇固定细胞。加入碘化丙啶DNA荧光染色(propidium iodide,PI:50 mg/L,1% Triton X-100),4 ℃冰箱避光染色30 min,铜网过滤,使样本成为合格的单细胞悬液,流式细胞仪检测细胞周期。
1.9 鳞癌Hep-2细胞悬液制备 取对数生长期 Hep-2细胞,胰酶消化成单个细胞,RMPI-1640液洗涤,吹打成悬液,用磷酸盐缓冲液(phosphate buffered saline,PBS)调整细胞数至 1×109备用。
1.10 构建裸鼠喉鳞癌皮下移植模型 在裸鼠右肩胛近腋窝处皮下接种喉鳞癌Hep-2细胞悬液0.2 mL,观察接种部位液体吸收、肿瘤生长过程及裸鼠状况。
1.11 统计学处理 采用SPSS 22.0统计软件进行t检验和χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-98-5p在喉鳞癌患者细胞中的表达 qRT-PCR检测喉鳞癌组织和癌旁正常组织中miR-98-5p的表达水平,结果显示,相比癌旁正常组织,喉鳞癌组织中miR-98-5p的表达水平明显降低,差异具有统计学意义(P<0.01,图1A);同时发现,出现转移的喉鳞癌组织中miR-98-5p的表达水平明显低于无转移的肿瘤组织(图1B)。结果显示,miR-98-5p可能对喉鳞癌存在一定的调控作用。

图1. miR-98-5p在喉鳞癌患者细胞中的表达 A.喉癌组织与癌旁正常组织比较;B.有转移和无转移组比较;*示P<0.01;**示P<0.05
2.2 临床特征 对纳入研究的喉癌患者组织进行检测,结果显示喉鳞癌组织中miR-98-5p的平均表达水平为0.69±0.17。以均数0.69为分界值,表达量≥0.69为miR-98-5p高表达,表达量<0.69为miR-98-5p低表达。将miR-98-5p的表达高低与患者临床特征进行相关性分析,结果显示,miR-98-5p与年龄、性别无明显相关性(P>0.05)。miR-98-5p高表达患者的癌组织分化程度及临床分期较低(P<0.05),无淋巴结转移患者中miR-98-5p的表达水平明显高于有淋巴结转移患者(P<0.01,表1)。
2.3 miR-98-5p通过结合HMGA2的 3′-UTR来抑制HMGA2的表达 对microRNA靶基因数据库进行筛选,预测HMGA2为miR-98-5p的潜在靶基因(图2A)。构建了HMGA2野生型3′-UTR荧光素酶报告基因质粒pMIR-HMGA2-wt及突变型报告基因质粒pMIR-HMGA2-Mut。将miR-98-5pmimics,miR-NC、内参海肾荧光素酶以及pMIR-HMGA2-wt和pMIR-HMGA2-Mut报告基因质粒共转染进Hep-2细胞中,双荧光素酶检测结果显示,miR-98-5pmimics可明显抑制pMIR-HMGA2-wt质粒荧光素酶活性;而对pMIR-HMGA2-Mut荧光素酶活性无明显影响(图2B)。表明miR-98-5p可以通过结合HMGA2的3′-UTR而抑制HMGA2的表达。为进一步验证miR-98-5p对HMGA2的调控作用,通过qRT-PCR检测发现,miR-98-5pmimics转染组中HMGA2的mRNA表达水平明显低于对照组(图2C),并且Western印迹检测结果显示,相比对照组,miR-98-5pmimics转染组中HMGA2表达量明显降低(图2D)。上述结果表明,miR-98-5p能够抑制HMGA2的mRNA翻译及其蛋白表达。
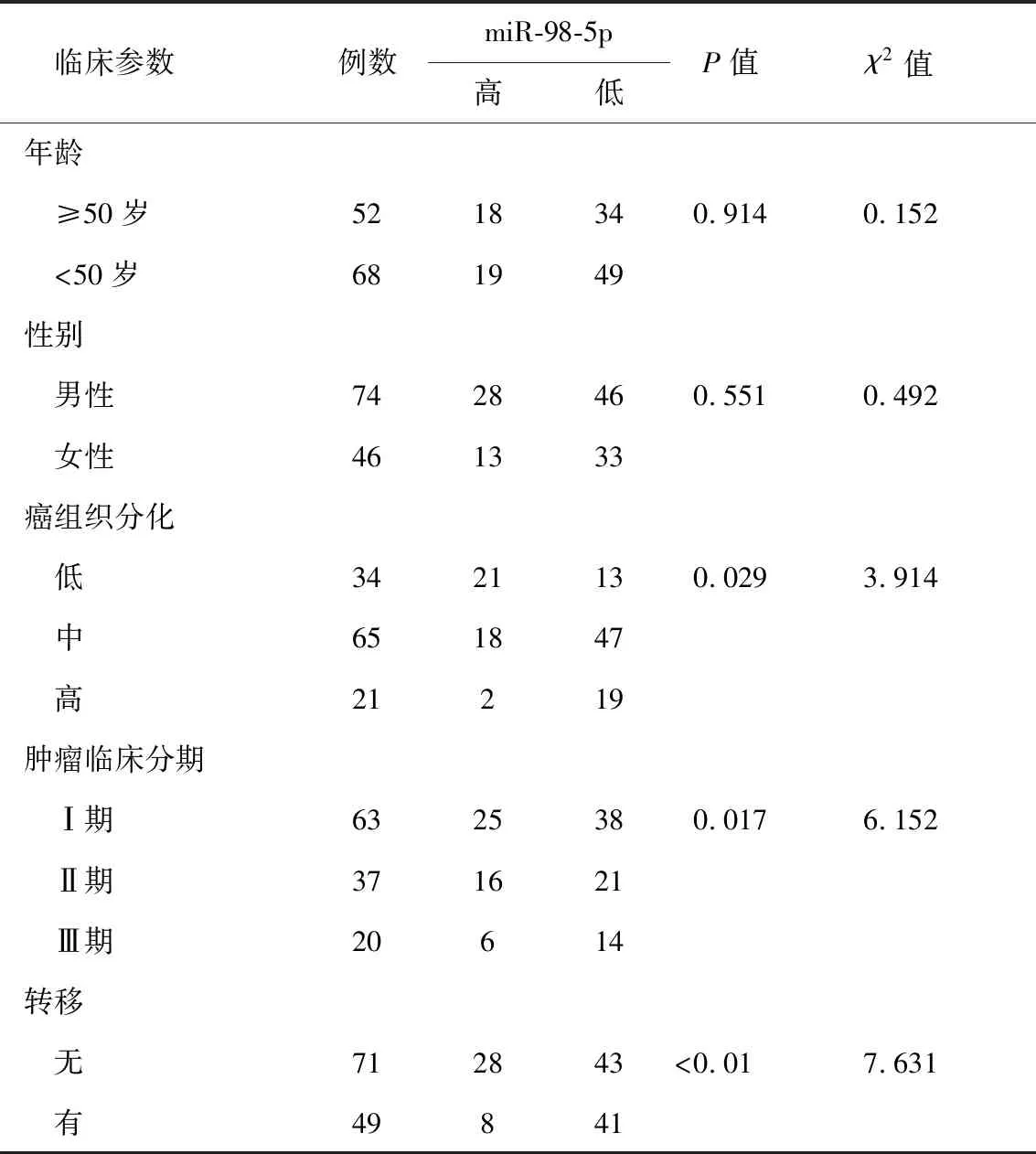
表1 miR-98-5p的表达水平与喉鳞癌患者临床特征的相关性(n)
2.4HMGA2在喉鳞癌组织中mRNA的表达水平 qRT-PCR检测结果显示,喉鳞癌组织相比癌旁正常组织,HMGA2的mRNA表达量明显升高(图3)。
2.5 miR-98-5p和HMGA2与细胞增殖及周期的相关性 将miR-NC, miR-98-5pmimics和HMGA2转染进Hep-2细胞,采用CCK8实验检测对照组、miR-98-5pmimics转染组和miR-98-5pmimics+HMGA2转染组发现,miR-98-5pmimics转染组的OD值明显低于对照组,而miR-98-5pmimics+HMGA2转染组的OD值明显高于miR-98-5pmimics转染组(图4A)。流式细胞法检测结果显示,miR-98-5pmimics转染组S期细胞比值明显低于对照组,而miR-98-5pmimics+HMGA2转染组S期细胞比值明显高于miR-98-5pmimics转染组(图4B)。以上结果表明,miR-98-5p可抑制喉鳞癌细胞Hep-2的增殖和细胞周期在S期聚集,而这些抑制效果可被HMGA2补回。

图2. HMGA2是miR-98-5p的靶基因 *示P<0.01
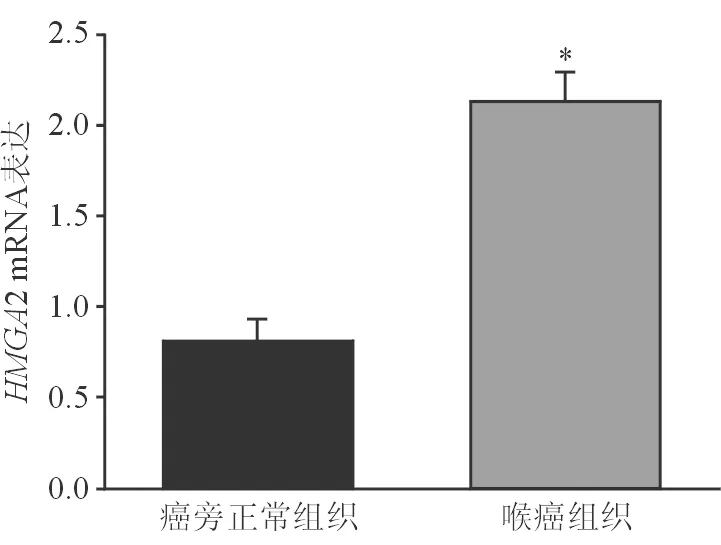
图3. 靶基因HMGA2的mRNA的表达水平 *示P<0.01
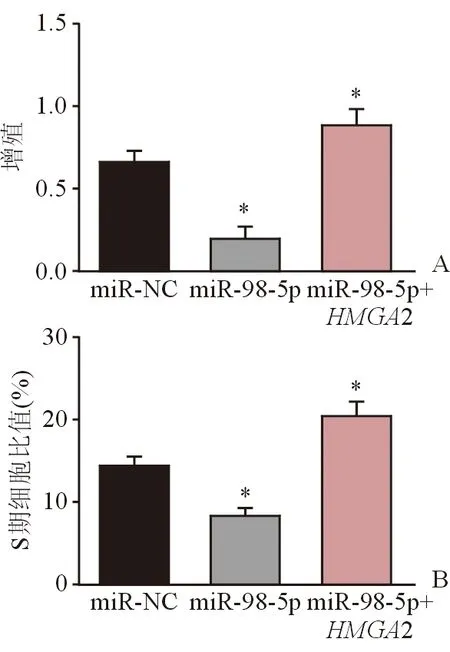
图4. miR-98-5p和HMGA2对细胞增殖及周期的调控作用*示P<0.01
2.6 miR-98-5p抑制裸鼠体内肿瘤生长 21 d后发现,miR-98-5pmimics转染组裸鼠肿瘤体积及重量均明显低于对照组(图5A、B),并且miR-98-5p在miR-98-5pmimics转染组小鼠肿瘤组织中的表达水平明显高于对照组(图5C),表明在裸鼠体内,miR-98-5p过表达能够抑制Hep-2细胞的增殖,抑制肿瘤的生长。
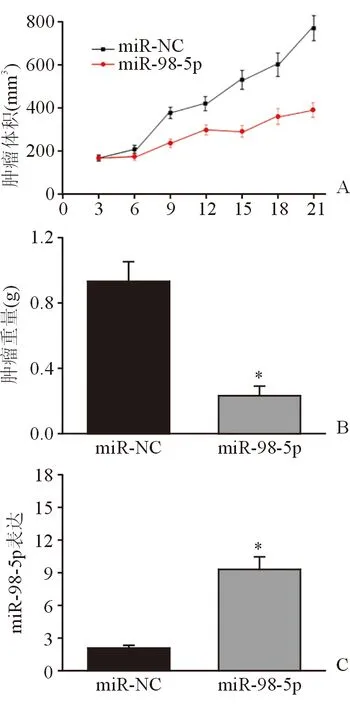
图5. miR-98-5p抑制裸鼠体内肿瘤生长 *示P<0.01
3 讨论
目前喉鳞癌患者确诊时已发展至Ⅲ~Ⅳ期者占40%,因此喉鳞癌的早期诊断与治疗显得尤为重要,然而目前为止还未发现能早期预测喉鳞癌的分子标志物[7-9]。 miRNA是一段大约由19~25个核苷酸组成的非编码小RNA,通过对其靶 mRNA的翻译抑制或者降解在动、植物体内发挥重要的调节作用。miRNA按照其在肿瘤发生、发展中的调控作用可分为致癌miRNA和抑癌miRNA,调控癌细胞的增殖、侵袭、凋亡及血管生成情况[10]。
本研究采用qRT-PCR检测喉鳞癌[11-13]组织和癌旁正常组织中miR-98-5p的表达水平,发现相比癌旁正常组织,喉鳞癌组织中miR-98-5p的表达水平明显降低。在构建裸鼠喉鳞癌皮下移植模型中,证明miR-98-5p在miR-98-5pmimics转染组裸鼠肿瘤组织中的表达水平明显高于对照组,因此表明miR-98-5p对喉鳞癌有调控作用。
有研究[14]报道,通过双向电泳在柯斯顿鼠肉瘤病毒(KiMSV)转化鼠甲状腺细胞株(FRTL5)中发现HMGA2与肿瘤表现型之间的联系,当时在细胞转化后共发现3种磷酸化的核蛋白质,标记为C、D、E,分别对应现在所指的HMGA2,HMGAla和HMGAlb。Berlingieri等[15]通过进一步的研究发现,以上这些磷酸化的蛋白质在反转录病毒转染的无完全恶性表型的鼠甲状腺细胞株中不表达,在有完全恶性表型的细胞株中则持续表达。Rice等[16]进一步证明了HMGA2的致癌活性。他们发现HMGA2表达增高的细胞系呈现出不依赖支持物生长的特性,而且在注入裸鼠体内后出现远处转移。
在本研究中,我们通过microRNA靶基因数据库进行筛选,预测HMGA2为miR-98-5p的潜在靶基因,使用双荧光素酶检测发现miR-98-5p可以通过结合HMGA2的3′-UTR[17-18]进而抑制HMGA2的表达。通过qRT-PCR和Western印迹确定miR-98-5p可以抑制HMGA2的mRNA和蛋白表达水平,更加验证了miR-98-5p对HMGA2的靶向调控作用。同时qRT-PCR检测结果也显示喉鳞癌组织相比癌旁正常组织,HMGA2的mRNA表达量明显升高,因此说明HMGA2对喉鳞癌具有调控功能。然后采用CCK8实验检测对照组、miR-98-5pmimics转染组和miR-98-5pmimics+HMGA2转染组发现,miR-98-5pmimics转染组的OD值明显低于对照组,而miR-98-5pmimics+HMGA2转染组的OD值明显高于miR-98-5pmimics转染组。同时流式细胞法检测结果显示,miR-98-5pmimics转染组S期细胞比值明显低于对照组,而miR-98-5pmimics+HMGA2转染组S期细胞比值明显高于miR-98-5pmimics转染组。结果表明,miR-98-5p可抑制喉鳞癌Hep-2细胞的增殖和细胞周期在S期聚集,而这些抑制效果可被HMGA2补回。在裸鼠喉鳞癌皮下移植模型实验中,我们发现miR-98-5pmimics转染组裸鼠肿瘤体积及重量均明显低于对照组,并且miR-98-5p在miR-98-5pmimics转染组裸鼠喉鳞癌组织中的表达水平明显高于对照组。通过本次研究,预示miR-98-5p能够通过抑制HMAG2的表达抑制喉鳞癌。
综上所述,miR-98-5p可抑制喉鳞癌Hep-2细胞的增殖和细胞周期在S期聚集,而这些抑制效果可被HMAG2补回,并且miR-98-5p能够抑制HMAG2的表达水平并抑制喉鳞癌细胞的增殖,对喉鳞癌有抑制效果。此外,本研究纳入150例患者中女性74例,考虑既往文献报道喉癌女性发病率远低于男性,因此本研究尚存在研究样本量不足而产生偏倚的可能,多中心大样本的临床研究对本研究结论的验证是必要的。本研究结果显示,miR-98-5p可以结合HMAG2的3′-UTR并抑制HMAG2的表达,抑制喉鳞癌的发展。miR-98-5p可能成为喉鳞癌诊断及治疗的新靶点,为诊断及治疗喉鳞癌提供新的研究价值和临床导向。
