真菌联合稀碱预处理杜仲叶提取杜仲胶的工艺研究
2019-07-23刘佩岩王思莹郭紫婧赵修华
刘佩岩 王思莹 郭紫婧 赵修华
(东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
杜仲(EucommiaulmoidesOlive.)为杜仲科(Eucommiaceae)杜仲属(Eucommia)多年落叶乔木,又名扯丝皮、丝联木,是我国特有的经济树种,同时也是国家珍贵的二类保护物种,其树皮是我国名贵的滋补中药,具有补肝肾、强筋骨、降血压、利尿、安胎等药用功效[1],现代科学研究表明,杜仲除了具有药理作用的成分外,其中的皮、叶、根和种子中都富含白色丝状杜仲胶(Eucommiaulmoidesgum,EUG),杜仲胶是一种天然高分子物质,其成分与东南亚的古塔波胶(gutta percha)和南美的巴拉塔胶(balata)一样,均为反式-聚异戊二烯,但是天然的三叶橡胶为顺式-聚异戊二烯[2]。杜仲胶存在于杜仲的树叶、皮和种子中,成熟的杜仲籽中含有的杜仲胶最高,为10%~17%。据文献报道,杜仲叶胶含量相对于杜仲皮和杜仲籽含量较低,理论上仅占杜仲叶干质量的1.55%~3.23%[3]。
在此之前,工艺不成熟的时候,杜仲皮的获取需要伐木取皮,即便现在研究出“杜仲剥皮再生技术”,可是毕竟受到了杜仲树资源的限制。但是杜仲树是落叶树,每年秋季会掉落大量的落叶,属于可再生资源,我国杜仲林现已有20余万hm2,1 hm2杜仲林叶产胶量约为150 kg[4],因此杜仲叶不仅可以加工成保健茶,还可以利用其作为提取杜仲胶的主要原料,这很大程度上提高了杜仲的生态环境利用价值,使其成为一种具有潜力的天然资源[5~6]。
目前从杜仲植物组织中提取杜仲胶的一般方法主要有机溶剂浸提法如:苯、甲苯、石油醚、正己烷,还有植物细胞壁破除法如:纤维素酶处理、碱处理、机械力处理这两类[7]。魏锦锦等[8]应用蒸汽爆破预处理杜仲皮来提取其中的杜仲胶与其他活性成分;周鹏等[9]在盐酸作为催化剂的条件下运用乙酸预处理杜仲果壳从而提取杜仲胶;刘贵华等[10]直接应用纤维素酶进行预处理,进而从杜仲粕壳提取杜仲胶;谢晓婷等[11]用碱水解和酶解预处理杜仲叶渣,之后用石油醚作为溶剂提取杜仲胶。对于从杜仲植物组织中提取杜仲胶的研究还有很多,但是都存在应用有机溶剂用量大、用料成本高、实验安全低,等诸多不足之处,所以在杜仲胶的提取工艺上还是要进行一些改进,本研究从原料的来源、工艺的安全、工艺流程绿色环保等各个方面,研究探索一种利用从杜仲叶中提取杜仲胶的方法,对杜仲叶的综合开发利用有着重要的意义。
1 材料与方法
1.1 材料
杜仲叶:产自安徽亳州,晒干后保存。绿色木霉:购自北京百欧博伟生物技术有限公司;超纯水(实验室自制);其余试剂均为市售分析纯。
1.2 方法
1.2.1 杜仲叶烘干
将已购的杜仲叶放置于50~60℃的烘箱中鼓风干燥12 h左右。
1.2.2 杜仲叶面角质层的去除
根据实验与文献报道[12],NaOH的稀溶液能较好溶解角质层,同时NaOH的稀溶液对杜仲叶纤维素无作用,所以选用NaOH的稀溶液预处理杜仲叶的角质层。选用在75℃下、0.45%的NaOH、料液比1∶14、时间为120 min条件下可以对杜仲叶的角质层有很好的去除效果。而且苏丹Ⅲ染色剂对植物的角质层有很好的染色效果,因此可以以此作为判定杜仲叶角质层是否去除完全的判定依据。
1.2.3 绿色木霉菌种活化与菌悬液的制备
按照菌种培养说明书,配置综合马铃薯培养基(PDA)培养基,经高压蒸汽灭菌后,制成平板培养基,在无菌工作台接种,在28℃下培养5~7 d,培养出菌丝绿色、生长健壮、浓密、无污染的菌种,放置于2~8℃环境中保存,为之后制备菌悬液做准备。斜面培养基为PDA培养基。种子培养基组成为:CMC-Na(7.5 g),蛋白胨(5 g)吐温-80(2 mL),MgSO4·7H2O 0.3 g,CaCl2(0.3 g),FeSO4·7H2O(0.005 g),MnSO4·H2O(0.001 6 g),ZnSO4·7H2O(0.001 4 g),CoCl2(0.002 g),蒸馏水1 000 mL,pH自然,121℃,灭菌20 min[12]。合成培养液。基质溶液成分为:NaCl(0.5 g·L-1),MgSO4(0.5 g·L-1),(NH4)2SO4(13 g·L-1),KH2PO4(10.5 g·L-1),CaCl2(0.3 g·L-1),FeSO4·7H2O(0.01 g·L-1),MnSO4·7H2O(0.015 g·L-1),ZnSO4·7H2O(0.015 g·L-1),CoCl2(0.01 g·L-1)[13~17]。
菌悬液的制备。种子摇瓶培养。在250 mL三角瓶中加入100 mL种子培养基,取已活化的绿色木霉菌种一环接种到种子培养基中,28℃,150 r·min-1,振荡培养72 h。
1.2.4 绿色木霉培养条件的优化
表1 绿色木霉发酵培养正交试验因素及水平
Table 1 Orthogonal test factors and levels of green trichoderma fermentation culture
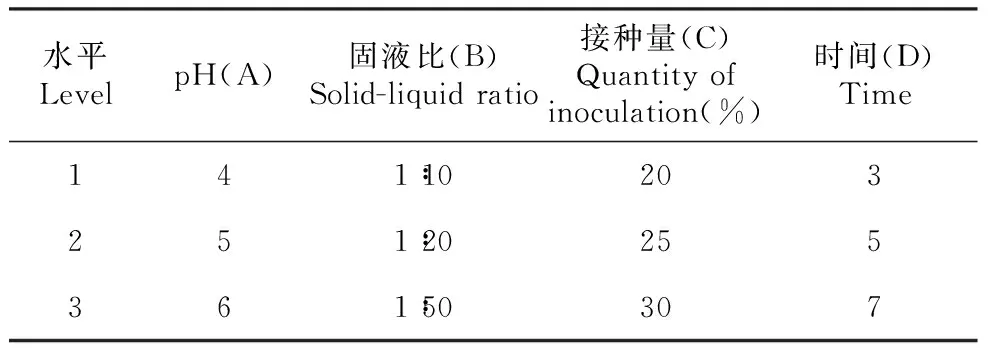
水平LevelpH(A)固液比(B)Solid-liquid ratio接种量(C)Quantity of inoculation(%)时间(D)Time141∶10203251∶20255361∶50307
1.2.5 纤维素酶活力的测定与计算
用移液管准确吸取0.2 mL粗酶液于试管中,再加入已用pH=5.0的NaAC-HA缓冲液配置好的CMC-Na溶液1.8 mL,55℃水浴30 min,然后加2 mL DNS试剂,混匀并在沸水浴中水浴5 min,放置至室温,定容到25 mL后于540 nm下测定其吸光值。最后按照DNS法测定还原糖量,再根据葡萄糖标准曲线计算纤维素酶的活力,单位酶活的计算如下:
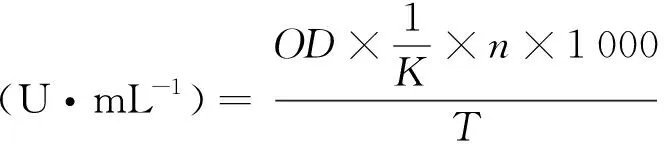
(1)
式中:OD为酶液的吸光值;K为曲线斜率;n为稀释倍数;T为反应时间(min);1 000为mg换算成μg。
1.2.6 杜仲胶得率与含量及纯度的计算
取的杜仲叶样品5 g,置于250 mL烧杯中。加入100 mL石油醚,在85℃下搅拌提取1次(测定杜仲叶中杜仲胶的含量时提取次数为3~5次),趁热过滤,将烧杯放入-20℃环境中冷冻,待2 h左右后有白色沉淀析出,进行过滤,获得杜仲粗胶,最后将杜仲胶粗品中加入丙酮溶液加热回流2 h即可得到杜仲胶纯品。过滤取沉淀在50~60℃鼓风干燥,获得杜仲胶精胶。将滤液装入500 mL圆底烧瓶中在55℃下减压蒸馏,进行溶剂回收。提取完成之后,回收得到的石油醚可以重复利用于杜仲胶的提取。提取得率与含量的计算方法如下:
(2)
式中:η为杜仲叶样品中杜仲胶提取得率(%);W1为最后得到杜仲叶样品中杜仲胶的质量(g);W0为杜仲叶样品的总质量(g)。
参照GB/T8086-2008《天然生胶杂质含量的测定》[18]测定。将所得杜仲胶分析天平准确称取m0,用干净干燥的三角烧瓶承装备用,向三角烧瓶中加入适量含有2-硫醇基苯并噻唑的橡胶溶剂,通过加热溶解样品。然后用干燥后已知恒m1的孔径为45 μm的滤筛过滤。最后,将装有杂质的滤筛用石油醚浸泡15~20 min后取出沥干,放置烘箱中烘干称重m2。杂质含量的计算公式如下:
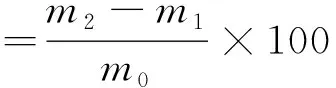
(3)
式中:m0为杜仲胶样品的质量(g);m1为空筛的质量(g);m2为空筛和杂质的总质量(g)。
1.2.7 杜仲叶表面SEM观测
选取适量的样品,在50~60℃鼓风干燥备用。将上述烘干后的杜仲叶样品通过导电胶粘到扫描电镜样品台上。将附有样品的样品台放置于BC-Ⅱ离子溅射仪中进行真空喷镀,喷镀时金靶材处于阴极,调整靶材和样品台合适的距离。电镜观察前处理完成后,放入场发射扫描电子显微镜中(型号为SU-8000 Hitachi);严格按照扫描电镜的观测步骤调节灯丝饱和点、光阑对中、光阑合轴、消象散调节和聚焦观测等步骤,选择合适的倍数观察,可获得清晰的杜仲叶微观表面形貌图像。
1.2.8 杜仲胶的红外光谱测定
对最终得到的杜仲胶进行红外光谱的测定:由于制得的杜仲胶呈固体状态,故把得到的杜仲胶精胶粉碎,准确称取1 mg杜仲精胶,研磨成细粉采用压片法与200 mg KBr混合压片。通过傅里叶红外光谱仪在波长为全波,扫描次数为35次,分辨率为2.0 cm-1,测定方式为Interferogram、条件下对所得的杜仲胶做红外光谱的分析。
2 结果与分析
2.1 叶面角质层去除效果
以未经预处理的杜仲叶制备培养基时,发现绿色木霉菌丝生长缓慢甚至不生长,对杜仲叶进行烘干后称重对比处理前重量也没有明显差异。间接说明绿色木霉直接与杜仲叶作用时,杜仲叶细胞壁未被破坏;用苏丹Ⅲ对杜仲叶进行显色表征,发现表面被染成红色(图1:A),说明杜仲叶表面覆盖有一层角质层,角质层阻碍了绿色木霉对杜仲叶细胞结构的作用。说明此条件提高了角质层的溶解效果,并且在应用稀碱溶液预处理的过程中,不仅溶解掉杜仲叶的角质层和表面的蜡质,也一定程度上除去了杜仲叶中的一些杂质,间接提高了杜仲胶在杜仲叶中的含量,为之后的提取做准备。同时,用苏丹Ⅲ对优化条件下稀NaOH溶液作用后的杜仲叶进行显色反应,在100倍显微镜下发现,与未经处理的杜仲叶相比,稀碱处理后的杜仲叶经苏丹Ⅲ染色(图1:B),没有染成红色,可以说明角质层去除比较完全。
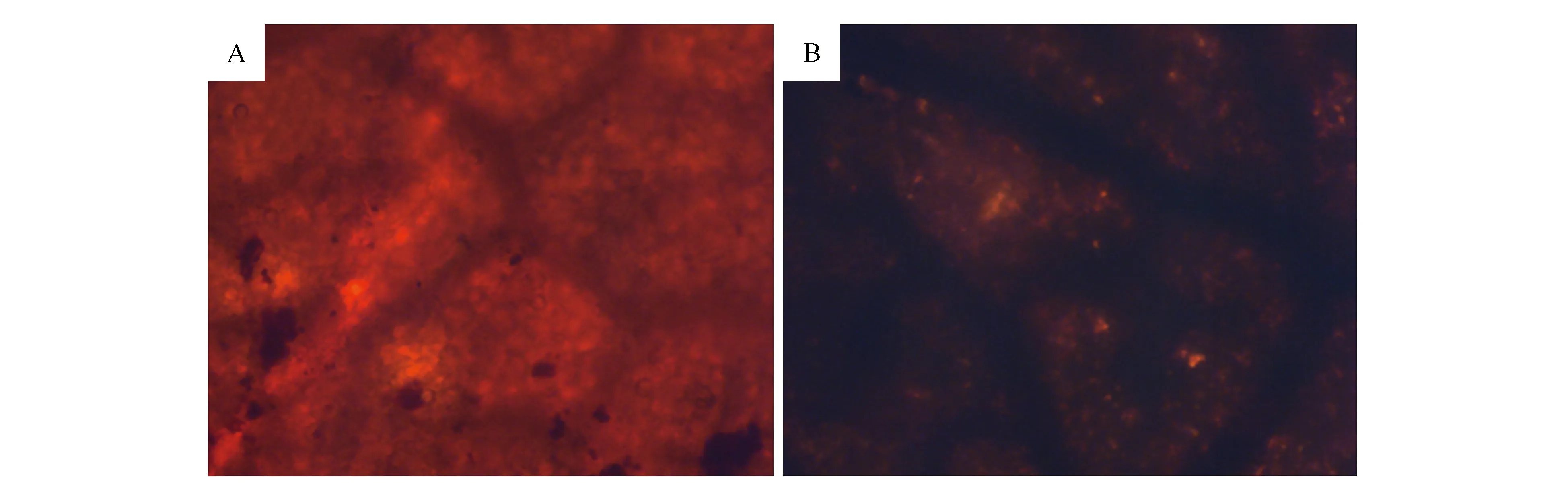
图1 苏丹Ⅲ染色100倍显微镜下观察杜仲叶表面Fig.1 Sudan Ⅲ staining observed the surface of E.ulmoides leaves under a microscope at 100 times

图2 杜仲叶原叶、稀碱处理、绿色木霉发酵培养的SEM结果Fig.2 SEM results of primary leaves of E.ulmoides,dilute alkali treatment and green trichoderma fermentation culture
2.2 杜仲叶表面SEM观测
通过对稀碱与绿色木霉联合处理后的杜仲叶进行SEM观察可以很清楚的发现,杜仲叶的表面由比较平整、杂质较多的状态(图2:A),变成粗糙(图2:B)、疏松多孔(图2:C)的状态,可以证明稀碱联合绿色木霉预处理杜仲叶是一种比较有效的方法。
2.3 绿色木霉发酵培养及条件优化
2.3.1 绿色木霉培养
由图3可知,图3A为摇床震荡液体培养之前的状态,图3B为经过摇床震荡培养之后的状态,可以清楚的看到培养基中有明显的菌团出现。可以证明在此培养基下绿色木霉可以旺盛的生长。为了在此验证绿色木霉在此培养基条件下生长情况,与液体培养同样培养基比例条件下,进行绿色木霉的平板培养,如图4所示,可以菌落生长极其旺盛,且呈现绿色木霉的特征菌落,进而证明此培养基利于绿色木霉的生长。
2.3.2 绿色木霉培养条件优化
由表2可知,4个因素对绿色木霉发酵效果的影响顺序为pH>固液比>接种量>时间。最优的水解水平为A3B1C1D2,即培养基pH=6,固液比1:10,接种量为20%,酶作用时间为5 d。最优条件下,测得绿色木霉的酶活性为19.883 U·mL-1,失重率达到27.5%,杜仲胶含量提升到4.36%,高于正交试验中任何一个条件结果,说明该优化组合得出了一个绿色木霉发酵最佳条件。

图3 绿色木霉液体培养状态Fig.3 Liquid culture status of green trichoderma

图4 绿色木霉平板培养状态Fig.4 Status of green trichoderma in plate culture
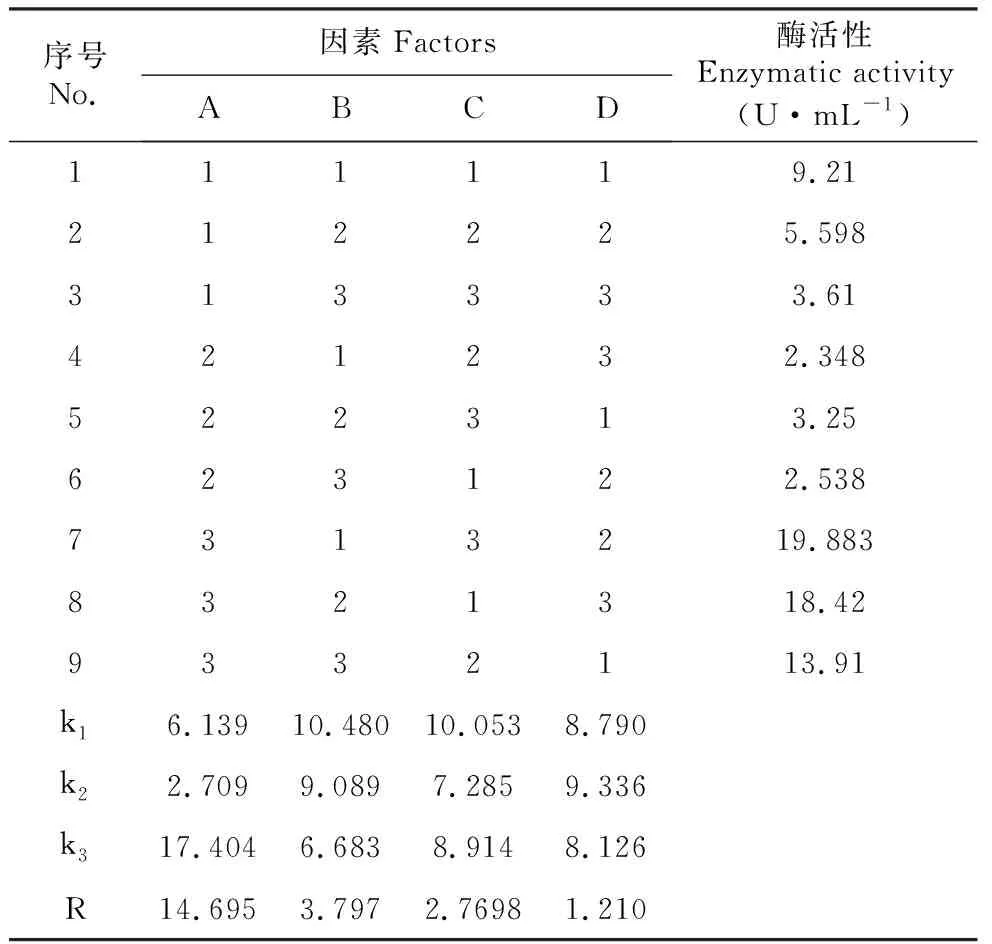
表2 绿色木霉正交试验与结果
2.4 有机溶剂对杜仲胶的提取
据相关文献显示[19],石油醚可以很好的溶解杜仲胶,实验结果发现,在温度为85℃、料液比为1∶20、提取次数为1次、每次提取时间为60 min、石油醚作为提取溶剂的条件下,对杜仲叶中的杜仲胶直接提取,杜仲胶的提取率仅为0.73%的杜仲胶。而经过稀碱溶液与真菌联合预处理后,杜仲胶的提取率可以达到2.85%,这是可能是因为通过稀碱联合绿色木霉预处理杜仲叶,不仅可以破坏其本身的纤维结构,也使得杜仲叶的纤维结构变得疏松、多孔有利于溶剂的渗透、增大提取效率,而且因为杜仲叶的质量的缺少,间接的提高了杜仲胶的含量,并且通过计算可以得出提取单位质量下的杜仲胶所需要的溶剂的量,为杜仲原叶的2.74 mL·mg-1,而预处理后仅为0.70 mL·mg-1,减少了石油醚的用量,以此达到既能获得高纯度的杜仲胶,又能使提取过程安全、环保的目的。
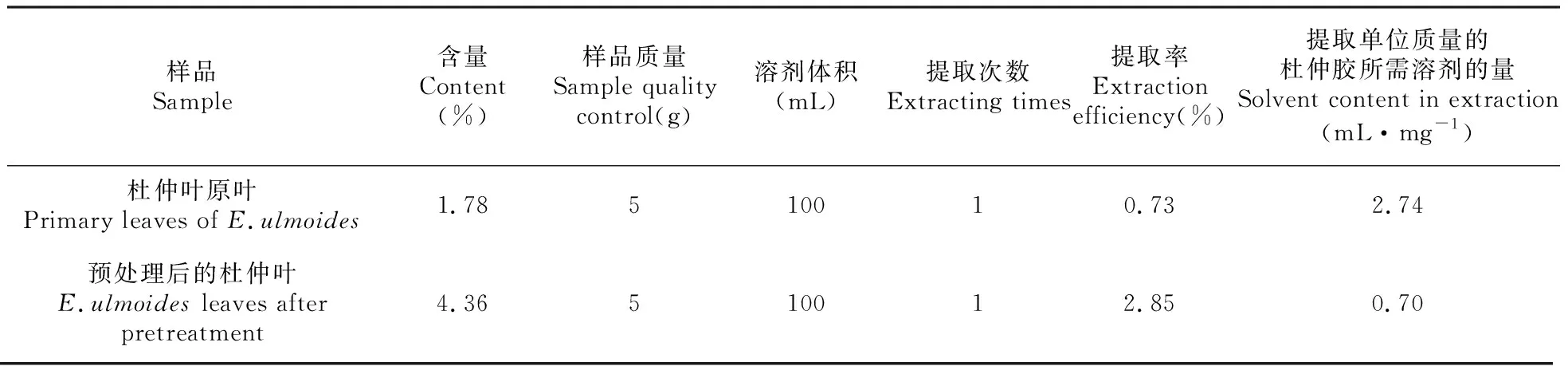
表3 预处理前后杜仲胶提取的对比
2.5 杜仲叶中的杜仲胶红外光谱的测定结果
对用丙酮纯化后得到的白色杜仲胶进行傅里叶红外光谱(FT-IR)的测定,获得光谱图如图5所示,将其与文献[20]进行对比可知,实验所得杜仲胶谱图与文献中所描述的值近乎相同,呈现为反式1,4-聚异戊二烯图谱,在2 854和2 918 cm-1处为甲基的伸缩振动,2 848 cm-1处为亚甲基的伸缩振动,1 669 cm-1处表示存在碳碳双键的伸缩振动,在800~1 500 cm-1范围内还有较多吸收峰,表示碳氢键、碳碳单键及甲基和亚甲基的振动及振动之间的耦合[20]。
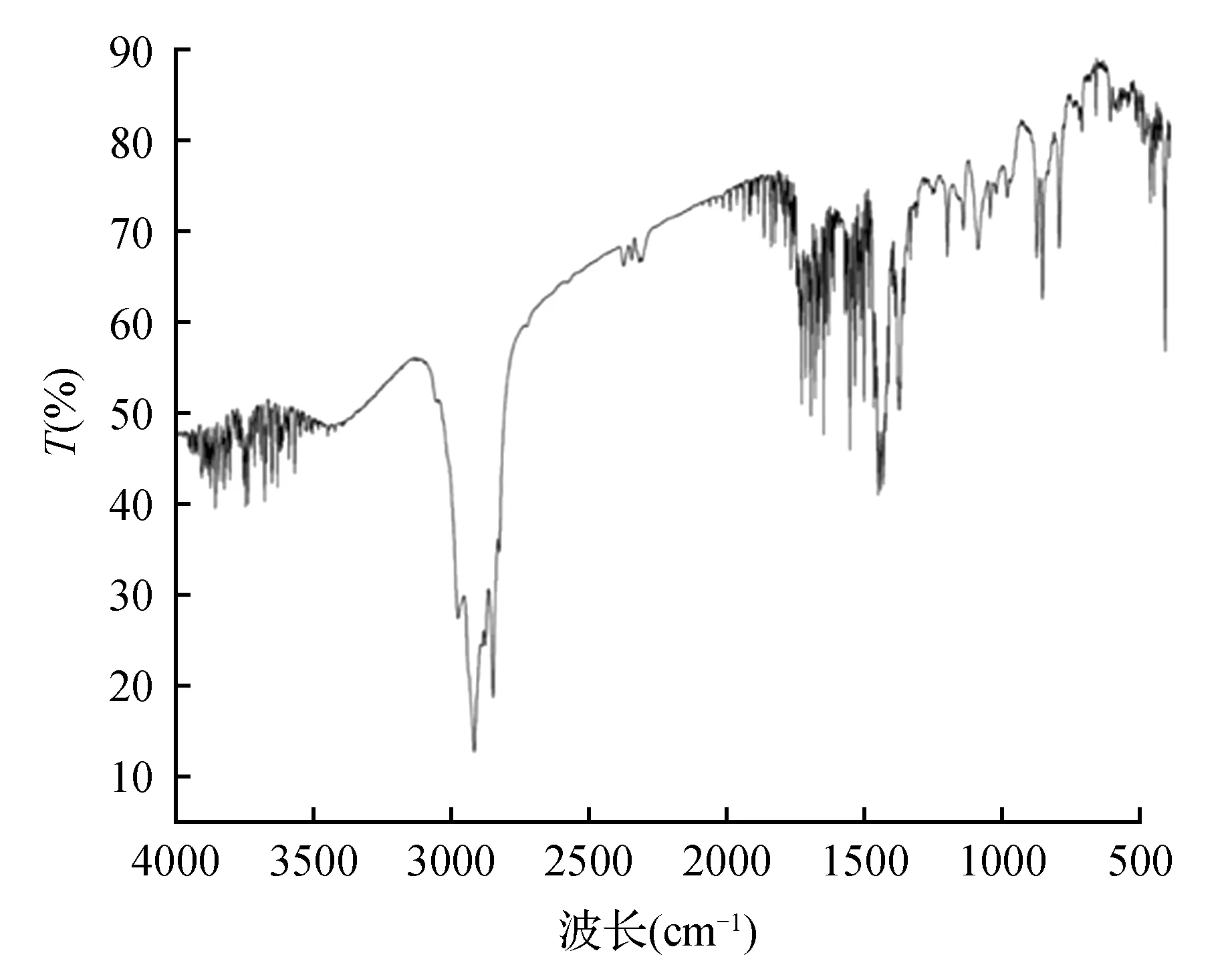
图5 所得杜仲胶的红外光谱图Fig.5 Infrared spectrum of gutta-percha obtained
3 讨论
结果表明,最佳的提取条件为:干燥的杜仲叶经过0.45% NaOH去除角质层并且同时溶出杜仲叶中的一些可溶解性的杂质,之后在pH=6、温度为28℃摇床培养下利用绿色木霉破坏细胞壁纤维素,发酵5天后,剩余物质干燥箱中鼓风干燥,再通过石油醚在温度为85℃、料液比为1∶20、提取次数为1次、提取时间为60 min提取出杜仲胶,最后,与有机溶剂直接提取杜仲胶相比,经过稀碱与绿色木霉联合处理后,首先,除去了杜仲叶表面的角质层,使绿色木霉可以更好的作用于杜仲叶本身,其次经稀碱预处理后的杜仲叶中的可溶性杂质更少,可以使得出的杜仲胶的纯度更高,最后经过稀碱与绿色木霉预处理后的杜仲叶,其结构更加的疏松,这样可以使石油醚更好的渗透进杜仲叶的内部,增大了溶剂于杜仲胶的接触面积,可以更好的提取出杜仲胶。此外,完整的杜仲叶经过稀碱与绿色木霉处理后,其中的木质素含量几乎无变化,其中的纤维素与半纤维素变化最为明显,由预处理前25.65%、18.36%,变化为13.81%、8.35%,脱除率均达到50%,再结合SEM的观察结果可以证明预处理是很有效的。最后将直接石油醚浸提杜仲叶中的杜仲胶与真菌联合稀碱预处理的再由石油醚总得率由0.73%,提升到2.85%,其杜仲胶含量由1.78%,增加到4.36%。但是在实际工业生产中利用微生物进行预处理的工艺还是不够成熟会有有很多的弊端,因此,实际生产中可根据适合的情况选择提取条件。
