表面增强拉曼散射技术对白酒中克百威残留的定性检测
2019-06-11谭文渊陈雨琴付大友王寿峰明红梅
谭文渊,陈雨琴,付大友,王寿峰,明红梅
(四川理工学院化学工程学院,四川 自贡 643000)
酒精饮品的酿制原料来源于农产品,可能因农产品中含有少量氨基甲酸酯类农药而被引入。氨基甲酸酯类农药是在20世纪50—60年代发展起来的有机合成杀虫剂[1-3]。该类农药是一类以甲酸酯为前体化合物发展而来的农药,其结构特性是分子中含有一个N-甲基基团,具有选择性强、分解快、残留期短、低毒、高效等特点,代表品种有克百威、西维因、涕灭威、叶蝉三、巴沙等,这些农药能诱发良性或恶性肿瘤,特别是肺癌与肝癌[4-7]。随着人们对食品安全越来越广泛的关注,对酒精饮料中氨基甲酸酯类农药残留量的测定研究具有极为重要的意义。
目前农残含量的测定方法中高效液相色谱法是检测氨基甲酸酯类农残的传统方法[8],但紫外检测器不够灵敏。由于在普通拉曼光谱测量中,一般物质分子的信号很微弱,使其应用受到限制。表面增强拉曼散射(surface enhanced Raman scattering,SERS)技术可使普通拉曼信号增强,SERS作为一种灵敏度高的定性分析技术,已经被广泛应用到工业控制、生物传感器及食品分析检测领域,符合快速检测的要求[9-16]。本研究采用SERS技术对白酒中的克百威残留进行定性检测,该方法快速、简便、结果可靠[17-18]。
1 材料与方法
1.1 材料与试剂
3 种酒精饮料,均购买自四川省自贡市沃尔玛超市,1号:乙醇体积分数58%(产地北京);2号:乙醇体积分数40%(产地上海);3号:乙醇体积分数43%(产地上海)。
氯金酸(HAuCl4·3H2O) 上海精细化工材料研究所;柠檬酸三钠(NaC6H2O7) 重庆北碚化学试剂厂;抗坏血酸 重庆川东化工试剂厂;克百威 国家农药质检中心(沈阳);2,6-二氯醌-4-氯亚胺 成都市科龙化工试剂厂;实验中所用试剂均为分析纯。
1.2 仪器与设备
紫外分光光度计 美国珀金埃尔默公司;激光显微拉曼光谱仪 赛默飞世尔科技公司;扫描探针显微镜日本精工电子株式会社;恒温磁力搅拌器 上海越众仪器设备有限公司;恒温鼓风干燥箱 上海安亭科学仪器有限公司;电子分析天平 上海舜宇恒平科学仪器有限公司;超声波清洗器 天津奥特赛恩斯仪器有限公司;微量进样器 上海佳安分析仪器厂。所有玻璃容器用配制的王水浸泡24 h后,用蒸馏水将其洗净,再用制得的双蒸水冲洗两次后干燥、待用。
1.3 方法
1.3.1 拉曼光谱仪的参数设置
激发波长780 nm,分辨率4.7~8.7 cm-1,10 倍物镜;波长拉曼光谱范围0~3 200 cm-1,光栅400 gr/mm,功率18 mW,50 μm针孔光栅。
1.3.2 金溶胶的制备及表征
1.3.2.1 金溶胶的制备
将0.85 mL 1%氯金酸溶液加入至100 mL双蒸水中,剧烈搅拌加热至沸腾,再加入1.5 mL 1%的柠檬酸三钠溶液,继续加热搅拌。加入还原剂25 s左右,反应液呈现微弱的蓝色,随着反应的进行溶液变为紫红色,随后停止加热并继续搅拌至溶液冷却至室温,得金溶胶(Au NPS),用棕色容量瓶避光于4 ℃冰箱保存备用[19-21]。
1.3.2.2 金溶胶的表征
Au NPS的吸收光谱测量:用紫外分光光度计获得,扫描波长范围为300~700 nm。Au NPS的粒径测量:用扫描探针显微镜获得。Au NPS滴于云母片表面,将其吹干,制成原子力显微镜样本,对其形貌进行表征。Au NPS SERS表征:罗丹明B(R6G)是检验SERS增强效果常用的染料探针分子,用1×10-4mol/L R6G溶液检验Au NPS的SERS增强效果。将R6G溶液与Au NPS以1∶7均匀混合20 min[22-23]。
1.3.3 Au@Ag NPS的制备及表征
1.3.3.1 Au@Ag NPS制备方法
在编号1~6的烧杯中加入10 mL备用的Au NPS作为种子溶液,并取1.5 mL 0.1 mol/L抗坏血酸溶液搅拌均匀,然后在常温条件下以30 s/drop的速率分别逐滴加入0.5、1.5、2.5、3.5、4.5、5.5 mL硝酸银溶液,同时剧烈搅拌至滴完后30 min,得不同Ag壳厚度的Au@Ag NPS[24-26]。每次用的Au@Ag NPS是实验前新配制的。
1.3.3.2 Au@Ag NPS表征
Au@Ag NPS的吸收光谱测量:将合成的Au@Ag NPS进行吸光度的检测,扫描波长范围为300~700 nm。Au@Ag NPS的SERS表征:将1×10-4mol/L R6G溶液依次与1~6不同Ag壳厚度Au@Ag NPS以1∶7均匀混合20 min,测定拉曼谱图。Au@Ag NPS的背景信号:将双蒸水与SERS增强效果最好的Au@Ag NPS以1∶7均匀混合20 min,测定拉曼谱图。Au@Ag NPS的粒径测量:对SERS表征效果最好的Au@Ag NPS形貌进行表征。
1.3.4 克百威的SERS增强的测定
将200×10-6mol/L克百威乙醇溶液与SERS增强效果最好的Au@Ag NPS以1∶7均匀混合20 min,测定拉曼谱图。
1.3.5 生成络合物的实验条件的测定
1.3.5.1 显色剂及NaOH用量对拉曼强度的影响
在1~5号的烧杯中各加入1 mL 200×10-6mol/L克百威乙醇溶液,再依次加入5 g/L 2,6-二氯醌-4-氯亚胺0.150、0.200、0.225、0.250、0.275 mL,最后各加入525 μL 0.5 mol/L NaOH溶液。反应5 min后,装样于核磁管测定拉曼谱图。在重新编号1~5的烧杯中各加入1 mL 200×10-6mol/L克百威乙醇溶液,0.225 mL 5 g/L 2,6-二氯醌-4-氯亚胺,再依次加入0.5 mol/L NaOH溶液500、525、550、575、600 μL。反应5 min后,装样于核磁管测定拉曼谱图。
1.3.5.2 时间对拉曼强度的影响
在装有0.1 mL的200×10-6mol/L克百威乙醇溶液中加入5 g/L 2,6-二氯醌-4-氯亚胺0.225 mL及0.5 mol/L氢氧化钠溶液0.525 mL。装样于核磁管中,测定反应时间为0、5、10、15、20 min的拉曼谱图。
1.3.6 络合物SERS增强实验条件的测定
1.3.6.1 与络合物混合最佳Ag壳厚度的测定
制备出6 种不同Ag壳厚度的Au@Ag NPS,编号1~6。在编号1~6小烧杯中,按生成络合物测定的最佳比例加入2,6-二氯醌-4-氯亚胺和氢氧化钠溶液,待最佳反应时间后,按络合物与Au@Ag NPS体积比为1∶7依次将1~6 Au@Ag NPS加入1~6小烧杯中。待溶液均匀混合20 min后,装样于核磁管测定拉曼谱图。
1.3.6.2 Au@Ag NPS与络合物最佳混合比例的测定
在编号1~6小烧杯中按生成络合物测定的最佳比例加入2,6-二氯醌-4-氯亚胺和氢氧化钠溶液,待最佳反应时间后,依次按络合物与Au@Ag NPS体积比为1∶5、1∶6、1∶7、1∶8、1∶9、1∶10加入最佳厚度的Au@Ag NPS。待溶液均匀混合20 min后,装样于核磁管测定拉曼谱图。
1.3.6.3 Au@Ag NPS与络合物最佳混合时间的测定
在烧杯中按生成络合物测定的最佳比例加入2,6-二氯醌-4-氯亚胺和氢氧化钠溶液,待最佳反应时间后,按测定的最佳混合比例加入最佳粒径的Au@Ag NPS,均匀混合。将装样于核磁管中,测定溶液混合5、10、15、20、25、30 min的拉曼谱图。
1.3.7 克百威检测下限
将200×10-6mol/L稀释为不同浓度的克百威乙醇溶液,按生成络合物测定的最佳比例加入2,6-二氯醌-4-氯亚胺和氢氧化钠溶液,待最佳反应时间后,按络合物的SERS增强最佳测定条件混合,装样于核磁管测定拉曼谱,直至得不到拉曼特征峰。
1.3.8 样品测定
将样品按生成络合物测定的最佳比例加入2,6-二氯醌-4-氯亚胺和氢氧化钠溶液,待最佳反应时间后,按络合物的SERS增强最佳测定条件混合,装样于核磁管测定拉曼谱图。
1.3.9 增强因子的计算
表面增强拉曼光谱的增强因子是表征SERS效应最重要的数据之一,所以表面增强拉曼光谱基底性能的优劣可以用增强因子来衡量,增强因子越高,说明表面增强拉曼光谱的增强性能越好。SERS测试的用基于化学分析的增强因子的计算公式为:

式中:EF为增强因子;ISERS和INR分别为有SERS基底存在的拉曼光谱峰强度和没有基底存在的普通拉曼光谱峰强度;CSERS和CNR分别为SERS检测和普通拉曼光谱测试的检测分子浓度[27]。
1.4 数据统计与图像处理方法
采用OMNIC软件进行数据处理,采用TQ Analyst™软件进行化学计量学的光谱处理和分析。
2 结果与分析
2.1 金溶胶的紫外表征图
新合成的Au NPS及在4 ℃贮存6 d后的Au NPS的紫外-可见光谱图如图1所示。可知新合成Au NPS最大吸收峰波长为520 nm,峰值为0.92,峰宽为75 nm,峰宽较窄,说明纳米粒子粒径均匀,分散性好;贮存6 d后的Au NPS最大吸收峰波长为520 nm,峰值为0.906,峰宽75 nm。通过比较,波长没有变化,未出现红、蓝移的情况;ΔA=-0.014,变化不大,稳定性较好;峰宽较窄且无变化,说明其粒径分布较好,分散性较好。故制备的Au NPS稳定性较好,适合作为制备Au@Ag NPS的种子溶液。
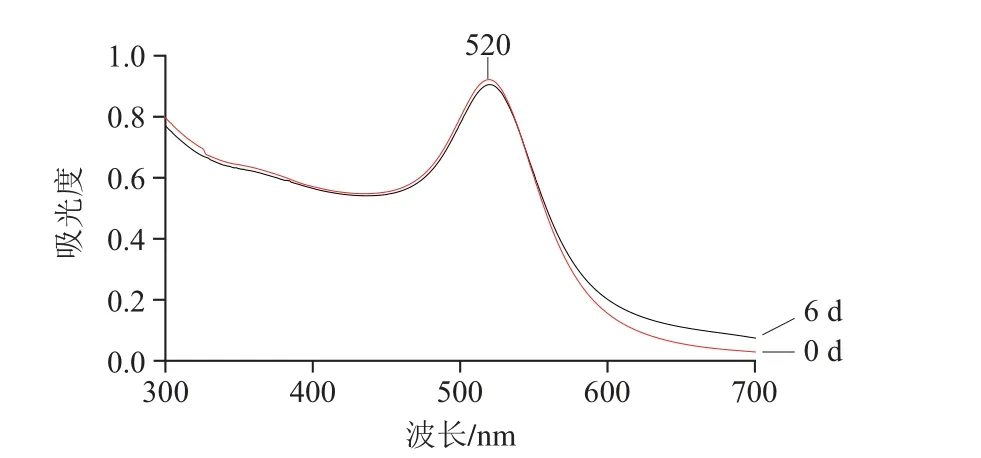
图1 Au NPS紫外-可见光谱对比图Fig. 1 UV-vis spectrum of Au NPS
2.2 Au@Ag NPS的表征
2.2.1 Au@Ag NPS的紫外表征
由图2可知,由于Ag沉积在Au核上,两者互相影响,导致Au NPS的最大吸收峰(520 nm)发生了蓝移,随着Ag壳厚度的增加,代表Ag NPS的最大吸收峰(400 nm左右)逐渐变高,而且也发生了红移。
2.2.2 Au@Ag NPS的SERS表征
1×10-4mol/L R6G与6 种不同Ag壳厚度的Au@Ag NPS的SERS增强光谱如图3所示,每个Ag壳厚度的Au@Ag NPS都能够得到R6G的特征拉曼峰。增强效应最好的是4号Ag壳厚度的Au@Ag NPS。采集1×10-4mol/L R6G溶液及Au NPS与4号Au@Ag NPS对1×10-4mol/L R6G增强效果如图4所示,因为R6G溶液浓度比较小,所以光谱图中并没有得到R6G的特征峰;Au NPS对1×10-4mol/L R6G增强效果不好,Au@Ag NPS增强效果更好,和Au@Ag NPS相比,Au NPS的增强效果几乎忽略不计。所以本实验采用Au@Ag NPS粒子作为SERS基底。
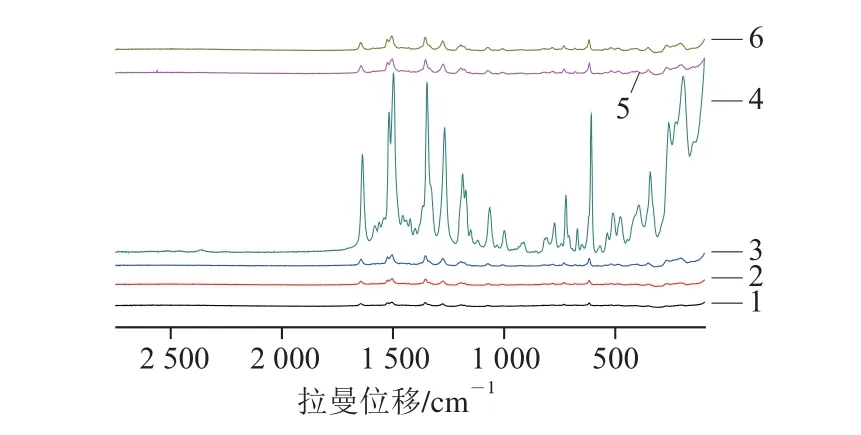
图3 基于不同Ag壳厚度Au@Ag NPS的R6G SERS谱图Fig. 3 R6G SERS spectra of Au@Ag NPS with different Ag shell thicknesses
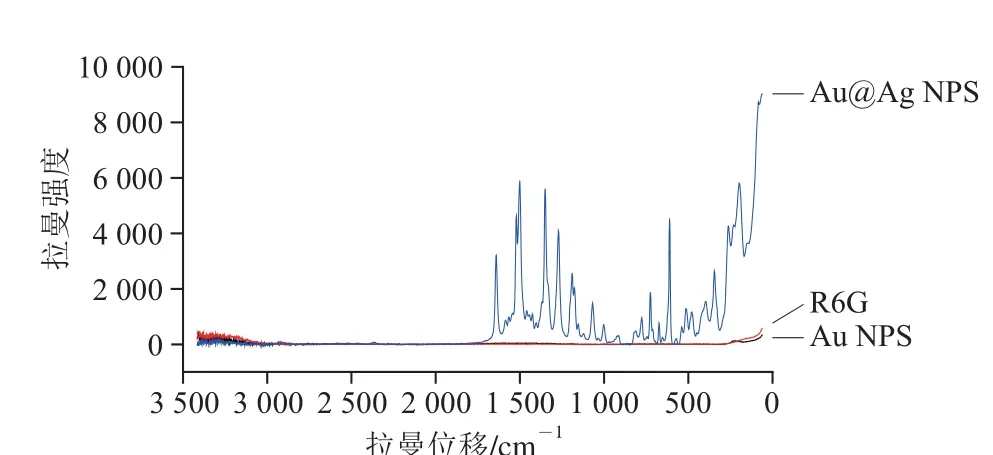
图4 1×10-4 mmooll/L R6G的拉曼谱图及两种粒子对R6G的SERRSS谱图Fig. 4 Raman spectra of 1×10-4 mol/L R6G and SERS spectra of two kinds of nanoparticles
2.2.3 金溶胶及Au@Ag NPS原子力显微镜表征

图5 Au NPS扫描探针显微图Fig. 5 Scanning probe micrograph of Au NPS
从图5可以看出,纳米粒子分布均匀,经粒径分析得纳米粒子的粒径均在30 nm左右。将增强效果最好的第4号Au@Ag NPS做原子力显微镜表征,其结果如图6所示。可以清晰地反映核壳结构,黑色代表Au核,Au核外面的就是银壳,而且纳米粒子分散均匀,经粒径分析,粒径为37 nm左右,与图2对比可知增强效果好的Au@Ag NPS的Ag壳厚度为7 nm。
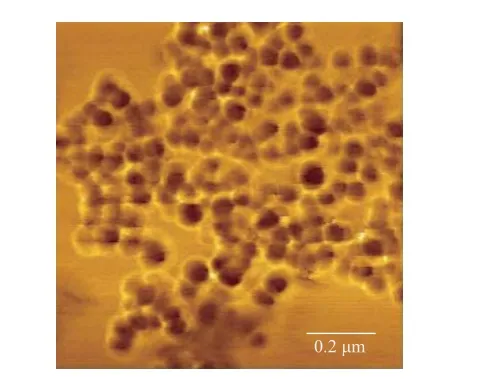
图6 Au@Ag NPS探针扫描显微图Fig. 6 Scanning probe micrograph of Au@Ag NPS
2.3 Au@Ag NPS的背景信号
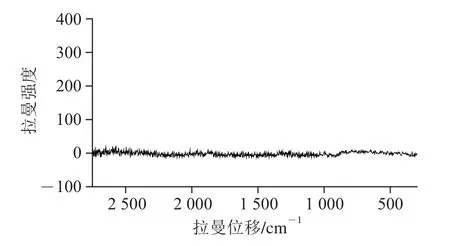
图7 Au@Ag NPS拉曼谱图Fig. 7 Roman spectrum of Au@Ag NPS
由图7可知,以双蒸水作为空白的SERS谱图基本没有信号,说明制备的Au@Ag NPS对所采集的样品SERS信号基本上没有背景信号的干扰。
2.4 克百威的SERS增强
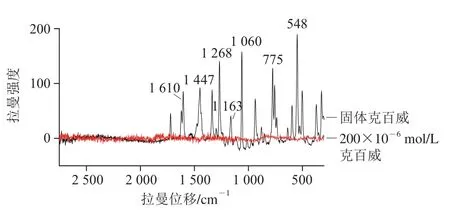
图8 固体及200×10-6 mol/L克百威普通拉曼谱图Fig. 8 Ordinary Raman spectra of solid carbofuran and 200 × 10-6 mol/L carbofuran
分别采集固体克百威和200×10-6mol/L克百威乙醇溶液的拉曼光谱图如图8所示,固体克百威光谱图中,得到1 610、1 447、1 268、1 163、1 060、775、548 cm-1这几个特征峰。而由于200×10-6mol/L克百威乙醇溶液浓度小,所以采集的拉曼光谱图中并没有出现特征峰。用2,6-二氯醌-4-氯亚胺将克百威与Au@Ag NPS偶合在一起,先用2,6-二氯醌-4-氯亚胺与克百威生成络合物,再将络合物与Au@Ag NPS混合在一起,从而将克百威与Au@Ag NPS偶合在一起发生等离子体共振,得到SERS增强信号[28]。
2.5 络合物测定条件的选择
2.5.1 显色剂及NaOH用量的选择
分别测量不同2,6-二氯醌-4-氯亚胺及NaOH用量下络合物的拉曼谱图,以1 180 cm-1左右的拉曼特征峰作为分析的依据,绘制特征峰强度随2,6-二氯醌-4-氯亚胺及NaOH用量的变化的曲线图,由图9可知,随2,6-二氯醌-4-氯亚胺用量的改变,2,6-二氯醌-4-氯亚胺用量为225 μL时,特征峰信号最强,故确定1 mL克百威的2,6-二氯醌-4-氯亚胺用量为225 μL。特征峰强度随NaOH用量的改变而变化,当NaOH用量为525 μL时,特征峰信号最强,所以确定1 mL克百威的NaOH用量为525 μL。
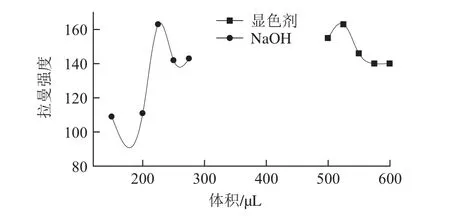
图9 特征峰强度随显色剂用量及NaOH用量变化曲线Fig. 9 Effect of dosage of color developer and NaOH on characteristic peak intensity
2.5.2 测定时间的选择
测量不同时间下络合物的拉曼谱图,根据测得的光谱图,以1 180 cm-1左右的拉曼特征峰作为分析的依据,绘制特征峰强度随时间的变化如图10所示。特征峰强度随着时间的变化发生了变化,在反应5 min时,特征峰强度最大。
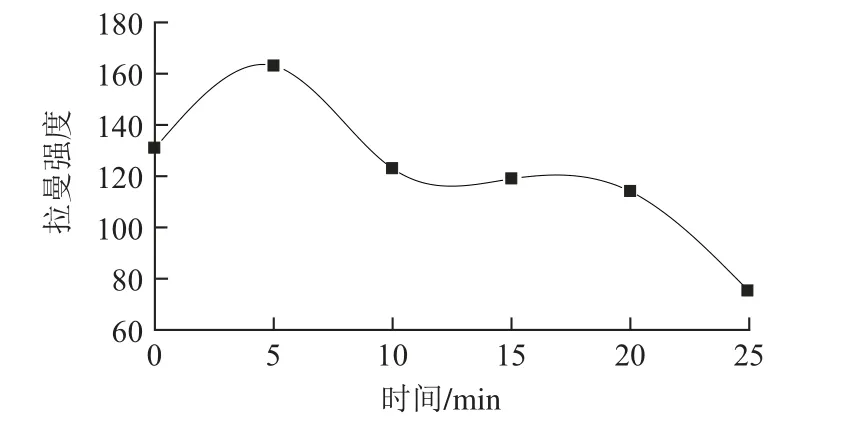
图10 特征峰强度随时间变化曲线Fig. 10 Time course curve of characteristic peak intensity
2.6 络合物SERS增强测定条件的选择
2.6.1 最佳Ag壳厚度的选择
由图11可以看出,与R6G一样,同样是第4号7 nm Ag壳厚度的Au@Ag NPS具有最强的拉曼增强效应。综合R6G和络合物的SERS结果,基于Au@Ag NPS的拉曼增强效应与Ag壳有关,则7 nm Ag壳厚度的Au@Ag NPS具有最强等离子体共振而具有最强的SERS效应。
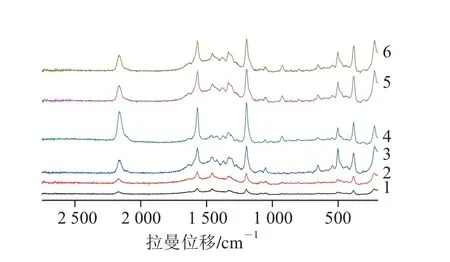
图11 不同Ag壳厚度Au@Ag NPS络合物SERS谱图Fig. 11 SERS spectra of Au@Ag NPS complexes with different thicknesses of Ag shell
2.6.2 最佳比例的选择
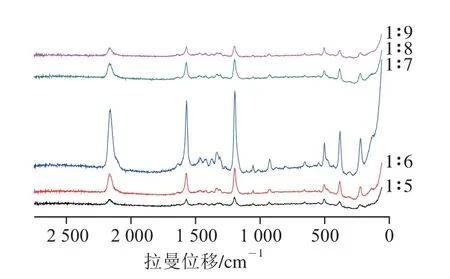
图12 络合物溶液与Au@Ag NPS不同比例混合SERS谱图Fig. 12 SERS spectra of mixtures of the complex with Au@Ag NPS at different proportions
由图12可知,随比例的改变特征峰强度也发生变化,其中当络合物溶液与Au@Ag NPS以1∶7的比例混合时,SERS增强效果最好。
2.6.3 最佳时间的选择
测量络合物溶液与Au@Ag NPS混合时间的SERS谱图,以1 193 cm-1左右的拉曼特征峰作为分析的依据,绘制特征峰强度随时间的变化的曲线如图13所示,随着时间的延长,特征峰强度先增大再逐渐减小,在20 min时,测得的特征峰强度最大,SERS增强效果最好。
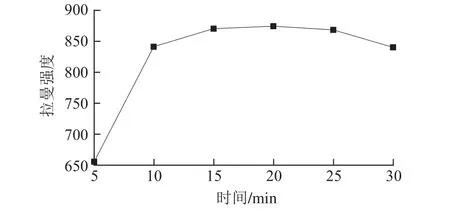
图13 络合物与Au@Ag NPS混合时间变化Fig. 13 Effect of mixing time between Au@Ag NPS and the complex on Raman intensity
2.7 络合物SERS增强光谱分析
为了更好地分析络合物的特征峰,采集固体2,6-二氯醌-4-氯亚胺的固体拉曼谱图,固体克百威的拉曼谱图,按最佳选择条件生成的络合物溶液的拉曼谱图及其SERS谱图如图14所示,络合物的主要特征峰有:1 618、1 443、1 347、1 180、1 045、8 68、460、37 cm-1;固体克百威的主要特征峰有:1 610、1 445、1 268、1 170、1 056、775、545 cm-1;固体2,6-二氯醌-4-氯亚胺的主要特征峰有:1 674、1 621、1 512、1 295、913 cm-1,根据查阅相关资料[29-30],可知络合物有几处峰与克百威相似而2,6-二氯醌-4-氯亚胺没有,如1 443、1 180、1 045 cm-1,所以此化合物能够用来代表克百威进行SERS增强的研究。SERS谱图峰形尖锐且基线平滑,表明合成的Au@Ag NPS对克百威和2,6-二氯醌-4-氯亚胺生成的络合物具有很强的拉曼增强作用。被增强后的主要拉曼峰位于1 570、1 333、1 193、381 cm-1,而且在2 157 cm-1处还出现了新的峰,与非SERS谱图中1 618、1 347、1 180、370 cm-1几处对应峰相比较可以发现:出峰的位置发生了偏移,说明在吸附之后,络合物分子的结构信息发生了一定的改变[31]。

图14 SERS和普通拉曼谱图Fig. 14 SERS and normal Raman spectra of the complex
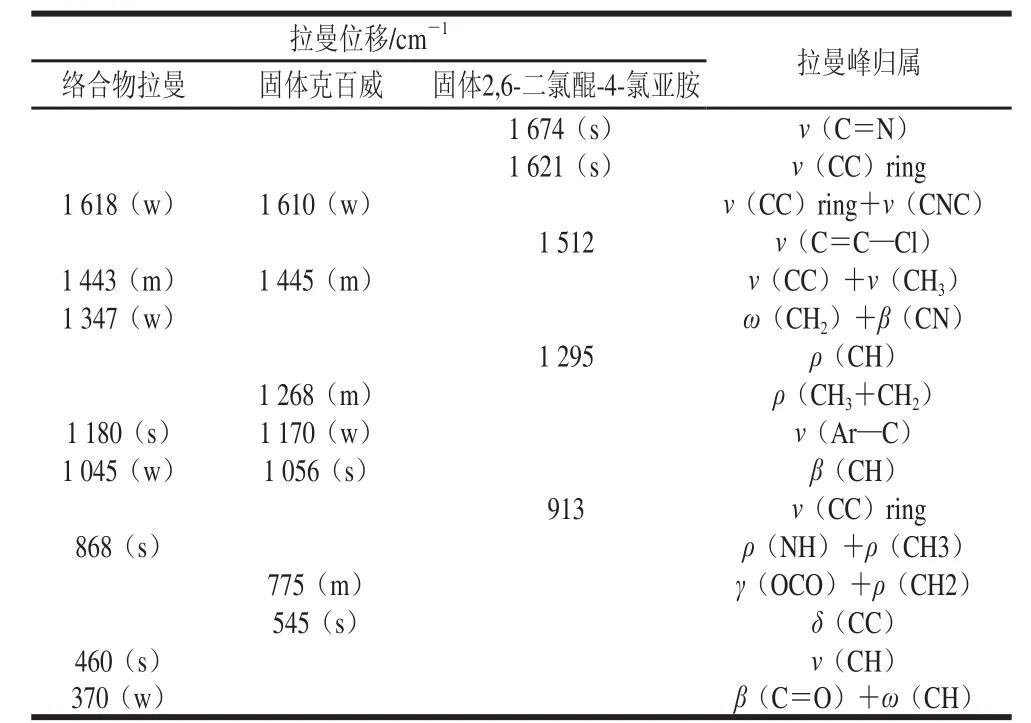
表1 络合物,固体克百威,固体显色剂拉曼谱图中的峰位归属Table 1 Raman peak position assignment of the complex, solid carbofuran and solid color developer
2.8 克百威检测下限的确定
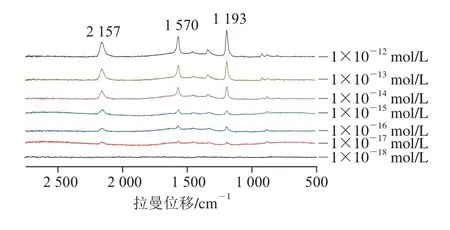
图15 不同浓度克百威SERS谱图Fig. 15 SERS spectra of carbofuran at different concentrations
由图15可以看出,在1×10-12mol/L时,2 157、1 570、1 193 cm-1这3 个特征峰仍十分明显,随着克百威浓度减小,特征峰强度也在不断减小,浓度低至1×10-18mol/L时完全无信号,1×10-17mol/L时信号极其微弱,SERS谱图上几乎无增强信号,所以Au@Ag NPS对克百威的检测下限为1×10-16mol/L。
2.9 样品的测定结果
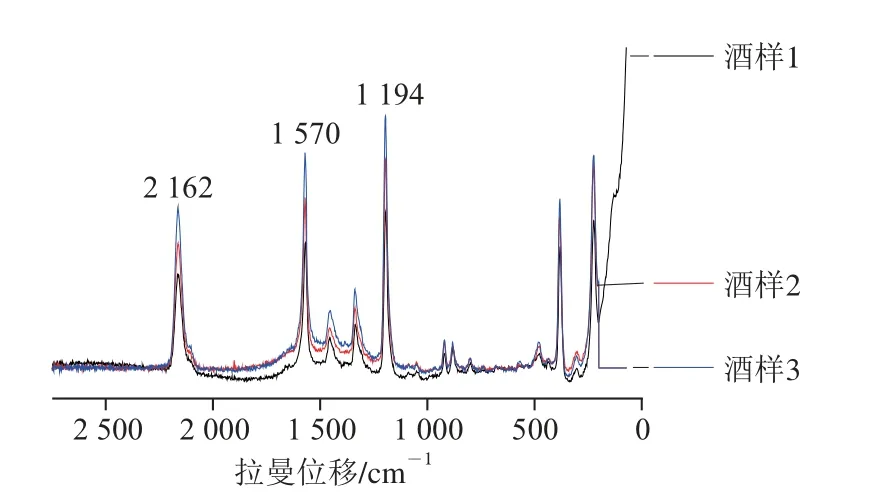
图16 酒样SERS谱图Fig. 16 SERS spectra of Chinese liquors
由图16可以看出,3 个酒样谱图中均出现克百威与2,6-二氯醌-4-氯亚胺生成的络合物特征峰2 162、1 570、1 194 cm-1,说明这3 个酒样均含有一定量的克百威。
2.10 增强因子的计算
为了确定克百威在Au@Ag NPS中的增强效果,现根据图14络合物的普通拉曼以及SERS谱图和图15不同浓度克百威的SERS谱图,由于2 157 cm-1的特征峰是新增的,普通拉曼图中没有这个峰,1 570 cm-1在固体克百威和2,6-二氯醌-4-氯亚胺中都有相对应的特征峰,而1 193 cm-1是克百威有相对应的峰但2,6-二氯醌-4-氯亚胺没有的,所以把1 193 cm-1作为特征峰估计增强因子。表面拉曼增强检测ISERS为760 AU,CSERS为1×10-12mol/L;普通拉曼检测INR为844 AU,CNR为2×10-4mol/L。将CSERS、ISERS、CNR、INR代入式(1)进行计算,得出制备的Au@Ag NPS对克百威的增强因子为2×108。这说明制备的Au@Ag NPS对克百威的增强效果很明显。
3 结 论
本实验制备的两种纳米粒子:Au NPS、不同Ag壳厚度Au@Ag NPS,通过探测分子R6G比较Au NPS和不同Ag壳厚度Au@Ag NPS的SERS增强效果。结果表明7 nm Ag壳厚度Au@Ag NPS增强效果最好,可作为SERS增强基底。其次,引入2,6-二氯醌-4-氯亚胺做标记物,用2,6-二氯醌-4-氯亚胺将克百威与Au@Ag NPS偶合在一起,在碱性条件下,先将2,6-二氯醌-4-氯亚胺与克百威生成蓝绿色络合物,再与Au@Ag NPS混合,对络合物进行普通拉曼采集以及SERS信号采集最佳条件讨论,并对光谱的谱峰进行比较和归属。最后,用最佳方法对不同浓度克百威-乙醇溶液SERS检测,得出Au@Ag NPS对克百威的检测下限为1×10-17mol/L,计算得到Au@Ag NPS增强因子为2×1012。并用此方法检测3 种酒精饮料中是否含有克百威,结果表明,3 种酒精饮料均含有一定量的克百威。
