超高效液相色谱-串联质谱法测定豆芽中植物生长调节剂残留量的不确定度评定
2019-06-11张居舟余晓娟
李 静,张居舟*,余晓娟,刘 毅
(安徽省食品药品检验研究院,安徽 合肥 230051)
豆芽因其烹饪方式不拘一格、营养丰富,且生产不受节令变化、区域限制而成为老百姓喜爱的家常菜。然而,一些不法商贩为牟取高额利润,在豆芽生产过程中滥用人工合成化学植物生长调节剂,企图缩短豆芽生长周期,提高发芽率,增加芽菜颜值等,以致“毒豆芽”“问题豆芽”事件层出不穷[1-9]。添加的植物生长调节剂主要为多效唑、吲哚乙酸和吲哚丁酸等,长期食用会影响人体内分泌和代谢平衡等[9-11]。为确保食用安全,我国已明令禁止赤霉素等植物生长调节剂不再作为食品加工助剂,而多效唑等植物生长调节剂则被列为农药范畴,严格控制其残留量[12-13]。由于植物生长调节剂品种繁多,化学性质和生物特性各异,残留水平较低,基质干扰较为严重,为确保检测结果的准确性,须进行测量不确定度的评定。目前仅有6-苄基腺嘌呤的非标准方法的不确定度报道[14],而多效唑等指定方法标准的不确定度研究尚处于空白。
测量不确定度是表征合理地赋予被测量之值的分散性,与测量结果相联系的参数,其数值的大小反映了测量结果质量的高低,并直接与检验结果的合格判定相关[15-21]。本实验参照JJF 1059.1—2012《测量不确定度评定与表示》[22]和JJF 1135—2005《化学分析测量不确定度评定》[23],通过BJS 201703《豆芽中植物生长调节剂的测定》[24]评定豆芽中多效唑、吲哚乙酸和吲哚丁酸3 种植物生长调节剂残留量检测的不确定度,以期为实验室质量控制提供科学、准确、可信的依据,同时为测量其他植物生长调节剂残留量的不确定度评定提供参考。
1 材料与方法
1.1 材料、试剂与仪器
豆芽 市购。
吲哚乙酸标准溶液(100 μg/mL)、吲哚丁酸标准溶液(100 μg/mL)、多效唑标准溶液(100 μg/mL)上海市农药研究所。
1290-6495型超高效液相色谱-串联质谱仪 美国Agilent公司;移液器 美国Gilson公司;XS4002S型电子天平 瑞士梅特勒公司。
其余试剂、材料和设备参见BJS 201703的要求。
1.2 方法
1.2.1 样品前处理
按照BJS 201703的要求提取后,取上层乙腈溶液5 mL置于QuEChERS离心管(含300 mg无水硫酸镁和100 mg C18)中,涡旋2 min,以14 000 r/min离心5 min,精密移取4 mL上清液于离心管中,于45 ℃水浴中氮吹至近干,用甲醇定容至1 mL,涡旋混匀,离心5 min,0.22 μm有机相滤膜过滤后,供UPLC-MS/MS测定。
1.2.2 超高效液相色谱条件
色谱柱:Agilent Eclipse Plus C18RRHD(2.1 mm×50 mm,1.8 μm);进样量:5 μL;流速:0.3 mL/min;柱温:40 ℃;流动相:A为0.1%甲酸溶液,B为乙腈;梯度洗脱程序:0~1 min,维持10% B;1~3 min,10% B线性变至60% B;3~5 min,60% B线性变至90% B;5~7 min,维持90% B;7~7.1 min,线性变至10% B。
1.2.3 质谱条件
离子源:电喷雾离子源,正离子模式扫描;多反应监测;毛细管电压3 000 V;干燥气温度230 ℃;干燥气流速18 L/min;鞘气温度320 ℃;鞘气流速12 L/min;喷嘴电压500 V;雾化气压力30 psi。主要质谱参数见表1。
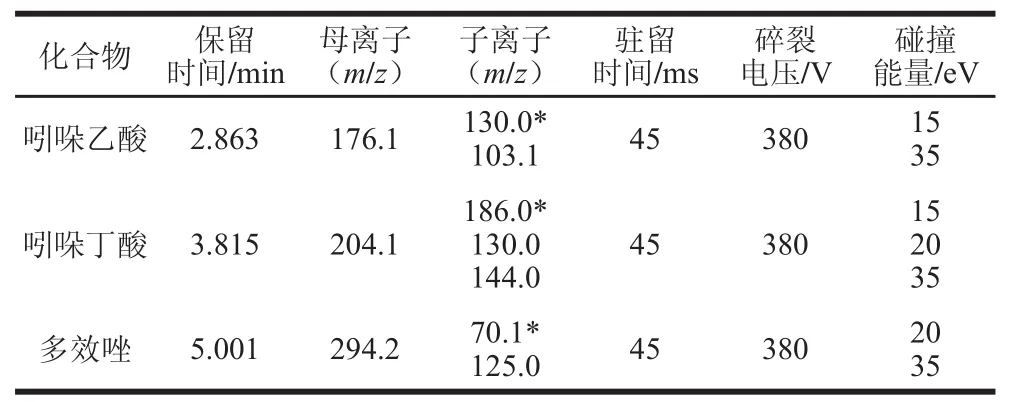
表1 种植物生长调节剂的主要质谱参数Table 1 Main mass spectrometric parameters for three plant growth regulators
1.2.4 数学模型的建立
按照BJS 201703的测定方法及结果计算,待测物的含量按(1)式计算:

式中:X为试样中待测组分的含量/(μg/kg);C为从标准工作曲线中读出的试样溶液中待测组分的质量浓度/(μg/L);V为试样溶液最终定容体积/mL;f为试样制备过程中的稀释倍数,本方法中为5;m为称样量/g。
标准工作曲线由最小二乘法进行线性拟合而成,外标法定量,并根据标准工作曲线以峰面积计算得到待测组分的质量浓度。标准溶液配制、体积量取等影响不确定度的相关因素之间采取多元回归分析,确定多个变量的因果关系,建立预测的数学模型。
2 结果与分析
2.1 不确定度的来源分析
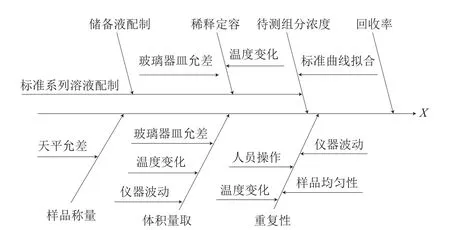
图1 3 种植物生长调节剂的不确定度来源Fig. 1 Uncertainty sources for determination of three plant growth regulators
根据本实验的测定过程,对豆芽中植物生长调节剂残留量的测定结果有影响的各种不确定度的分量进行分析,具体引入的不确定度来源如图1所示。
2.2 不确定度的评定
2.2.1 试样称量产生的不确定度u(m)
使用去皮称量,称取10.00 g豆芽样品,天平校准证书说明最大允许误差为±0.01 g,假设按矩形分布[15],其不确定度u(m)=0.01/ =0.0058 g;urel(m)=u(m)/m=0.000 58。
2.2.2 体积量取产生的不确定度u(V)
2.2.2.1 提取液总体积引入的不确定度u(V1)
用20 mL单标吸量管移取V1为20 mL 1%甲酸的乙腈提取液,按A类评定,其体积允差为±0.03mL,假设按矩形分布,其不确定度u(V1-1)=0.03/ =0.017 32mL;若温度允差为±5 ℃,则温度变化引起的不确定度u(V1-2)=。故u=0.0 8 0 9 m L,urel(V1)=u(V1)/V1=0.004 0。
2.2.2.2 浓缩体积引入的不确定度u(V2)
用5 mL分度吸量管移取V2为4 mL 1%甲酸的乙腈净化液进行浓缩,按A类评定,其体积允差为±0.025 mL,假设按矩形分布,其不确定度u(V2-1)=0.025/ =0.014 43 mL;若温度允差为±5 ℃,则温度变化引起的不确定度u(V2-2)=4×5×0.015 82mL。故u(V2)0.015 8 mL,urel(V2)=u(V2)/V2=0.004 0。
2.2.2.3 最终定容体积引入的不确定度u(V3)
试样净化液经氮吹浓缩后,用1 mL单刻度吸量管移取V3为1 mL甲醇溶解残渣,按A类评定,其体积允差为±0.007 mL,假设按矩形分布,其不确定度u(V3-1)==0.004 04 mL;若温度允差为±5 ℃,则温度变化引起的不确定度u(V3-2)==1×5×1.1×故=0.005 1 mL,urel(V3)=u(V3)/V3=0.005 1。
2.2.3 待测物引入的不确定度
待测物(C)的不确定度来源由两个因素组成,即标准系列溶液配制和由标准曲线拟合时所产生的不确定度。其中标准系列溶液配制包括储备液配制、稀释及标准曲线溶液配制3 个部分[25-28]。
2.2.3.1 储备液配制过程引入的不确定度u(C1)
由标准证书可知,吲哚乙酸、吲哚丁酸及多效唑标准溶液相对不确定度均为urel(C1)=0.040 0。
2.2.3.2 储备液稀释过程引入的不确定度u(C2)
分别用1 mL单标线吸量管移取1 mL吲哚乙酸和吲哚丁酸储备液、用0.2 mL分度吸量管移取0.2 mL多效唑储备液于100 mL容量瓶中,甲醇定容至刻度,摇匀,得到吲哚乙酸和吲哚丁酸为1 μg/mL、多效唑为0.2 μg/mL质量浓度的混合标准溶液。按照矩形分布处理,参考GB/T 12806—2011《实验室玻璃仪器 单标线容量瓶》[29]和JJG 196—2006《常用玻璃量器检定规程》的要求[30],按A类评定,玻璃器皿及温度波动引入的不确定度见表2;则储备液稀释过程引入的相对标准不确定度吲哚乙酸和吲哚丁酸按urel计算,多效唑按
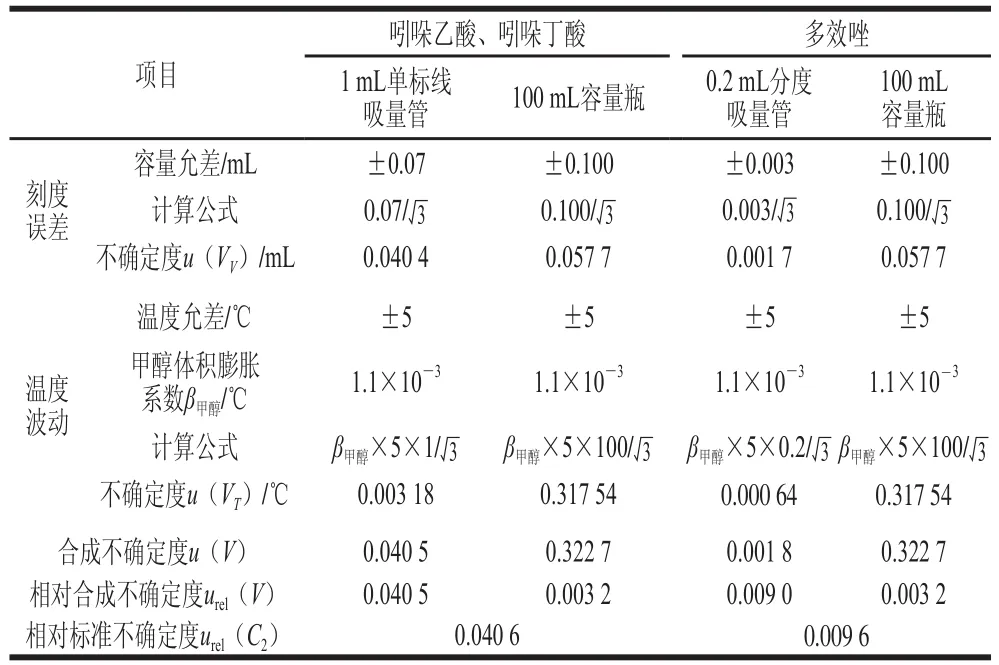
表2 储备液稀释过程中引入的不确定度Table 2 Uncertainty resulting from dilution of stock solution
2.2.3.3 标准系列溶液配制过程产生的不确定度u(C3)
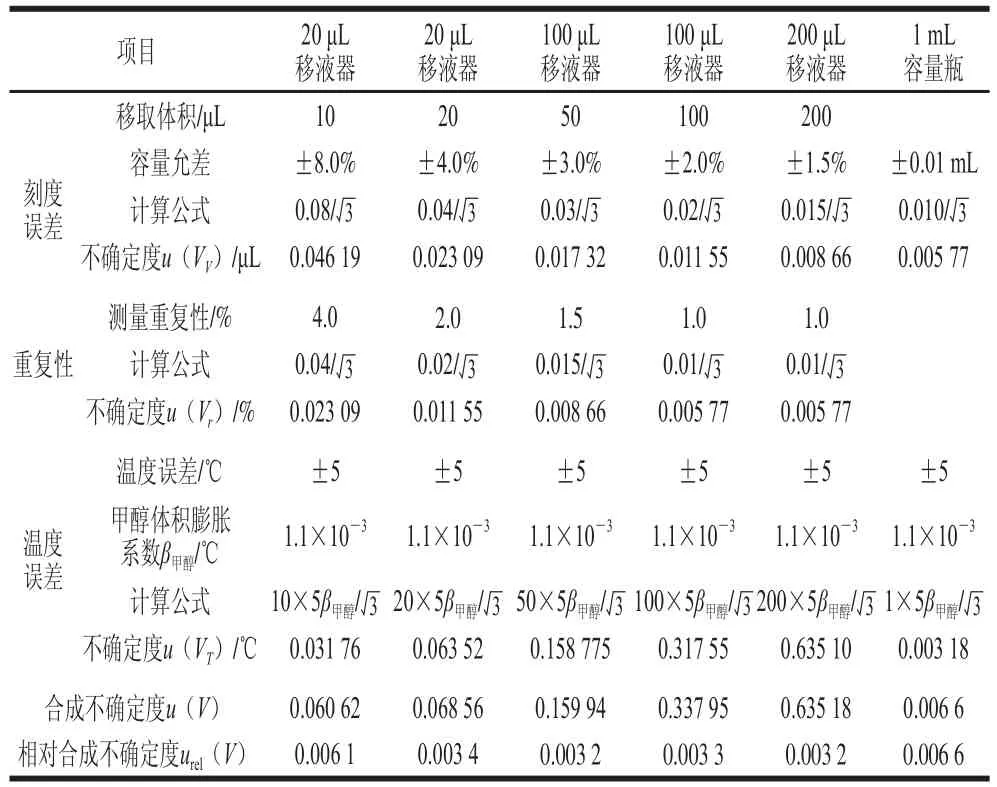
表3 标准系列溶液配制过程引入的不确定度Table 3 Uncertainty resulting from preparation of standard solution
使用20、100、200 μL移液器分别移取10、20、50、100、200 μL混合标准溶液于1 mL容量瓶中,用空白豆芽基质溶液定容至刻度,得到质量浓度分别为10、20、50、100、200 μg/L的标准系列工作溶液,其中多效唑的质量浓度为2、4、10、20、40 μg/L。移液器的刻度误差参考JJG 646—2006《移液器检定规程》的要求[31],按A类评定,如表3所示。则标准系列溶液配制过程引入的相对标准不确定度为
2.2.3.4 标准曲线拟合产生的不确定度u(C4)
将空白豆芽基质溶液配制的5 种不同质量浓度的标准系列溶液,各取5 μL分别重复进样3 次,以峰面积(Ai)为纵坐标,标准溶液浓度(Ci)为横坐标,采用最小二乘法拟合而成的线性回归方程为Ai=aCi+b,测定数据及计算结果如表4。取一阳性样品,对各待测化合物浓度C0进行3 次重复测定,其结果见表5,则由标准曲线拟合产生的不确定度按(2)式计算:
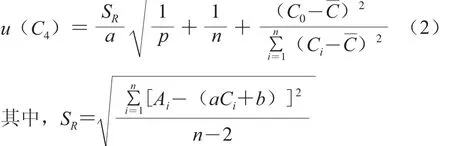
式中:SR为标准溶液待测物峰面积残差的标准差;a为斜率;b为截距;p为对样品溶液C0的测定次数,p=3;n为标准溶液测试次数,本实验中5 个质量浓度重复测定3 次,n=5×3=15;Ai为标准溶液各点的待测物的峰面积;Ci为标准溶液各点的待测物的质量浓度;C0为校准方程求得的阳性样品溶液中待测物的质量浓度;
为标准溶液的平均质量浓度,则相对标准不确定度urel(C4)=u(C4)/C0,结果见表6。
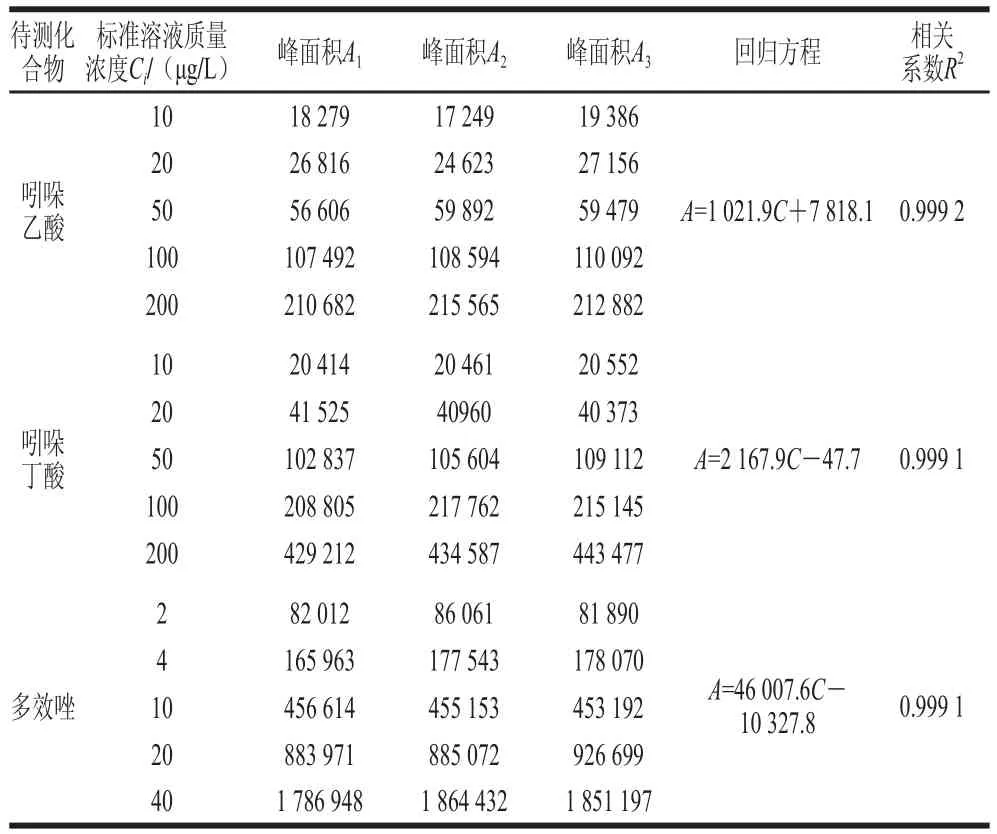
表4 标准曲线数据Table 4 Results of standard curves
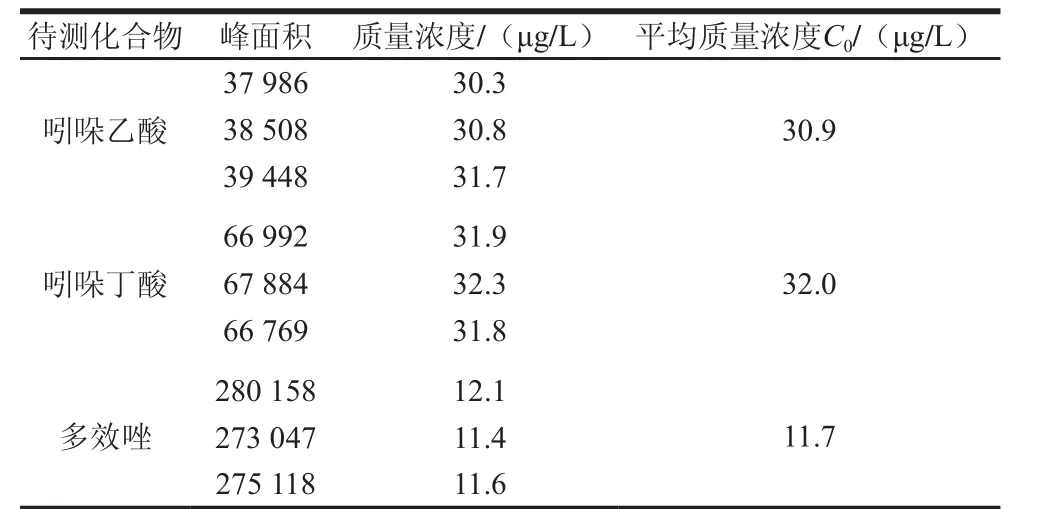
表5 阳性样品测定结果Table 5 Results of determination of positive samples
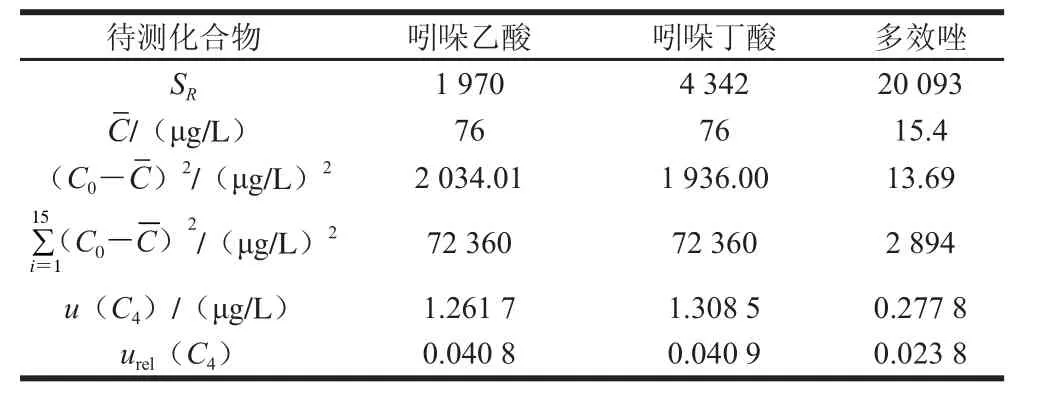
表6 曲线拟合引入的不确定度相关量Table 6 Calculation of uncertainty resulting from curve fitting
2.2.4 重复性产生的不确定度u(X)
在空白豆芽试样中添加水平为7.5 μg/kg多效唑和25 μg/kg吲哚乙酸及吲哚丁酸的标准溶液,平行测定10 次。将重复测定的含量平均值X、标准偏差S(X)结果分别代入公式u(X)=u(X)/X)=S(X)/ 和urel(X,由重复性引入的不确定度和相对不确定度结果如表7所示。
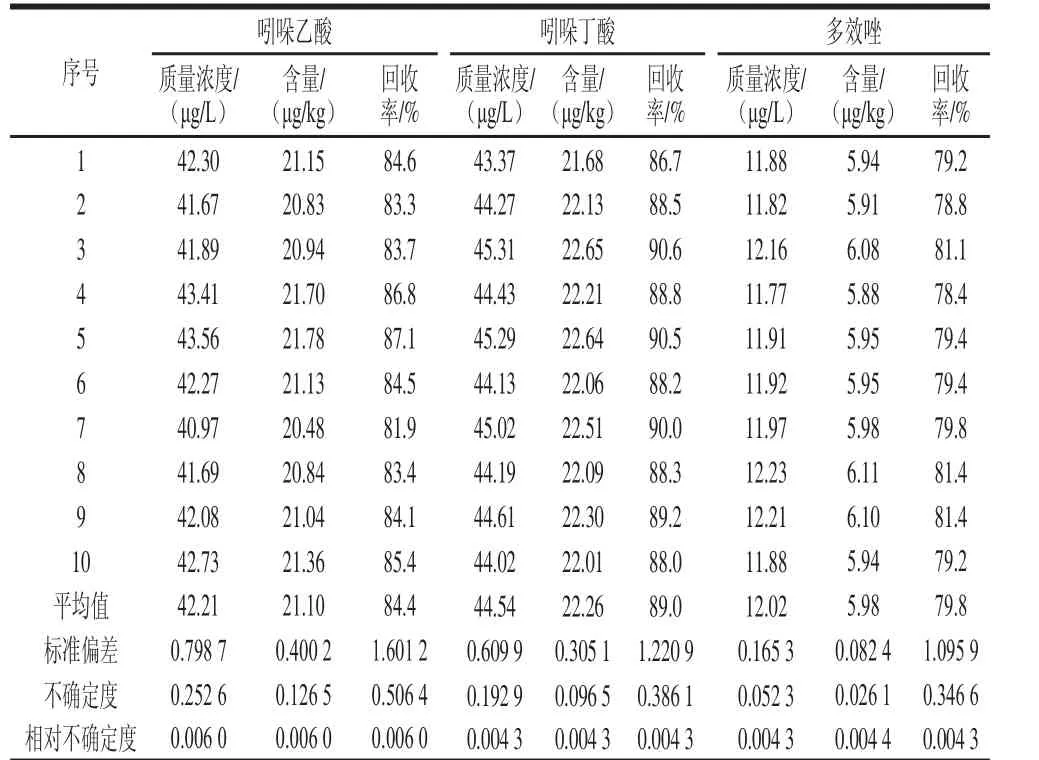
表7 豆芽中吲哚乙酸、吲哚丁酸和多效唑的测定结果Table 7 Results of determination of indole-3-acetic acid,3-indolebutyric acid and hydrochloride in bean sprouts
2.2.5 回收率产生的不确定度u(R)
测量回收率结果列于表7,按A类评定,将平均回收率、标准偏差S(R)的结果分别代入公式u(R)=(R)=u(R)/R,则得到回收率引入的不确定度和相对不确定度。
2.3 合成不确定度
3 种植物生长调节剂的相对不确定度分量见表8,若不考虑各不确定度的相关性,则其合成不确定度按公式计算。

表8 3 种植物生长调节剂相对不确定度分量Table 8 List of relative uncertainty components for three plant growth regulators
2.4 扩展不确定度及结果表示
依据CNAS-GL006:2018《化学分析中不确定度的评估指南》[15],在95%置信区间,对于大多数测量选择包含因子k=2,则扩展不确定度由此得到豆芽中3 种植物生长调节剂含量的结果,详见表9。
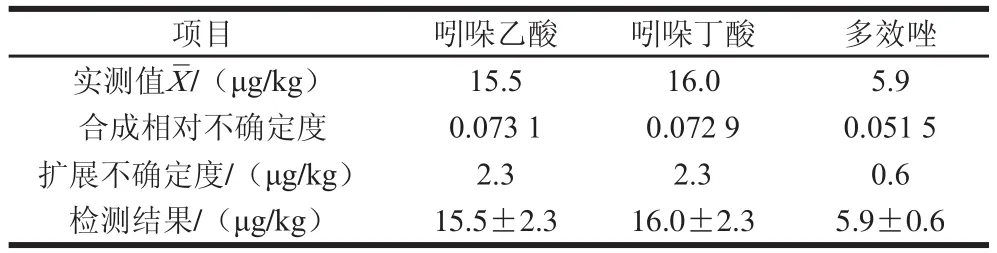
表9 3 种植物生长调节剂不确定度评定结果Table 9 Uncertainty evaluation for the determination of three plant growth regulators
3 结 论
从豆芽中3 种植物生长调节剂的测量不确定度评定过程可知,实验的前处理、质谱测定、数据处理等过程均会引入不确定度。本研究系统深入地对标准溶液配制、标准溶液稀释、实验环境温度、玻璃器皿、重复性、回收率、样品称量、体积量取等因素进行综合考量,结果表明,标准溶液配制和标准曲线拟合过程引入的不确定度最大,其次是重复性、回收率和体积量取,而样品称量引入的不确定度可忽略不计。因此,在实验操作过程中,可采取增加标准曲线溶液和平行样品的测定次数,保持超高效液相色谱-质谱联用仪良好的稳定性和较高的灵敏度,对标准溶液定期开展期间核查,对仪器进行校准或检定,提升实验员的操作水准等途径,以减小测量的不确定度,从而确保检测结果的准确性和可信度。
