罗非鱼鱼鳞柠檬酸-苹果酸钙的制备及产物鉴定
2019-06-11谭南峰李春海周惠敏
张 玲,谭南峰,李春海,*,周惠敏,张 钟,李 雯
(1.广东省岭南特色果蔬加工及应用工程技术研究中心,广东普通高校食品科学创新团队,广东 茂名 525000;2.广东石油化工学院生物与食品工程学院,广东 茂名 525000)
我国是世界淡水鱼生产大国,罗非鱼是我国主要的淡水经济鱼种,也是联合国推荐养殖的优质水产养殖品种之一,2017年我国罗非鱼产量接近180万 t[1-2]。鱼鳞是罗非鱼加工下脚料中的主要副产物,加工过程中会产生约占体质量1%~2%的鱼鳞。近年来研究发现,鱼鳞含有丰富的蛋白质和多种矿物质,其中有机物占41%~55%,磷酸钙占38%~46%,还含少量碳酸钙、磷酸镁、磷酸钠等无机盐[3-4]。但在生产过程中,鱼鳞往往仅加工成低廉的饲料或直接视为垃圾处理掉。如果能对罗非鱼鱼鳞加以高值利用,既可解决环境污染问题,又可促进水产品加工废弃物的综合利用,并带来丰厚的经济效益。
柠檬酸-苹果酸钙(calcium citrate malate,CCM)又名果酸钙,是柠檬酸和苹果酸与钙离子复合构成的钙盐,是一种新型的钙营养强化剂,具有溶解性高、吸收利用性强、减少铁吸收阻碍、风味良好、安全无毒等特点,还能抑制肾结石的产生,既可以作为食品添加剂,也可直接制成补钙保健品,又可用于药品中,是国际公认的优秀钙源,具有广泛的开发应用前景[5-7]。CCM可以直接用作补钙保健品,也可作为钙强化剂,添加到面包、饼干、糕点、糖果、奶粉及早餐食品和风味小吃中制成功能性食品,用于钙强化饮料可以添加到牛奶、豆乳饮料等饮料中。用CCM作为钙强化剂的饮料已在世界多个地区销售。美国(1986年)、日本(1990年)、欧洲(1991年)已经开始销售。日本卫生福利部已批准CCM作为“特殊健康食品”的原料,加拿大政府已批准CCM吞服片和咀嚼片作为医药上的钙质补充剂[8-10]。据报道,CCM具有高吸收利用性可能与其组成成分柠檬酸和苹果酸是体内三羧酸循环的中间代谢产物有关,随着构成CCM的柠檬酸和苹果酸组分在体内进入三羧酸循环参与代谢,CCM则缓慢地释放出钙离子,从而提高了CCM的吸收利用性[11]。Smith等[12]以10 名21~31 岁的女性为对象,用双重同位素法比较CCM和碳酸钙的吸收利用率,结果显示,来自CCM的钙吸收利用率为37.3%,明显高于碳酸钙(29.6%)的吸收利用率。
目前,关于CCM研究的重点主要集中于生产工艺和应用等方面。我国已有少部分食品添加剂企业进行了CCM的试生产,并有小批量产品上市,但关于制备原料的配比、合成工艺条件与产品溶解度之间的关系,以及CCM结构探讨、吸收率等方面部分研究仍处于起步阶段,开展相关研究具有重要的意义[5,13-14]。
鱼鳞骨质层中含有的钙质以羟基磷灰石[Ca10(OH)2(PO4)6]形式存在,其溶出较为困难。目前提取钙的方法主要有酸法(包括盐酸、乳酸、柠檬酸等)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)法和其他物理辅助法(超声波、微波等)[15-16]。国内脱除鱼鳞中钙的方法主要有酸法和EDTA法,这两类方法存在反应时间长或酸用量多等缺点,且脱除的钙几乎无法回收,不利于资源的经济型利用。近年来,超声波技术在天然产物提取中已显示出巨大的优势,利用超声波产生的强烈振动、空化效应、搅拌作用等可以加速细胞中有效成分进入溶剂,提高提取率,缩短提取时间,节省溶剂,简化提取操作步骤[17]。与超临界流体萃取相比,超声波萃取的设备更加简单,可以提取多种化合物,无论其极性如何,因为超声波萃取可用任何一种溶剂;与微波辅助萃取相比,超声波萃取的步骤更少,萃取过程简单,不易对萃取物造成污染,更安全,某些情况下的萃取速度更快[18]。
本研究以罗非鱼鱼鳞为原料,采用超声辅助制备CCM,通过单因素试验和正交试验确定CCM的最佳制备工艺条件,并对产物进行扫描电镜观察、X射线衍射(X ray diffraction,XRD)、傅里叶红外光谱、比表面积及孔径分析;本方法在一定程度上可取代传统的盐酸法脱鱼鳞钙的操作,产品是国际公认的良好钙源,产品及生产技术应用空间较大。
1 材料与方法
1.1 材料与试剂
罗非鱼鱼鳞由广东百维生物科技有限公司提供。
DL-苹果酸(食品级) 郑州市食代添骄化工产品有限公司;柠檬酸(食品级) 天津市百世化工有限公司;氧化镧(分析纯) 天津市光复精细化工研究所;柠檬酸钙(分析纯) 天津市大茂化学试剂厂;苹果酸钙(分析纯) 广东翁江化学试剂有限公司;硝酸、盐酸(均为分析纯) 西陇科学股份有限公司。
1.2 仪器与设备
NRY-1102C恒温摇床 上海南荣实验室设备有限公司;LS-B501全自动数显立式高压灭菌器 江阴滨江医疗设备有限公司;XO-120D超声波清洗槽、XO-120D超声波清洗机 南京先欧仪器制造有限公司;DHG-9023A鼓风干燥机 上海申光仪器仪表有限公司;YP3002电子天平 上海佑科仪器仪表有限公司;SP-3801AA原子吸收分光光度仪 北京华洋仪器公司;KYKY-EM3200扫描电镜 北京中科科仪技术发展有限责任公司;PE-M1730红外光谱仪 美国PE公司;Ultima IV组合式多功能X射线衍射仪 日本理学公司;JW-BK100A比表面积及孔径分析仪 北京精微高博科学技术有限公司。
1.3 方法
1.3.1 罗非鱼鱼鳞CCM的制备
选用干燥无腐败变质的未经脱钙处理的罗非鱼鱼鳞,于60 ℃鼓风干燥4~6 h,置于万用中药打粉机中打碎;取适量鱼鳞粉,经预煮或超声预处理后,加入一定体积、质量分数、质量比的柠檬酸-苹果酸溶液,在超声波下控温提取一定时间,抽滤得滤液,采用火焰原子吸收法测定得钙率;将滤液真空浓缩达到钙盐介稳区[19],然后降温至15~20 ℃,放置24 h左右,直到有大量钙盐晶体析出,分离出晶体,然后用清水反复冲洗晶体3 次,静置后再分离晶体,最后于40 ℃真空干燥至质量恒定。
1.3.2 鱼鳞预处理方法的比较
在进行单因素试验前,先确定罗非鱼鱼鳞的预处理方式。比较不经预煮、100 ℃水煮30 min、超声波60 ℃处理30 min、超声波(60 ℃,30min)结合预煮(100 ℃,30 min)4 种预处理方式对鱼鳞钙提取效果的影响。其余提取条件为:温度60 ℃、提取总时间1.75 h、液料比20∶1(mL/g)、苹果酸与柠檬酸质量比1∶1、混合酸总质量分数8%。
1.3.3 液料比对鱼鳞得钙率的影响
选择苹果酸与柠檬酸总质量分数为8%,质量比为1∶1,60 ℃提取0.5 h的固定条件,改变提取酸液与鱼鳞粉的液料比分别为10∶1、15∶1、20∶1、25∶1、30∶1(mL/g),考察液料比对得钙率的影响。
1.3.4 正交试验
基于鱼鳞前处理及单因素试验结果,选择混合酸总质量分数(A)、苹果酸与柠檬酸质量比(B)、超声温度(C)和超声时间(D)4 个因素,设计采用4水平5因素正交试验,见表1,优化超声辅助柠檬酸、苹果酸制备CCM的最佳工艺条件,并考察4 个因素对CCM制备的影响重要性次序。每组实验均重复3 次,取平均值。

表1 正交试验设计因素与水平Table 1 Factors and levels used in orthogonal array design
1.3.5 罗非鱼鱼鳞复合钙产物的表征及鉴定
以最优制备工艺条件下制得的罗非鱼鱼鳞复合钙为样品,对其进行表征鉴定。
1.3.5.1 红外光谱分析
比较4 种样品(样品1:分析纯的柠檬酸钙;样品2:分析纯的苹果酸钙;样品3:分析纯的柠檬酸钙与苹果酸钙物质的量比1∶2混合物;样品4:罗非鱼鱼鳞复合钙产物)的红外光谱图,对产物进行红外光谱分析。具体操作如下:将1 mg的各种样品和约100 mg干燥的溴化钾放入研钵中仔细研细调匀,然后把混合物转入专用的压片机中,边抽气边加压,制成几乎透明的薄圆片,放入光路系统进行测量。
1.3.5.2 XRD分析
对4 种样品进行XRD分析并鉴定产物。具体如下:采用组合式多功能XRD仪,Cu靶,管电压40 kV,管电流40 mA,样品压片后检测。
1.3.5.3 扫描电镜观察
先将导电胶粘接在样品座上,再均匀地把罗非鱼鱼鳞复合钙粉末撒在导电胶上面,用吸耳球吹去未粘住的粉末,再镀上一层导电膜后上电镜观察。
1.3.5.4 比表面积及孔径测定
1.3.6 钙含量检测方法及得钙率的计算
钙含量参照GB/T 5009.92—2003《食品中钙的测定》[21]通过原子吸收法测定。
标准曲线制备:配制20 g/L的氧化镧溶液,将1 000 μg/L钙标准溶液分别稀释成1、5、10、15、20、30、50 μg/L的钙标准溶液,定容到50 mL,采用原子吸收分光光度仪检测,绘制标准曲线。
样品消解及钙含量检测:用混合酸提取鱼鳞中的钙之前,记录提取容器质量m1及鱼鳞样品质量m0,提取完毕后,记录提取容器和提取液总质量m;用100 mL锥形瓶,装入5.0 g提取液,加入25 mL浓硝酸并加入几粒玻璃珠,三角瓶口放一小漏斗防止液体飞溅,置电陶炉上加热消解,调整火力使液体保持微沸状态,消解至液体清亮无色、剩余2~5 mL为止。再用20 g/L氧化镧溶液稀释定容至50 mL比色管,再从中取5 mL液体用氧化镧溶液稀释定容至50 mL容量瓶中,再用原子吸收分光光度仪测定吸光度,查标准曲线计算钙的浓度,记为C(μg/mL)。得钙率的计算公式如下:

1.4 数据及图片处理
单因素及正交试验每组实验均重复3次,取平均值;采用SPSS Statistices 17.0对正交试验结果进行方差分析;采用Origin 8.5进行数据图绘制。
2 结果与分析
2.1 鱼鳞预处理方式对得钙率的影响

图1 鱼鳞的不同预处理条件对得钙率的影响Fig. 1 Effect of different pretreatment conditions on calcium yield
由图1可知,采用超声波预处理鱼鳞对钙的提取具有促进作用,这是因为超声波具有空化作用、机械作用、热效应等,能增加物质分子运动频率和速度,增加提取剂的穿透力,从而可以提高目标成分的浸出率[22];而预煮处理不利于钙的提取,这可能是因为经过熬煮的鱼鳞变得黏稠,不利于钙的溶出,所以,后续实验中鱼鳞均不采用水煮前处理,只采用超声辅助提取。
2.2 液料比对得钙率的影响

图2 液料比对得钙率的影响Fig. 2 Effect of solvent-to-solid ratio on calcium yield
由图2可知,在液料比为15∶1时,得钙率上升较快,超过20∶1后,得钙率有缓慢上升,最终几乎趋于平衡。当液料比低于10∶1,由于水分少,提取过程中体系浓稠,不利于钙的溶出,提取液也不易抽滤分离,会造成损失,所以液料比20∶1时较为合适。
本研究将调查对象锁定为在南宁动物园游玩的家庭型游客。为保证被调查对象符合研究条件,研究者将调查地点定于南宁动物园大门前,被调查对象必须是从园内游玩出园的家庭型游客,问卷由被调查者独立完成,并通过访谈获得被调查者的信息。调查于2017年10月24日开始至11月6日结束,共发放调查问卷220份,收回有效问卷214份,有效问卷回收率97%。
2.3 CCM制备工艺的正交试验优化结果
由表2可知,各个因素及其交互作用对结果影响的主次顺序为混合酸总质量分数>超声时间>超声温度>苹果酸与柠檬酸质量比;由表3方差分析可知,混合酸总质量分数、超声时间对得钙率影响极显著,超声温度对得钙率影响显著,而苹果酸与柠檬酸质量比对得钙率影响不显著;鱼鳞得钙的最优组合为A3B2C4D3,即最佳制备工艺条件为苹果酸与柠檬酸总质量分数12%、质量比2∶1、超声温度70 ℃、超声时间1.0 h;验证最佳组合,平行实验3 次,取均值,最终得钙率为18.97%,比表2中最佳组合得钙率18.68%略高,说明正交试验结果是可靠的。

表2 正交试验设计与结果Table 2 Results and analysis of orthogonal array design

表3 正交试验方差分析Table 3 Analysis of variance of orthogonal array design
2.4 罗非鱼鱼鳞复合钙产物的形貌观察及结构表征
2.4.1 红外光谱分析
从图3可看出,混合物的红外光谱图仅为柠檬酸钙及苹果酸钙两者红外光谱图的简单叠加,并无新峰出现。从图4可以看出,鱼鳞复合钙产物与混合物红外光谱图明显不同,明显不是两组分的叠加,鱼鳞复合钙产物的特征峰为3 399.94、3 324.73、2 898.53、1 683.58、1 548.58、1 452.16、825.40、597.83 cm-1,这与刘红玲[5]研究报道的结果相近。结合图3和图4分析可知,苹果酸钙的特征峰为3 438、1 625、1 544、1 450、1 386、1 095、825、570 cm-1,这说明在鱼鳞复合钙产物中苹果酸钙的特征吸收体现较多较强,与李淑芳等[8]等研究结果基本相似。据文献报道,柠檬酸、苹果酸的羰基峰在1 739~1 700 cm-1范围内[23-24],鱼鳞复合钙产物在1 683.58、1 548.58 cm-1处出现羧酸根的反对称vas(COO—)和对称vs(COO—)的伸缩振动吸收峰,与苹果酸和柠檬酸羰基峰位置相比,向低波段移动,说明柠檬酸和苹果酸两种酸的羧基中氧原子与钙形成了配位键,发生了络合反应;并且在570~597 cm-1内出现的吸收峰可推测为Ca-O伸缩振动吸收峰[25];从图4还可以看出,鱼鳞复合钙产物中出现3 324.73 cm-1和2 898.53 cm-1两个特征峰,这相对于羟基(3 400 cm-1)特征吸收峰向低波段移动并出现宽化现象,说明复合盐中形成新的氢键[26-27],这也显示该复合盐并不是由一定量的柠檬酸钙和苹果酸钙简单的混合在一起形成的。目前虽然还没有CCM复合盐的标准结构,仅通过红外光谱分析也还不能完全确定CCM复合盐的具体结构,但本实验可以判断鱼鳞复合钙产物存在与文献报道相符的CCM结构,结构中存在柠檬酸与苹果酸形成的氢键,结构中以苹果酸占优势,推测这种钙盐也与文献[5]、[8]具有类似的结构。

图3 柠檬酸钙、苹果酸钙以及混合物的红外图谱比较Fig. 3 IR spectra of calcium citrate, calcium malate and their mixture

图4 混合物与罗非鱼鱼鳞复合钙产物的红外图谱比较Fig. 4 IR spectra of a mixture of calcium citrate and calcium malate and CCM
2.4.2 XRD分析
从图5可看出,混合物的XRD图仅为柠檬酸钙及苹果酸钙两者XRD图的简单叠加,并无新峰出现。从图6可以看出,鱼鳞复合钙产物与混合物的XRD图明显不同,鱼鳞复合钙产物在0°~10°内没有尖锐的特征峰出现,但在16.66°、21.32°和3 1.54°处出现了3 个尖锐峰形,且特征峰的数目增多,这也说明鱼鳞复合钙盐不是柠檬酸钙和苹果酸钙两组分的简单叠加。

图5 柠檬酸钙、苹果酸钙以及混合物的XRD图比较Fig. 5 XRD patterns of calcium citrate, calcium mala te and their mixture

图6 混合物与罗非鱼鱼鳞复合钙产物的XRD图比较Fig. 6 XRD patterns of a mixture of calcium citrate and calcium malate and CCM
2.4.3 比表面积分析
罗非鱼鱼鳞复合钙产物晶体氮气物理吸-脱附等温曲线、BET比表面曲线和孔容-孔径综合分布曲线分别如图7~9所示,分析数据见表4。从图7可以看出,罗非鱼鱼鳞复合钙的氮气物理吸-脱附等温曲线为典型的III型吸附等温线[28],表明复合钙盐对氮气的吸附比较微弱[29]。综合分析,罗非鱼鱼鳞复合钙孔径为4.049 nm,单点吸附总孔体积为0.320 cm3/g,孔径4 nm之后,孔容越来越大;T-图法微孔(外)比表面积为385.703 m2/g。
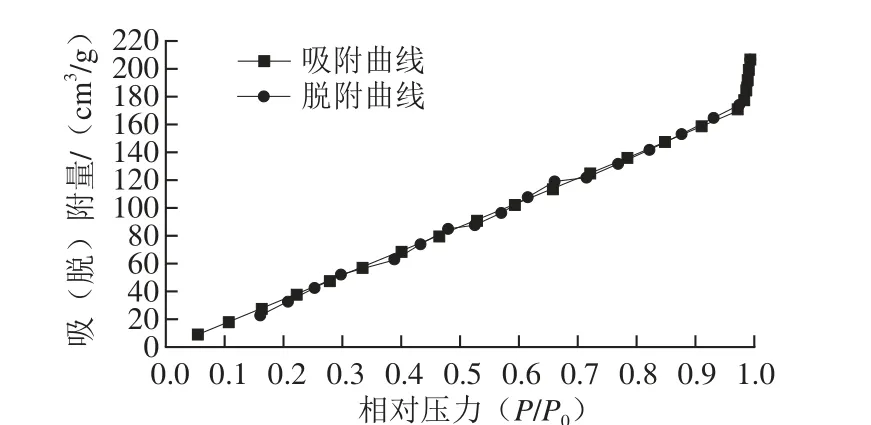
图7 罗非鱼鱼鳞复合钙产物的等温吸-脱附曲线Fig. 7 Isothermal adsorption and desorption curves of CCM

图8 罗非鱼鱼鳞复合钙产物的BET比表面曲线Fig. 8 T-graph curve of CCM

图9 罗非鱼鱼鳞复合钙产物的孔容-孔径综合分布图Fig. 9 Pore volume-pore size distribution curves of CCM

表4 罗非鱼鱼鳞复合钙盐比表面积和孔隙结构参数Table 4 Specific surface area and pore structure data of CCM
2.4.4 扫描电镜分析
罗非鱼鱼鳞复合钙产物的扫描电镜图如图10所示,可知复合盐晶体是有棱角的六方形体。

图10 罗非鱼鱼鳞钙产物的扫描电镜图Fig. 10 SEM of CCM
3 结 论
研究确定罗非鱼鱼鳞只用超声辅助提取的得钙率相对比较高且稳定,无需采用预煮处理;在液料比为20∶1条件下,正交试验优化得到鱼鳞复合钙的最佳制备工艺条件为苹果酸与柠檬酸的总质量分数12%、质量比2∶1、超声温度70 ℃、超声时间1.0 h,此条件下得钙率为18.97%,高于谭文溢等[30]以草鱼鱼鳞制备CCM的得钙率(8.56%)。将产物进行除杂、浓缩结晶,得到复合钙盐晶体。红外光谱及XRD分析均显示制备产物不是柠檬酸钙与苹果酸钙的简单混合物,而与CCM结构吻合;扫描电镜观察到产物结晶呈六方形;晶体比表面积介孔测定知罗非鱼鱼鳞复合钙产物孔径为4.049 nm,单点吸附总孔体积为0.320 cm3/g,T-图法微孔(外)比表面积为385.703 m2/g。
在本实验研究基础上,后续将进行3 个方面的研究:1)对罗非鱼鱼鳞复合钙的溶解性(包括温度、pH值对复合钙的溶解度及钙溶解量)进行系统研究; 2)与柠檬酸钙、苹果酸钙、柠檬酸钙与苹果酸钙的混合物、碳酸钙的溶解性进行比较;3)以罗非鱼鱼鳞钙为主要原料,研发一种补钙制剂。
