氨基化Fe3O4-SiO2固定化磷脂酶A1
2019-06-11李进红操丽丽潘丽军侯志刚水龙龙姜绍通
李进红,操丽丽,庞 敏,潘丽军,侯志刚,水龙龙,鲍 赛,姜绍通*
(合肥工业大学食品与生物工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
磷脂广泛存在于植物油脂中,随着植物油存放时间的延长,会使油脂变得不稳定,促使氧化酸败加剧,颜色加深[1],增加过滤和操作的难度,造成设备结焦、脱色脱酸效果不佳、炼耗和辅助剂的用量增大等问题。因此菜籽油的脱磷对精炼工艺变得尤为重要[2-4]。随着对菜籽油品质的要求提高以及节能环保的理念增强,酶法脱胶具有广阔的研究前景[5-6]。磷脂酶主要包括磷脂酶A1、A2、B、C和D,它们能够特异性水解磷脂内部酯键,生成对应的溶血磷脂和脂肪酸。溶血磷脂具有良好的水分散性,易在水化工艺阶段去除[7-8]。磷脂酶A1热稳定性良好,酶活力高,反应稳定,适合用于科学研究和工业应用[9]。磷脂酶具有高效性和高度专一性,应用于油脂脱胶中具有反应条件温和、耗能低,几乎不会产生废水的优点。
固定化酶的方法和材料丰富多样,随着绿色发展的脚步加快,经济环保的材料成为科学研究的热门话题。水龙龙[10]、刘倩倩[11]等以离子交换树脂吸附固定化磷脂酶。以大孔树脂固定化酶会随着反应次数的增加,底物和产物的积累,使传质阻力增加,反应效率降低。经物理吸附的固定化酶结合稳定性差,造成酶较易泄露。陈丽萍[12]、占剑峰[13]等以天然高分子材料包埋固定化磷脂酶。天然高分子材料无毒无害,传质性好,但机械强度低,易溶解,容易受金属离子的影响。于殿宇等[14]以纤维素为载体,得到结合牢固,稳定性好的共价固定化磷脂酶。
磁性Fe3O4纳米离子具有较大的比表面积,同时具有的超顺磁性,即在外加磁场中具有磁性,当外加磁场消失时其磁性也会消失,因此可以很方便的将固定化酶从反应体系中回收重复利用[15]。虽然磁性Fe3O4纳米粒子具有纯度高,磁性稳定,比表面积大等优点,但作为金属粒子,在溶液中易与氢离子结合使其表面带有较强的正电荷,相比其他有机材料更容易团聚,因此对Fe3O4纳米粒子表面进行改性,成为制备固定化载体重要的一步[16]。用有机试剂对磁性纳米粒子进行改性,不仅可以使其表面拥有特定的活性基团,同时还保留了无机磁性材料的磁响应优点。杨兆壬[17]、谈昭君[18]等通过高锰酸钾氧化得到表面羧基化的磁性Fe3O4载体。李晔[19]、阮贵华[20]等以γ-氨丙基三乙氧基硅烷改性得到氨基化的磁性Fe3O4载体。Fe3O4作为无毒无害的环保材料,在食品加工处理领域具有重要的意义[21-22]。使用Fe3O4磁性纳米粒子作为载体进行固定化反应,能实现固定化酶与反应体系的高效分离,提高酶的重复使用率,降低生产成本,有利于实现连续化生产[23]。
1 材料与方法
1.1 材料与试剂
Lecitase® Ultra磷脂酶A1(酶活力5 000 U/mL)丹麦诺维信公司;大豆卵磷脂 上海蓝季科技发展有限公司;Fe3O4纳米粒子、硅酸乙酯(ethyl silicate,TEOS)、戊二醛(50%) 阿拉丁试剂有限公司;乙醇、氨水、聚乙烯醇(polyvinyl alcohol,PVA)、95%乙醇溶液 展望化工试剂有限公司;3-氨基丙基三乙氧基硅烷(3-aminopropyltriethoxysilane,3-APTES) 上海麦克林生化科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HitachiS-4800场发射扫描电子显微镜 日本日立公司;Tecnai G2-T20场发射透射电子显微镜 美国FEI公司;Nicolet-8700傅里叶变换红外光谱仪 美国尼高力仪器公司;MiniFlex-600 X射线衍射仪 日本株式会社理学公司。
1.3 方法
1.3.1 载体的制备
Fe3O4-SiO2磁性复合载体的制备:取2 g Fe3O4纳米粒子,加入到含有160 mL乙醇、40 mL水、5 mL氨水的混合液中,超声处理1 h后,然后将5 mL TEOS缓慢加入到该溶液体系,室温、350 r/min连续机械搅拌反应12 h。用去离子水将沉淀洗涤数次,然后用0.1 mol/L盐酸处理沉淀12 h,以去除未包裹上SiO2的Fe3O4纳米粒子,将沉淀物在室温下真空干燥24 h。
3-APTES改性的Fe3O4-SiO2磁性复合载体的制备:在250 mL圆底烧瓶中,加入1 g磁性Fe3O4-SiO2载体,超声处理1 h,使载体均匀分布在60 mL乙醇中。然后加入6.0 mL NH3·H2O,继续超声10 min,随后向反应液中缓慢加入4.0 mL 3-APTES,在50 ℃持续搅拌反应8 h。反应用永久性磁铁将载体和溶液分离,并分别用乙醇和水充分洗涤至中性。最后,将3-APTES改性的Fe3O4纳米颗粒在常温下真空干燥24 h,获得含有氨基官能团的Fe3O4-SiO2磁性复合载体[24-25]。
Fe3O4-SiO2磁性复合载体的交联:在50 mL锥形瓶中加入2 g改性后的复合载体,加入一定质量分数戊二醛(使用pH 7.0,0.1 mol/L磷酸盐缓冲液稀释)进行交联,室温下,放置在摇床上以转速150 r/min,反应12 h。反应完成后,用去离子水将载体反复洗涤,得到交联复合载体[26-27]。
1.3.2 磷脂酶的固定化
称取交联后的Fe3O4-SiO2复合载体50 mg放入锥形瓶中,加入预定量0.02 g/mL磷脂酶A1液(一定pH值的磷酸缓冲液稀释)。在水浴摇床中,于设定的温度、150 r/min反应预定的时间。随后把固定化好的磷脂酶A1用永久性磁铁分离,用磷酸盐缓冲液(pH 7.0)反复洗涤直到上清液中检测不到游离酶为止,固定化磷脂酶置于4 ℃冰箱中保存备用[28-29]。
1.3.3 固定化磷脂酶活力的测定
参照文献[30]方法。将15.0 mL底物溶液于100.0 mL锥形瓶中,将锥形瓶放置50 ℃气浴摇床上,预热8.0 min。加入固定化磷脂酶,在160 r/min、50 ℃条件振荡下反应10.0 min后,立刻加入10.0 mL的95%乙醇溶液终止反应。用0.1 mol/L NaOH标准液,采用自动电位滴定仪滴定反应后的溶液,通过实验组和空白组计算NaOH标准液消耗量,测得固定化磷脂酶活力。酶活力回收率和蛋白固载率的计算见公式(1)和(2):

式中:A1为固定化酶总活力/(U/mL);A2为原酶液总活力/(U/mL)。

式中:C1为加入载体中蛋白含量/(mL/mg);C2为残液中蛋白含量/(mL/mg)。
1.3.4 固定化载体的表征
场发射扫描电子显微镜采用电子枪为冷场发射电子源,加速电压20 kV,分辨率1.4 nm,放大倍数30~80万倍;透射电子显微镜采用的电子枪为LaB6,加速电压200 kV,线分辨率0.144 nm,点分辨率0.248 nm,放大倍数25~110万 倍;傅里叶红外光谱仪扫描区间为4 000~400 cm-1;X射线衍射仪采用的X射线源为Cu靶Kα射线,石墨单色器,管压力15 kV,管电流30 mA,扫描速率5 °/min,扫描范围2θ为20°~70°。对样品的形态结构、粒径大小、化学组分进行检测分析。
2 结果与分析
2.1 磷脂酶A1固定化单因素试验结果
2.1.1 pH值对固定化的影响
在温度4 0 ℃、戊二醛质量分数4%、加酶量4 mL/50 mg、固定化时间6 h条件下,考察pH值(5.0、6.0、7.0、8.0、9.0)对磷脂酶A1固定化的影响,结果如图1所示。
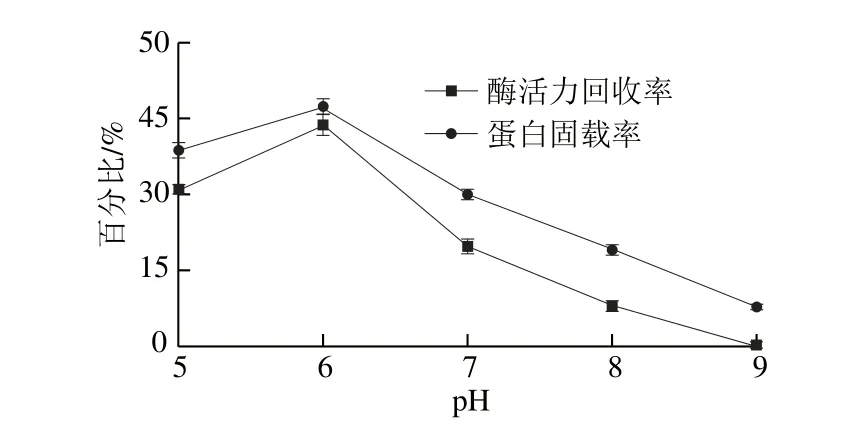
图1 pH值对磷脂酶A1固定化的影响Fig. 1 Effect of pH on the immobilization of phospholipase A1
由图1可知,随着固定化pH值的增加,固定化磷脂酶A1的酶活力回收率和蛋白固载率均先增大后减小。在pH 6.0时回收率和固载率都达到最大,当pH值继续增加时,回收率和固载率持续降低。其原因是pH值改变能影响酶的活性部位和载体上相关官能团的解离,在一定的解离程度下,适合酶和载体发生固定反应。另一方面,磷脂酶的化学本质是蛋白质,当pH值过低或过高时,蛋白质的次级键和空间结构被破坏,从而使酶的生物活性丧失,酶活力降低。
2.1.2 固定化温度对固定化的影响
在固定化pH 6.0、戊二醛质量分数4%、加酶量4 mL/50 mg、固定化时间6 h的条件下,考察固定化温度(25、30、35、40、45 ℃)对磷脂酶A1固定化的影响,结果如图2所示。

图2 固定化温度对磷脂酶A1固定化的影响Fig. 2 Effect of temperature on the immobilization of phospholipase A1
由图2可知,随着固定化温度的升高,酶活力回收率增大,当温度达到30 ℃时,酶活力回收率达到最高,随着固定化温度的继续升高,酶活力回收率反而下降。原因是温度升高使酶分子活化,碰撞次数增加,酶与载体接触机会上升,从而有利于固定化反应,当温度过高时,使酶分子的构象发生变化,影响酶活力。温度对固载率影响不大,在35 ℃时固载率达到最大。综合考虑酶活力回收率和蛋白固载率,最后选择最适固定化温度为30 ℃。
2.1.3 固定化时间对固定化的影响
在固定化pH 6.0、固定化温度30 ℃、戊二醛质量分数4%、加酶量4 mL/50 mg的条件下,考察固定化时间(4、8、12、16、20 h)对磷脂酶A1固定化的影响,结果如图3所示。

图3 固定化时间对磷脂酶A1固定化的影响Fig. 3 Effect of time on the immobilization of phospholipase A1
由图3可知,酶活力回收率在初始阶段随着时间的延长而提高,在8 h时达到最高,继续延长固定化时间,酶活力回收率基本保持不变。原因是在初始阶段随着时间的延长,酶分子不断固定到载体上,当载体上活性基团连接的酶分子达到饱和后,继续延长时间,酶分子与载体也不会发生有效的固定化反应,酶活力回收率和蛋白固载率基本保持不变。
2.1.4 戊二醛质量分数对固定化的影响
在固定化pH 6.0、固定化温度30 ℃、固定化时间8 h、加酶量4 mL/50 mg的条件下,考察戊二醛质量分数(2%、4%、6%、8%、10%)对磷脂酶A1固定化的影响,结果如图4所示。

图4 戊二醛质量分数对磷脂酶A1固定化的影响Fig. 4 Effect of glutaraldehyde concentration on the immobilization of phospholipase A1
戊二醛作为常用的交联剂,本身所具有的醛基能与载体上游离的氨基反应生成亚胺基团(-RC=N-),使载体与载体连接起来,从而增大酶与载体的接触面积,有利于酶的固定化反应。由图4可知,酶活力回收率随戊二醛质量分数的增加,先升高后降低。在戊二醛质量分数小于8%时,磁性载体表面的醛基随着戊二醛的质量分数增大而变多。当戊二醛质量分数高于8%时,载体表面过度醛基化,使酶与载体交联过度,空间位阻变大,酶活力位点受限。戊二醛质量分数对蛋白固载率影响较大,随着戊二醛质量分数增加,载体提供的结合位点增多,与磷脂酶结合的机率增大,更利于酶的固定化,但戊二醛质量分数过高也会使酶丧失部分活力。
2.1.5 加酶量对固定化的影响
在固定化pH 6.0、固定化温度30 ℃、固定化时间8 h、戊二醛质量分数8%的条件下,考察加酶量(2、4、6、8、10 mL/50 mg)对磷脂酶A1固定化的影响,结果如图5所示。

图5 加酶量对磷脂酶A1固定化的影响Fig. 5 Effect of enzyme amount on the immobilization of phospholipase A1
由图5可知,在加酶量较低时,酶活力回收率随着加酶量的增加而提高,当加酶量达到8 mL/50 mg载体后,继续加大酶量,固定化酶的酶活力回收率反而会下降。这是由于一定量的载体可以固定的酶量是一定的,当载体固定化位点达到饱和,再继续添加酶反而会使酶分子聚集成团,使酶分子之间的活性位点彼此覆盖,空间位阻增大,对酶活力产生抑制作用。在加酶量达到8 mL/50 mg后蛋白固定率持续降低,使酶的利用率下降。在考虑最适加酶量时应考虑蛋白固载率,避免造成不必要的浪费,而且降低成本对酶的固定化经济效益有利。
2.2 响应面试验结果与分析
2.2.1 响应面试验结果
根据单因素试验结果,设计响应面试验,确定最佳固定化条件,每组试验重复3 次,因素与水平如表1所示。

表1 响应面试验因素与水平Table 1 Variables and their levels used for response surface design

表2 响应面试验设计与结果Table 2 Experimental design and results for response surface analysis
响应面试验设计与结果见表2所示,方差分析结果见表3所示。

表3 回归模型的方差分析Table 3 Analysis of variance of the regression equation
通过Design-Expert 8.0.6分析,可以得到固定化条件与酶活力回收率之间的二次多项式模型为Y=61.34+5.52A+3.83B+6.14C+2.28D-2.02AB-3.50AC+3.91AD-6.08BC-3.64BD-4.06A2-6.21B2-5.53C2-8.97D2。根据二次多项式,可确定固定化磷脂酶A1的最佳固定化pH 6.67、固定化时间7.92 h、戊二醛质量分数8.34%、加酶量8.24 mL/50 mg[31]。
由表3回归模型的方差分析可知,R2=0.966 3,说明该模型能较好地反映固定化磷脂酶A1的酶活力回收率随固定化条件的变化规律,模型的P值小于0.000 1,说明此模型极显著,失拟项P值为0.238 5大于0.05,说明模型拟合良好,可以接受。校正决定系数j=0.937 4,表明此方程能够解释响应值93.74%的变化。AC、AD、BC、BD交互作用对固定化磷脂酶A1的酶活力回收率影响较为显著,且主次顺序为BC>AD>BD>AC[32-33],两因素交互作用的响应面3D图和等高线图见图6。


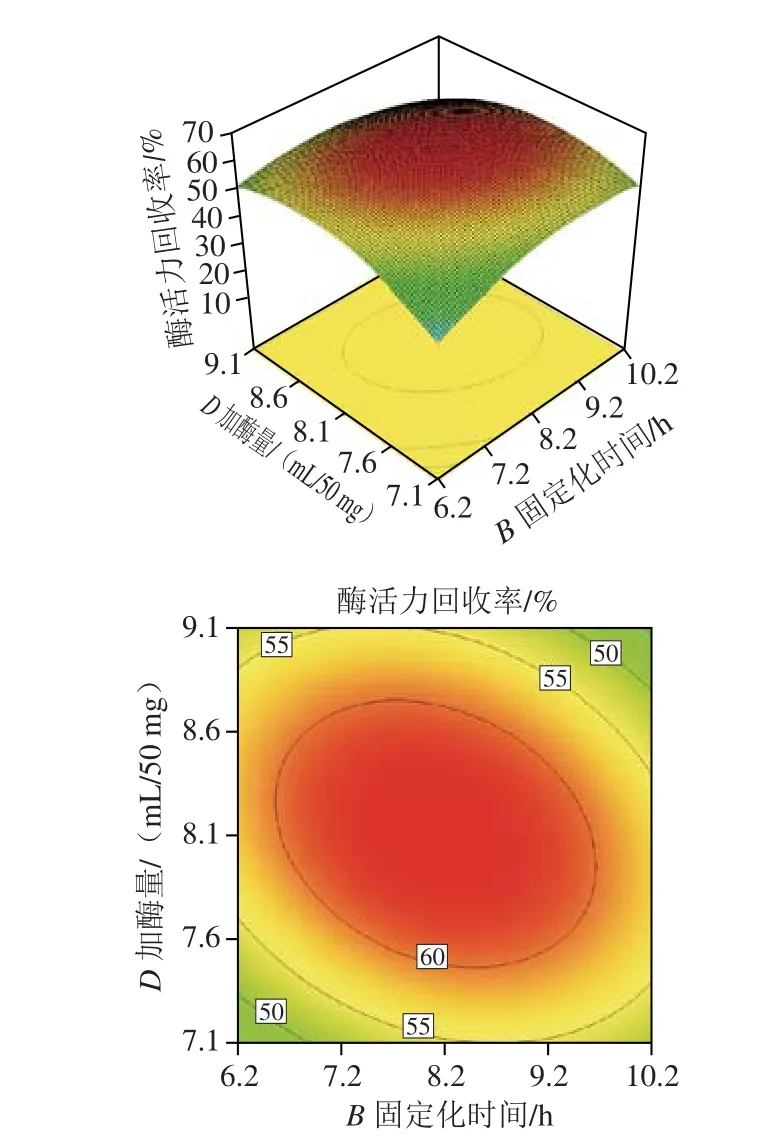
图6 各因素交互作用对酶活力回收率影响的响应面和等高线Fig. 6 Response surface and contour plots showing the interactive effects of four variables on the recovery of enzymatic activity
2.2.2 验证实验结果
根据响应面法获得的最佳固定化条件,进行3 次平行验证实验,根据实验的可操作性,最终确定的条件为固定化pH 6.7、固定化时间7.9 h、戊二醛质量分数8.3%、加酶量8.2 mL/50 mg。在此条件下固定化加酶量2 mL/50 mg的酶活力回收率为63.6%,蛋白固载率为68%, 落在响应值Y的95%预测区间[56.17%,66.50%]内,说明所建立的回归模型具有较好的拟合性。
2.3 磁性固定化磷脂酶A1的表征分析
2.3.1 扫描电子显微镜分析
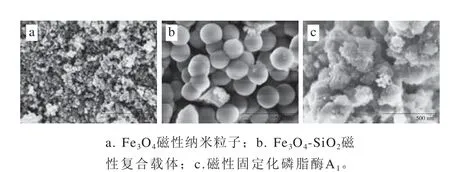
图7 样品扫描电子显微镜图Fig. 7 Scanning electron microscope images of samples
由图7可知,Fe3O4磁性纳米粒子基本形貌为球状,具有良好的分散性,团聚较少,其平均粒径在15 nm左右。Fe3O4-SiO2磁性复合载体的粒径较为均一,表面平滑,呈球状,各载体间分散性良好,载体的平均粒径为200 nm左右,比表面积大。复合载体平均粒径大于Fe3O4纳米颗粒,表明SiO2成功地包裹在Fe3O4粒子表面,包裹后的Fe3O4-SiO2复合载体表面含有大量的羟基,可通过改性在其表面添加活性基团。磁性固定化磷脂酶A1之间交联效果良好,同样具有较好的分散性,有利于固定化酶与底物接触反应[34]。
2.3.2 透射电子显微镜分析
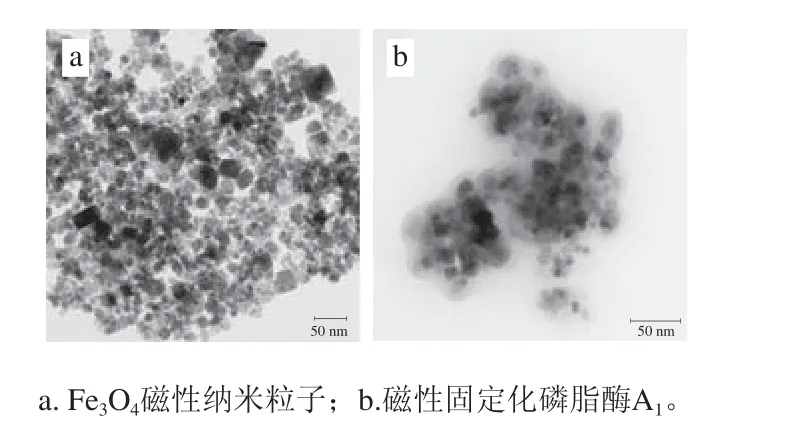
图8 样品的透射电子显微镜图Fig. 8 Transmission electron microscope image of samples
从图8可知,Fe3O4纳米颗粒的分散性较好,极少团聚,有利于TEOS均匀地包裹在磁性纳米材料表面。磁性固定化磷脂酶A1与Fe3O4纳米粒子形态相似,各固定化载体之间均匀分散,呈核壳形,中间黑色的实心为Fe3O4纳米颗粒,载体周围呈现出均匀的灰色薄层,可看出SiO2均匀地包裹在Fe3O4纳米颗粒表面[35-36]。
2.3.3 傅里叶变换红外光谱分析

图9 样品的傅里叶变换红外光谱图Fig. 9 Fourier transform infrared spectraof samples
在图9b、c中,1 092 cm-1处较强的吸收峰是Si—O—Si键的伸缩振动吸收峰,表明SiO2成功地包裹在载体表面,1 544 cm-1处较弱的峰是酰胺特征吸收峰,说明磷脂酶成功地固定到磁性载体上。1 631 cm-1处较强的吸收峰表明水分子物理吸附到载体表面,3 421 cm-1处是—OH的伸缩振动峰。
2.3.4 X射线衍射分析
在图10a、b、c中均能观察到独立的窄的尖锐衍射峰,说明各样品纯度高,为较好的“晶态”物质。与X射线衍射标准卡片(PDF 19-0629)对照得出,衍射图谱上的2θ为30.15°、35.47°、43.10°、53.44°、56.99°、62.51°的衍射角分别很好地对应材料中反尖晶石型晶体结构磁性Fe3O4的(220)、(311)、(400)、(422)、(511)、(440)晶面。固定化PLA1的特征衍射峰明显弱于Fe3O4磁性纳米粒子,是因为固定化PLA1中的Fe3O4相对含量较低[37-38]。

2.4 固定化磷脂酶的酶学特性分析
2.4.1 最适温度和pH值
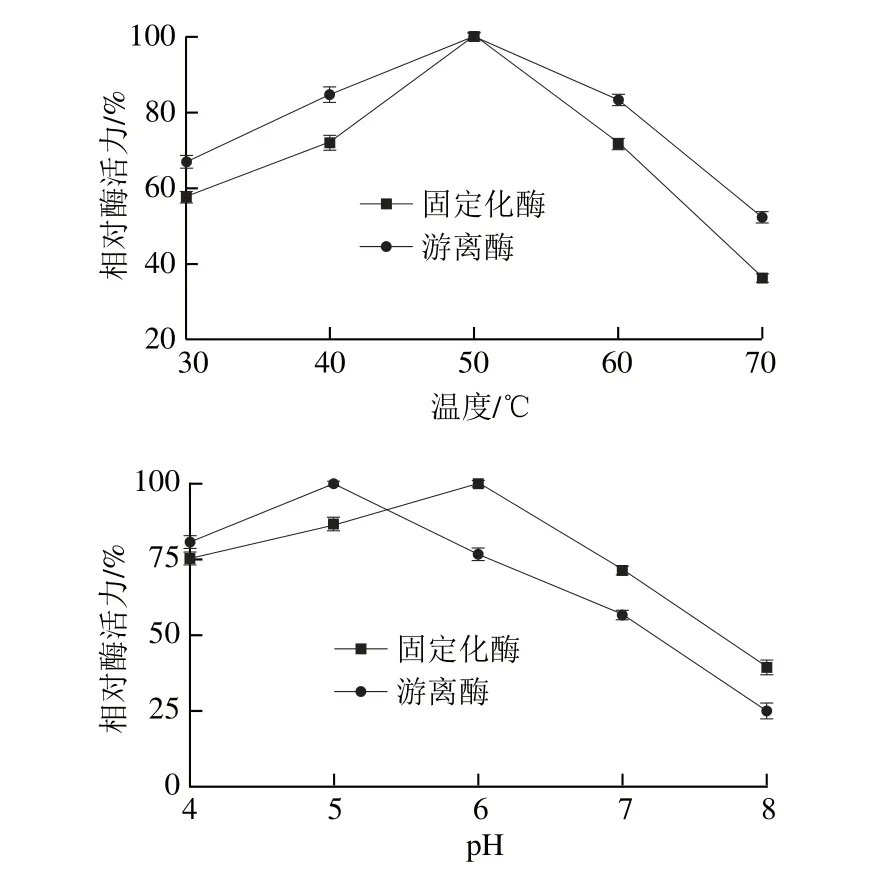
图11 游离酶和固定化酶的最适温度和pH值Fig. 11 Optimal temperature and pH for the free and immobilized enzyme
在不同温度下测定游离酶和固定化酶的酶活力,以酶活力最大的组为100%,其余各组的酶活力与最大酶活力的比值即为相对酶活力。由图11可知,游离酶和固定化酶的最适反应温度均为50 ℃,但固定化酶受温度的影响比游离酶小,在更广的温度范围内可以保持相对较高的酶活力。可能是因为固定化反应使酶的空间结构发生改变,使其对温度的耐受程度得到提高。游离酶的最适反应pH 5.0,固定化酶的最适反应pH 6.0。相比游离酶固定化酶的最适pH值变大,pH值稳定性更好。可能是固定化使酶的带电性质改变,或者是固定化载体材料使酶的微观环境发生变化。
2.4.2 操作稳定性
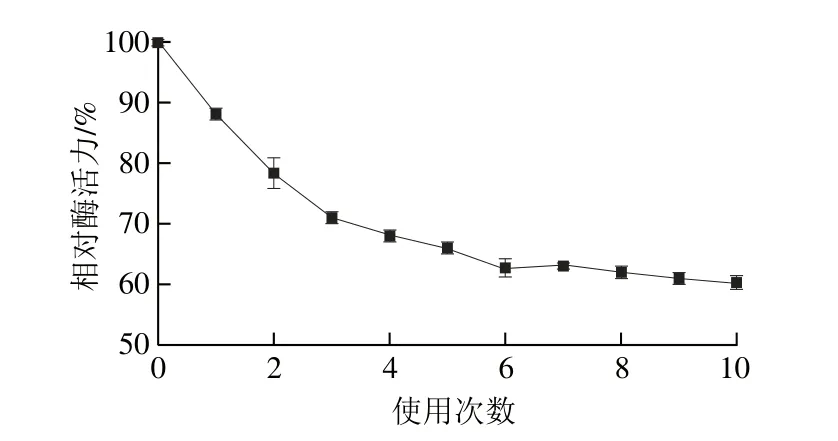
图12 固定化酶的操作稳定性Fig. 12 Reusability of the immobilized enzyme
固定化酶在50 ℃与底物反应10 min,经过10 次反应后,固定化酶保留61%的初始酶活力。由图12可知,在前4 次反应中固定化酶活力损失严重,可能是由于与载体结合不牢固的那一部分磷脂酶,在反应过程中从载体上脱落,造成酶活力降低幅度较大。

图13 固定化酶和游离酶的贮藏稳定性Fig. 13 Storage stability of the immobilized and free enzyme
将固定化酶和游离酶贮藏在4 ℃冰箱,每隔5 d定时测酶活力,如图13所示。固定化酶和游离酶相对酶活力随贮藏时间的延长,在25 d后,固定化酶相对酶活力保持在83%以上,游离酶在79%左右,相对于游离酶,固定化酶的稳定性得到了改善。
3 结 论
通过响应面试验,确定Fe3O4纳米粒子固定化磷脂酶A1的最优条件:固定化pH 6.7、固定化温度30 ℃、固定化时间7.9 h、戊二醛质量分数8.3%、加酶量8.2 mL/50 mg,在此最佳条件下制得磁性固定化磷脂酶A1的酶活力回收率能达到63.6%,蛋白固载率为68%。
通过表征分析表明磷脂酶被成功固定到了载体表面。固定化载体分散均匀,粒径均一,平均粒径在200 nm左右。固定化酶的最适反应温度50 ℃,最适pH 6.0,热稳定性、pH值稳定性和贮藏稳定性均高于游离酶,重复使用固定化酶10 次后,仍保留61%的初始酶活力。
磷脂酶A1具有宽泛的底物专一性,且反应彻底速率快,常被应用于食物油的脱胶处理。本实验使用价格低廉且无毒害作用的Fe3O4纳米粒子作为固定化载体,符合当下倡导的生态文明理念。固定化酶的热稳定性好,能与产物迅速分离,便于回收重复利用。与其他改性方法相比,使用3-APTES和戊二醛改性得到的载体,表面具有大量的活性基团,能在较为温和的条件下与酶更好的接触发生化学反应,所制得的固定化磷脂酶A1不仅酶活力高,而且稳定性好,为食用油酶法脱胶领域的研究和发展提供参考。
