phoP 调节子对阪崎克罗诺肠杆菌环境耐受力的影响
2019-06-11周亚琴李梦云夏效东
周亚琴,李梦云,夏效东*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
阪崎克罗诺肠杆菌(Cronobacter sakazakii)周身鞭毛,为革兰氏阴性菌,其无芽孢,多寄生于肠道内[1]。作为食源性条件致病菌,阪崎克罗诺肠杆菌可致使婴幼儿以及免疫力低下者感染脑膜炎、小肠结肠炎等疾病,致死率极高,达50%~80%[2-4]。尽管临床上已用一些抗生素治疗这些疾病,但部分康复的患者仍旧会伴有严重的后遗症例如发育障碍等[5]。该菌对营养物质的需求量不大,对环境的耐受能力却极强,众多研究结果表明,致病菌能否感染宿主取决于其对外界环境的感知和应对能力。2000—2016年期间,阪崎克罗诺肠杆菌对于我国婴幼儿食品的污染现象并不罕见,检出率高达21.62%,可见对于克罗诺肠杆菌的控制远不能达到实际生产要求[6]。
阪崎克罗诺肠杆菌存在于自然界各处[7-8],已有研究表明,能够从粪便、谷作物、食材、水、泥土等处分离出阪崎克罗诺肠杆菌。虽然迄今为止,对于阪崎克罗诺肠杆菌的传播方式以及宿主仍旧不明,但是由其引发的疾病已证实只与婴幼儿配方奶粉有关,所以婴幼儿配方奶粉被认定为是阪崎克罗诺肠杆菌感染婴幼儿人群的主要传播媒介[5,9]。从最初污染婴幼儿奶粉一直到进入婴幼儿体内引发疾病,阪崎克罗诺肠杆菌需要克服多种环境压力才能够存活以引发人体疾病,例如温度、酸度、渗透压等,已有研究表明阪崎克罗诺肠杆菌能够存活于多种极端环境,对渗透压和温度具有强耐受力[10]。
PhoP是一种胞内效应蛋白,与胞外感应蛋白PhoQ组成PhoP/PhoQ二元调控系统,该调控系统普遍存在于肠道杆菌之中,在肠道杆菌应对宿主环境的过程中起着至关重要的作用,能够调节毒力,调节多种革兰氏阴性菌的活性。位于细菌外膜上的PhoQ蛋白感应外界环境后,将磷酸基团传至PhoP蛋白从而将其激活,被激活的PhoP蛋白作为调节子直接或间接调控一系列靶基因。phoP基因的缺失会导致PhoP/PhoQ二元调控系统的转磷酸化过程的失衡,使得致病菌的毒力降低。PhoP蛋白最早发现于鼠伤寒沙门氏菌中,具有调控非特异性酸性磷酸酶表达的功能,其中包含的字母pho有表示参与磷酸的代谢调节的含义[11]。Perez等[12]通过破坏结核分歧杆菌中的phoP基因进行研究,结果表明,phoP基因是结核分歧杆菌在巨噬细胞内存活生长的必要条件。
传统的基因敲除方法是借助RecA重组系统,通过分子质量大的复合体RecBCD使得DNA链解开,再通过RecA单链结合蛋白促进各DNA片段进行配对连接。然而,该方法有许多的不足之处。首先,该方法需要的靶基因同源臂较长,其次复合体RecBCD能够降解线性DNA故而需要构建具有特定靶位点的靶质粒,最后,依照该传统方法制备基因缺失菌株的成功率低,耗时费力[13-14]。Red同源重组技术不同于RecA重组系统,不需要酶切等操作步骤,其原理是将携有与靶基因两端(50 bp左右)序列同源的聚合酶链式反应(polymerase chain reaction,PCR)产物或人工合成的寡核苷酸片段,经由电转化的方式导入宿主体内,在重组酶的作用下,与基因组的特定靶序列进行高效重组替换,从而使得目的基因被敲除[15]。Red同源重组技术已成功运用于多种细菌基因缺失菌株的构建。
越来越多的研究表明,致病菌对外界环境的感知和应对能力是决定其能否感染宿主的关键,在感染宿主时致病菌会遇到许多不同的环境压力,而这些压力对于细菌而言具有潜在的致命性。阪崎克罗诺肠杆菌污染婴幼儿配方奶粉被制作以及被摄入体内后,必须具有抵抗各种环境压力的能力,才能最终存活以引发人体疾病。酸碱、温度、胆盐、渗透压等是其必须克服的外界环境压力。目前,关于阪崎克罗诺肠杆菌的研究大多集中于对其外膜蛋白的研究以及药物对其抑制及生物膜的清除等情况,对其致病机制以及潜在毒力因子的研究还都处于初级阶段,这就意味着在该领域仍旧存在着太多的未知。本实验旨在研究phoP基因对阪崎克罗诺肠杆菌环境耐受的影响,通过Red同源重组法构建基因缺失菌株,从生长曲线、酸碱、温度、胆盐、渗透压方面测定了阪崎克罗诺肠杆菌phoP基因缺失前后对于环境的耐受能力的变化,分析phoP基因在阪崎克罗诺肠杆菌应对外界环境压力时所起的调节作用,对阪崎克洛诺肠杆菌的防控具有一定的指导意义。
1 材料与方法
1.1 材料与试剂
阪崎克罗诺肠杆菌BAA894-NA由本实验室保存;质粒PKD46、PKD3和PCP20 捷晶生物有限公司。
胰蛋白胨大豆琼脂及肉汤培养基、LB琼脂、LB肉汤北京路桥技术有限公司;L-阿拉伯糖、氯霉素(Cm)、羧苄青霉素(Carb)等抗生素 美国MP生化公司;EcoRI内切酶及Buffer 美国Thermo公司;高保真酶及PCR体系 北京全式金生物科技有限公司;PCR引物江苏奥科生物科技公司;胆盐 美国Sigma公司;电击杯(2 mm) 美国BTX公司。
1.2 仪器与设备
2216MK低温高速离心机 德国Hermle公司;9600基因扩增仪 珠海黑马医学仪器有限公司;iQ5实时荧光定量PCR仪、Smart SpecTMplus分光光度计 美国Bio-Rad公司;InfinitcTMM200PRO多功能酶标仪 瑞士帝肯集团公司;JS680B凝胶成像仪 上海培清科技有限公司;LMQ.C立式灭菌器 山东新华医疗机械股份有限公司。
1.3 方法
1.3.1 phoP基因缺失菌株的构建
1.3.1.1 引物设计
通过Primer Premier 5.0进行同源重组的引物(phoP-F、phoP-R)的设计,5’端为实验菌株阪崎克罗诺肠杆菌的目的基因phoP两端的同源臂(小写表示),3’端为用以扩增氯霉素抗性基因(其两侧各携有1个FRT位点)的引物(大写表示),通过该引物扩增模板PKD3上的氯霉素抗性片段,最后通过DNA纯化试剂盒获得能够与目的基因phoP发生同源重组的氯霉素抗性片段。鉴定引物(JD-F、JD-R)则设计在目的基因的上下游。引物见表1。
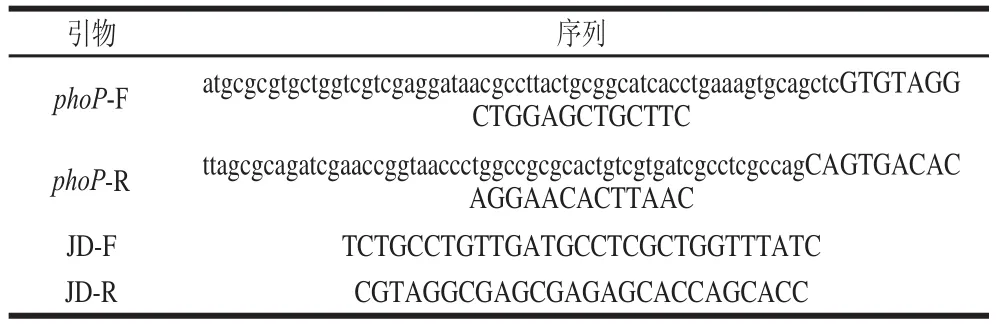
表1 引物序列Table 1 Primer sequences used in this study
1.3.1.2 电转感受态的制备
将细菌划线活化,挑取单菌落于LB液体培养基中(25 mL),置于37 ℃、180 r/min摇床中培养至OD600nm值为0.6,然后置于低温高速离心机中5 000 r/min、4 ℃离心10 min,倒掉上清液后用事先预冷的无菌水洗涤一次,预冷的10%甘油洗涤2 次,最后浓缩250 倍为100 μL的感受态细胞,以每管50 μL的量分装,置于-80 ℃冰箱备用[16]。
1.3.1.3 氯霉素抗性片段的制备
以PKD3为模板,phoP-F、phoP-R为引物,扩增两侧携有FRT位点的氯霉素抗性片段。扩增反应程序设计如下:95 ℃预变性3 min;94 ℃变性20 s;60 ℃退火20 s;72 ℃延伸30 s;35个循环后,72 ℃延伸10 min。以JD-F、JD-R为引物进行产物鉴定。
1.3.1.4 Red同源重组系统的构建
将阪崎克罗诺肠杆菌BAA894-NA制备为感受态(1.3.1.2节方法制备),取PKD46质粒约150 ng电转入50 μL感受态。电转化条件参数:电压2.5 kV,频率25 μF,电阻200 Ω,时间4~5 ms。电击完成后加入1 mL SOB(super optimal broth)液体培养基,转移至无菌试管中,于180 r/min、30 ℃条件下振荡培养2 h后,涂布于Carb平板(50 μg/mL)上,30 ℃条件下培养过夜。挑选Carb平板上的阳性重组子接种于25 mL含Carb(50 μg/mL)的SOB培养基中,加入2.5 mLL-阿拉伯糖(1 mol/L)溶液进行诱导后,制备成感受态(按1.3.1.2节方法制备)。
1.3.1.5 目的基因替换
取氯霉素抗性基因片段约250 ng电转入同源重组系统构建成功的感受态中(电转化条件参数同1.3.1.4节所述),电击完成后加入1 mL SOB液体培养基,于30 ℃、180 r/min条件下振荡培养2 h,涂布于Cm平板(20 μg/mL),42 ℃培养过夜。用无菌牙签挑取Cm平板上长出的单菌落,分别点样于Cm平板、Carb平板和LB平板上,42 ℃培养。挑取能够在LB平板及Cm平板上生长但在Carb平板上不能生长的单菌落,以JD-F、JD-R为引物进行产物鉴定。
1.3.1.6 耐药基因的消除
挑选验证正确的氯霉素抗性重组子制备成感受态(按1.3.1.2节方法制备),电转入PCP20质粒(电转化条件参数同1.3.1.4节所述),涂布于氨苄和Cm双抗性平板,于30 ℃条件下培养,挑选出阳性重组子转至LB培养液中,42 ℃培养过夜。热诱导使FLP重组酶得以表达,从而删除氯霉素片段以及一个FRT位点。取适量菌液涂布于LB平板,用无菌牙签挑取平板上长出的单菌落分别点样于Cm平板、Carb平板和LB平板,最终所得无耐药性菌株即为phoP基因缺失菌株。以JD-F、JD-R为引物进行产物鉴定,并送样测序。
1.3.2 菌种活化
取出保藏的实验菌株,在LB平板上划线培养后,挑取单菌落于胰蛋白胨大豆肉汤液体培养基(tryptic soy broth,TSB)中进行二次活化,培养18 h致使细菌处于对数生长期后期,将活化所得的菌悬液用新鲜的TSB培养液清洗一次(4 ℃,8 000×g,5 min)后,再添加新鲜的TSB培养液,调整其OD600nm值为0.5(此时菌液浓度约为108CFU/mL)[17]。
1.3.3 生长曲线测定
将野生型菌株以及基因缺失菌株按1.3.2节方法制备成菌悬液后,稀释100 倍备用。取出96 微孔板,每孔加入250 μL稀释的菌液,每个菌株做6 个复孔,以无菌新鲜的TSB培养液为阴性对照,于37 ℃培养,每隔1 h测定一次培养液的OD600nm值。绘制菌株的生长曲线图。
1.3.4 对酸碱耐受的测定
将野生型菌株以及基因缺失菌株按1.3.2节方法制备成菌悬液后,取出96 微孔板,每孔按1∶1加入菌液和pH 4的新鲜培养基250 μL(125 μL的菌液和125 μL pH 4的新鲜培养基混合),每个菌株做6 个复孔,以相对应的无菌新鲜TSB培养液为阴性对照,以测定菌对酸的耐受性;同样的,每孔按1∶1加入菌液和pH 12的新鲜培养基250 μL(125 μL的菌液和125 μL pH 12的新鲜培养基混合),每个菌株做6 个复孔,以相对应的无菌新鲜TSB培养液为阴性对照,以测定菌的碱耐受性。放置于37 ℃条件下培养,每隔1 h测定一次培养液的OD600nm值。绘制菌株的生长曲线图。
1.3.5 对温度耐受的测定
将野生型菌株以及基因缺失菌株按1.3.2节方法制备成菌悬液后,分别以1%的菌浓度接种至新鲜培养液中分别置于55、65 ℃条件下培养,于1、2、5、8、10、20、30 min时,对菌液进行10 倍稀释从而形成不同梯度菌液,将菌液进行涂布、点板,于37 ℃条件下过夜,计数测定活菌数。
1.3.6 对胆盐耐受的测定
将野生型菌株以及基因缺失菌株按1.3.2节方法制备成菌悬液后,分别以1%的菌浓度接种至含不同胆盐质量分数(4%、8%、12%)的培养液中,置于37 ℃条件下培养。分别在2 h时取样进行10 倍稀释,进行涂布、点板,于37 ℃条件下过夜,计数,计算存活率。
1.3.7 对渗透压耐受的测定
将野生型菌株以及基因缺失菌株按1.3.2节方法制备成菌悬液后,分别以1%的菌浓度接种至NaCl质量分数不同(1.5%、3%、6%)的培养液(模拟不同渗透压环境)中,放置于37 ℃条件下培养。分别在2、4 h取样进行10 倍稀释,进行涂布、点板,于37 ℃条件下过夜,计数,计算存活率。
1.3.8 存活率的计算
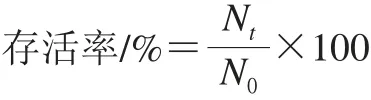
式中:N0为t时刻纯培养液中活菌数;Nt为t时刻不同条件溶液中活菌数。
1.4 数据分析
实验数据利用SPSS软件22.0版本进行分析,采用独立样本T检验法进行分析。P<0.05,差异显著;P<0.01,差异极显著。
2 结果与分析
2.1 phoP基因缺失菌株的构建

图1 PCR鉴定重组子Fig. 1 PCR amplification of positive clones
通过Red同源重组方法成功构建阪崎克罗诺肠杆菌phoP基因缺失菌株,通过引物JD-F、JD-R进行产物验证。理论上,野生型菌株C. sakazakii BAA894-NA的PCR产物大小为872 bp,目的基因被成功替换的菌株PCR产物大小为1 378 bp,而最终的基因缺失菌株的PCR产物大小为448 bp。如图1所示,显然,phoP基因缺失菌株的条带接近500 bp,符合预期。送样测序的结果如下:CGCTTATGCCTTTAGTATAATTGGCGTTAAACTATTTA TATATTTGATGGATAAGGGGACCCCGGATGCGCGTG CTGGTCGTCGAGGATAACGCCTTACTGCGGCATCAC CTGAAAGTGCAGCTCGTGTAGGCTGGAGCTGCTTC GAAGTTCCTATACTTTCTAGAGAATAGGAACTTC GGAATAGGAACTAAGGAGGATATTCATATGGACCAT GGCTAATTCCCATGTCAGCCGTTAAGTGTTCCTGTG TCACTGCTGGCGAGGCGATCACGACAGTGCGCGGC CAGGGTTACCGGTTCGATCTGCGCTAAATGAAAAA AAACGTCCTGCGCCACTTTCTCCCGCTCTCGCTGCG GGTGCGCTTTTTACTCGCGACCGCGGCGGTGGTGCT GGTGCTCTCGCTCGCCTACGAGGGGG(下划线部分为同源臂,框住部分为残留的一个FRT位点,可见phoP基因被成功敲除)。
2.2 phoP基因对阪崎克罗诺肠杆菌生长曲线的影响

图2 生长曲线的测定Fig. 2 Growth curves
借助酶标仪每隔1 h测定一次阪崎克罗诺肠杆菌BAA894-NA以及phoP基因缺失菌株培养液的OD600nm值评估菌的生长,如图2所示,phoP基因的缺失明显延缓了阪崎克罗诺肠杆菌的生长速率,在指数期的尤其是第3、4小时,phoP基因缺失菌株培养液的OD600nm值仅为野生型菌株OD600nm值的41.79%、45.77%。
2.3 phoP基因对阪崎克罗诺肠杆菌酸碱耐受的影响
测定阪崎克罗诺肠杆菌野生型菌株以及phoP基因缺失菌株对酸(pH 4)、碱(pH 12)的耐受,如图3所示,比较阪崎克罗诺肠杆菌在应对酸、碱外界刺激培养相同时间时的OD600nm值可以发现,碱性情况下阪崎克罗诺肠杆菌达到平缓期的OD600nm值明显低于在酸性条件下的OD600nm值,由此推测阪崎克罗诺肠杆菌耐酸不耐碱。无论是在酸性或是碱性环境中,phoP基因缺失菌株在对数生长期时的生长情况均劣于野生型菌株,可见phoP基因在阪崎克罗诺肠杆菌应对外界酸碱刺激变化的过程中,确实起到了作用。
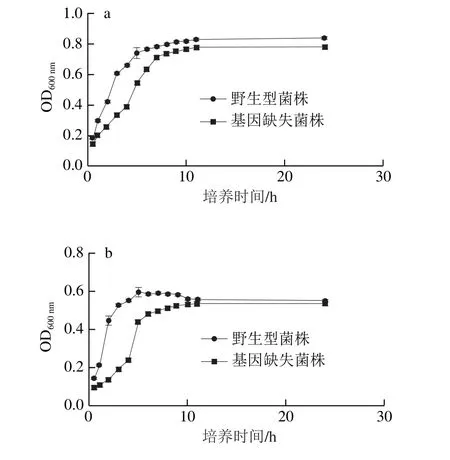
图3 3 phoPphoP基因对阪崎克罗诺肠杆菌耐酸(a)及a耐碱(b)能力的影响Fig. 3 Effect of phoP on acid (a) and alkaline (b) tolerance of C. sakazakii
2.4 phoP基因对阪崎克罗诺肠杆菌温度耐受的影响
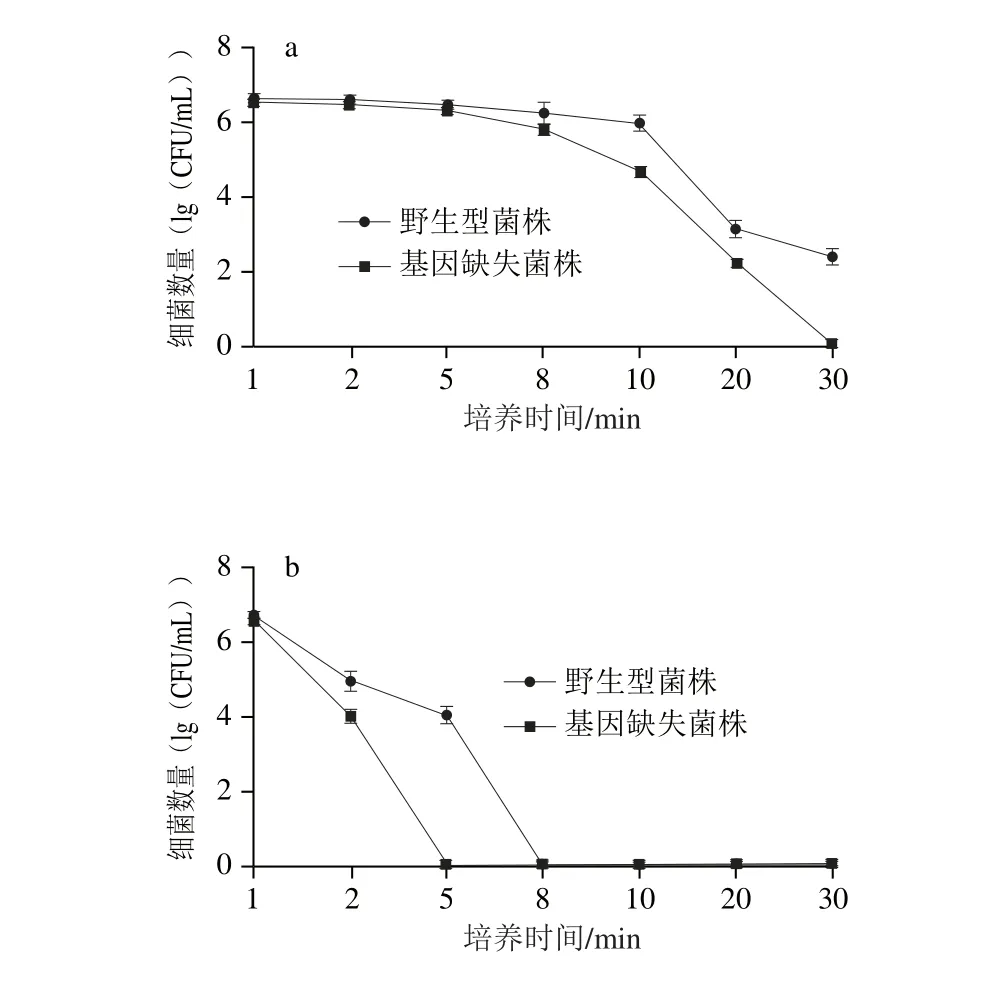
图 4 pphhooPP基因对阪崎克罗诺肠杆菌耐受温度55 ℃(a)和65 ℃(b)的影响Fig. 4 Effect of phoP on temperature tolerance of C. sakazakii at 55 ℃ (a) and 65 ℃ (b)
阪崎克罗诺肠杆菌对温度(55、65 ℃)的耐受结果如图4 所示,55 ℃条件下,30 min时phoP基因缺失菌株已完全被杀灭,低于检测线,而野生型菌株在30 min时仍然有存活;65 ℃条件下,phoP基因缺失菌株完全灭活只需5 min,而野生型菌株在该温度下经过8 min时才失去活性。
2.5 phoP基因对阪崎克罗诺肠杆菌胆盐耐受的影响
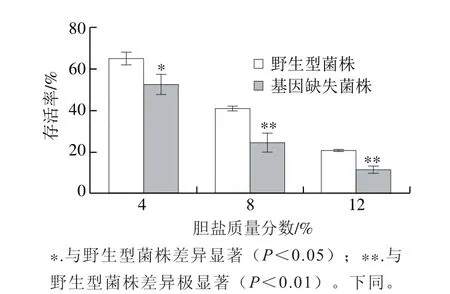
图5 5 phoPphoP基因对阪崎克罗诺肠杆菌耐胆盐能力的影响Fig. 5 Effect of phoP on bile salt tolerance of C. sakazakii
如图5所示,phoP基因的缺失减弱了阪崎克罗诺肠杆菌对于胆盐的耐受力。随着胆盐质量分数的增大,阪崎克罗诺肠杆菌的存活率呈现出递减趋势,并且phoP基因缺失菌株在不同质量分数胆盐溶液中的生长状况均劣于野生型菌株。培养2 h时,在含4%的胆盐溶液中培养后,阪崎克罗诺肠杆菌的phoP基因缺失菌株的存活率比野生型菌株的显著降低了19.93%(P<0.05),在含8%、12%胆盐溶液中培养后的阪崎克罗诺肠杆菌,phoP基因缺失菌株的存活率与野生型菌株相比极显著降低了40.73%和45.84%(P<0.01)。
2.6 phoP基因对阪崎克罗诺肠杆菌渗透压耐受的影响
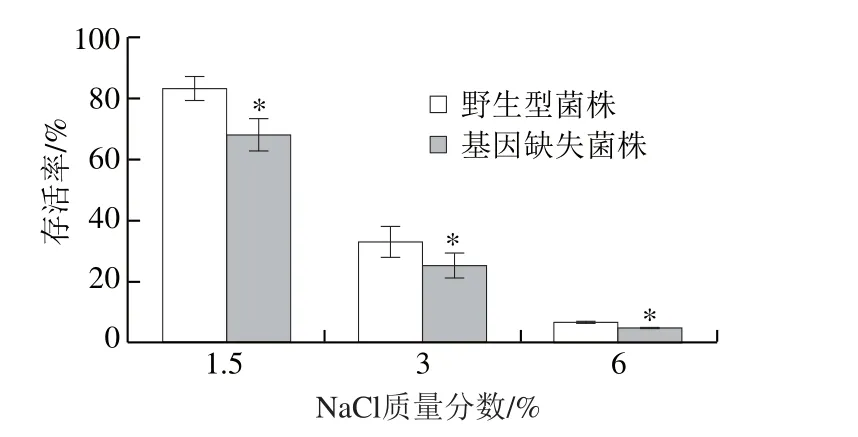
图6 6 phoPphoP基因对阪崎克罗诺肠杆菌渗透压耐受力的影响Fig. 6 Effect of phoP on osmotic pressure tolerance of C. sakazakii
利用不同质量分数NaCl溶液模拟不同渗透压环境,如图6所示,phoP基因缺失后,阪崎克罗诺肠杆菌对于渗透压的耐受力降低,基因缺失菌株与野生型菌株相比均显著降低(P<0.05)。且随着渗透压环境压力的增大,阪崎克罗诺肠杆菌的活性呈递减趋势。
3 讨 论
Red同源重组技术不需要酶切连接等复杂过程,已经被应用于大肠杆菌、克罗诺氏菌、假单胞菌、沙门氏菌等[18-19]。杨汐静等[20]通过Red同源重组技术成功构建大肠杆菌膜外蛋白A的缺失菌株以探究OmpA基因对大肠杆菌的生长影响。陶明新[21]依据此同源重组技术构建了肠炎沙门菌的sipA基因缺失菌株以探究其致病性。本实验通过Red同源重组技术成功构建获得阪崎克罗诺肠杆菌的phoP基因缺失菌株,为探究该基因对阪崎克罗诺肠杆菌环境耐受力的影响提供了研究依据。
实验结果表明,就阪崎克罗诺肠杆菌的生长状态而言,phoP基因的缺失明显延缓了菌的生长速率。在第3、4小时时,phoP基因缺失菌株培养液的OD600nm值仅为野生型菌株OD600nm值的41.79%、45.77%,可见phoP基因对阪崎克罗诺肠杆菌的生长状况具有一定的调节作用。这与Lin Zhiwei等[22]在志贺氏杆菌中发现的结论相符合。
酸碱耐受能力测定的实验结果表明,phoP基因在阪崎克罗诺肠杆菌应对外界酸碱刺激变化的过程中,确实起到作用。就体内而言,胃酸因其强酸性在很大程度上阻碍了致病菌的致病性。Bearson等[23]研究表明PhoP本身就是一种酸休克蛋白,phoP基因的缺失可能会略微增加有机酸的渗透性进而影响细菌。Lin Zhiwei等[22]报道中指出PhoP/PhoQ系统调控了志贺氏杆菌对pH值的应激反应,其存在使得志贺氏杆菌能够耐受低酸环境,促使该菌更快适应环境生长,这点与本实验结果相符合,即phoP基因使得阪崎克罗诺肠杆菌在一定程度上更耐酸碱。相对成人而言,婴幼儿的胃酸pH值要高一些,由母乳喂养的婴儿胃酸值约2.7,而由奶粉喂养的婴儿胃酸值更高为3.6左右,加上进食之后胃酸被稀释,pH值随之升高,这也是婴幼儿更容易被阪崎克罗诺肠杆菌感染致病的原因。柴云雷等[24]研究发现,阪崎克罗诺肠杆菌对酸的耐受力较强,但对碱耐受力弱,究其原因可能因为阪崎克罗诺肠杆菌为革兰氏阴性菌,细胞壁富含脂类物质从而易与碱发生反应,致使细胞膜破裂引发菌死亡。
阪崎克罗诺肠杆菌在6~45 ℃条件下均能生长,最佳生长温度为25~37 ℃[25]。通过热压能力测定的实验结果可知,随着温度的升高,阪崎克罗诺肠杆菌的存活时间变短,而phoP基因的缺失会导致菌的灭活时间进一步被缩短,由此可见,phoP基因起到了辅助阪崎克罗诺肠杆菌抵御外界热压的作用。对于阪崎克罗诺肠杆菌的防治与杀灭多体现应用于奶粉中,为避免奶粉中其他营养物质因高温而被破坏,温度不能过高。有关研究表明,巴斯德灭菌的温度能够杀灭阪崎克罗诺肠杆菌使其不得存活,故该菌的感染可能来自后续加工,猜测奶粉中的蛋白质、糖类等成分可能在一定程度上增加了阪崎克罗诺肠杆菌的耐热能力[24]。
胆汁是在消化系统中被发现的,另一种杀菌物质胆盐作为胆汁的重要构成成分,已经被证实具有杀菌作用,是阪崎克罗诺肠杆菌在胃肠道内存活必须克服的一个主要压力因素[26]。近年来,很多学者都致力于研究胆盐在抑菌过程中起的作用,特别是对肠道内细菌的作用,据推测,胆盐的分泌能力与细菌的致病力直接相关[27]。Velkinburgh等[28]研究显示,缺少PhoP/PhoQ调控系统的伤寒沙门氏菌突变株对胆汁的耐受浓度显著低于野生型菌株,证实鼠伤寒沙门氏菌对胆汁的高水平抗性依赖于PhoP/PhoQ二元调控系统。本实验结果显示,phoP基因缺失菌株在不同质量分数胆盐溶液中的生长状况均劣于野生型菌株,由此推测,phoP基因能促使阪崎克罗诺肠杆菌更快适应胆盐应激反应。
渗透压是威胁阪崎克罗诺肠杆菌在奶粉中存活的另一大阻碍,奶粉的水分活度低至0.2,这意味着阪崎克罗诺肠杆菌要 存活下来则必须克服高渗透压环境。Álvarez-Ordóñez等[29]研究表明,在渗透压作用下,蛋白质的再生、大分子的损伤修复、细胞 膜结构的维护及完整性以及一些代谢活动对细菌的存活至关重要。Yuan Jing等[30]将PhoP/PhoQ二元调控系统与渗透传感联系起来,其研究表明缺乏phoP基因的菌株面临高渗情况时,与野生型菌株相比表现出明显的生长滞后,证明了PhoP/PhoQ在高渗透压环境中能够加速细胞的修复。本研究结果显示,phoP基因缺失导致阪崎克罗诺肠杆菌对于渗透压的耐受力降低,与前人有关的研究结果相符合。
4 结 论
探究phoP基因对阪崎克罗诺肠杆菌环境耐受的影响,通过Red同源重组基因敲除手段,成功构建出阪崎克罗诺肠杆菌的phoP基因缺失菌株。在此基础上,通过测定并绘制阪崎克罗诺肠杆菌野生型菌株和phoP基因缺失菌株的生长曲线发现,phoP基因的缺失在一定程度上降低了阪崎克罗诺肠杆菌的生长速率。从酸碱环境耐受实验看,阪崎克罗诺肠杆菌表现出耐酸不耐碱的性质,野生型菌株对酸碱的耐受力优于phoP基因缺失菌株。其次,对于温度耐受能力测定的结果表明,phoP基因的缺失使得细菌的热致死时间变短,phoP基因起到了辅助阪崎克罗诺肠杆菌抵御外界热压的作用;再者,选取4%、8%、12%胆盐溶液对阪崎克罗诺肠杆菌的胆盐耐受力进行测定,结果表明随胆盐质量分数的增大,阪崎克罗诺肠杆菌的存活率呈递减趋势,phoP基因有利于阪崎克罗诺肠杆菌在胆盐溶液中存活;最后,对于渗透压环境的耐受实验表明,phoP基因也有助于阪崎克罗诺肠杆菌应对高渗环境以存活。综上所述,phoP基因有利于阪崎克罗诺肠杆菌的生长以适应外界环境压力。实验结果为进一步研究阪崎克罗诺肠杆菌的生长特性及致病力提供一定理论依据。
