辣椒自然游离小孢子胚状体诱导研究
2019-05-31高素燕吕敬刚焦荻商纪鹏焦定量黄亚杰
高素燕 吕敬刚 焦荻 商纪鹏 焦定量 黄亚杰
摘 要:为建立辣椒自然游离小孢子培养技术体系,以32个辣椒品种为试材,研究基因型(CL-1~CL-32)、基本培养基(MS、Nitsch and Nitsch、NLN、B5)、激素配比(ZT 0.5 mg·L-1+IAA 0.8 mg·L-1、ZT 0.5 mg·L-1+IAA 1.0 mg·L-1、ZT 1.0 mg·L-1+IAA 1.0 mg·L-1、ZT 1.5 mg·L-1+IAA 1.5 mg·L-1)、活性炭添加量(0.1,0.5,0.8,1.0 g·L-1)对辣椒小孢子胚状体诱导的影响。结果表明,基因型是辣椒小孢子胚状体诱导的关键因素,供试的32个基因型中有18个诱导成功,诱导成功率56.25%,其中F1代诱导成功率达到66.67%,而自交系诱导成功率为0,各基因型中以CL-14诱导率最高,达到29.2%;不同基因型最适培养基不同,5个基因型(CL-4,CL-8,CL-10,CL-12,CL-14)中CL-4、CL-12、CL-14均以Nitsch and Nitsch为基本培养基添加适量激素诱导胚状体最佳;不同基因型的适宜激素浓度配比不同,3个基因型(CL-4、CL-8、CL-14)中CL-8、CL-14以添加0.5 mg·L-1 ZT和1.0 mg·L-1
IAA效果最好;适量添加活性炭可提高小孢子胚诱导率,CL-4、CL-8、CL-14分别以添加0.8,0.5,0.5 g·L-1诱导效果最好。
关键词:辣椒;小孢子培养;花药培养;胚状体;单倍体
中图分类号:S641.3 文献标识码:A DOI 編码:10.3969/j.issn.1006-6500.2019.04.003
Studies on Embryoid Induction of Shed-microspore Culture in Pepper (Capsicum annuum L.)
GAO Suyan1,2,3,4, LYU Jinggang1,2,3,4, JIAO Di1,2,3,4, SHANG Jipeng1,2,3,4, JIAO Dingliang1,2,3,4, HUANG Yajie1,2,3,4
(1. Tianjin Kernel Vegetable Research Institute, Tianjin 300381, China; 2.State Key Laboratory of Vegetable Germplasm Innovation, Tianjin 300381, China; 3.Tianjin Key Laboratory of Vegetable Genetics and Breeding Enterprise, Tianjin 300381, China; 4.Tianjin Vegetable Research Center, Tianjin 300381, China)
Abstract: To establish the shed-microspore culture technique system in pepper, the experiment was conducted with 32 pepper varieties as materials, the effects of genotypes(CL-1~CL-32), culture medium (MS, Nitsch and Nitsch, NLN, B5), hormones (ZT 0.5 mg·L-1+IAA 0.8mg·L-1, ZT 0.5 mg·L-1+IAA 1.0 mg·L-1, ZT 1.0 mg·L-1+IAA 1.0 mg·L-1, ZT 1.5 mg·L-1+IAA 1.5 mg·L-1), active charcoal (0.1, 0.5, 0.8, 1.0 g·L-1) on microspore embryos induction were studied. The results showed that genotype was the key factor for microspore embryoid induction in pepper, 18 of 32 genotypes were embryonic, and the induction success rate was 56.25%; the induction success rate of F1 generation was 66.67%, while that of inbred lines were 0; the induction rate of CL-14 was the highest (29.2%). The optimum medium for different genotypes was different, Nitsch and Nitsch was best for CL-4, CL-12, CL-14 in 5 genotypes (CL-4, CL-8, CL-10, CL-12, CL-14). In 3 genotypes (CL-4, CL-8, CL-14), adding 0.5 mg L-1 ZT and 1.0 mg L-1 IAA was suitable for CL-8, CL-14 to produce embryos successfully. Adding activated carbon could improve the induction rate of microspore embryos, in which CL-4, CL-8 and CL-14 had the best induction effect by adding 0.8, 0.5, 0.5 g·L-1, respectively.
Key words: pepper; microspore culture; anther culture; embryo; haploid
辣椒(Capsicum annuum L.)是茄科辣椒属一年生或多年生草本植物,在明末传入我国,并被广泛种植。据2017年中国蔬菜流通协会统计,我国辣椒栽培面积占世界总面积的35%,总产量占世界的46%(数据来源于2017年遵义第二届国际辣椒博览会新闻发布会),辣椒产业已成为国内最大的蔬菜产业。
单倍体培养技术可以在短时间内获得纯系、缩短育种周期,受到育种家的普遍重视。早在1973年国内外就已经有通过花药培养获得辣椒单倍体植株[1-2]的报道,之后多位研究者对培养基组成及培养方法进行了改进[3-6],并利用该技术选育出海花系列辣(甜)椒品种[7-9]。随着小孢子培养技术的发展,人们开始进行辣椒的游离小孢子培养的探索并成功获得胚状体[10-13]。但游离小孢子胚状体诱导率极低,虽然经过改良培养基、小孢子预处理等方法的改进,仍不能达到理想效果。利用固液双层培养方法(小孢子散出培养法或自然游离法)既可有效减少花药培养过程中易褐化的问题,也可减少机械游离对小孢子的伤害,该方法国内外均有成功报道[14-17],但多应用于甜椒,并且诱导频率较低,因此继续对该方法进行优化,提高胚状体诱导率,获得双单倍体(DH)植株及DH系才能使该技术早日应用于辣椒育种中。
本研究通过对不同类型辣椒进行自然游离小孢子的培养,分析影响小孢子胚状体诱导的各种因素,旨在总结出适合辣椒单倍体诱导的培养方法,提高辣椒小孢子胚状体诱导率。
1 材料和方法
1.1 试验材料
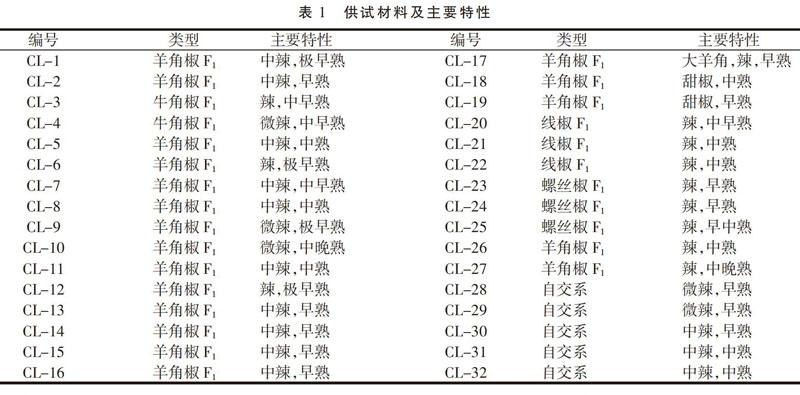
供试材料为32个辣椒杂交一代及自交系,来源于天津科润蔬菜研究所辣椒课题组,于2018年4月定植于天津市农科院武清创新基地的塑料大棚中,类型包括羊角椒、牛角椒、螺丝椒、线椒;其中杂交一代品种27个,自交系5个;供试材料及主要特性见表1。
1.2 试验方法
小孢子培养方法参考Supena[15],并进行适当优化。具体操作过程如下:从处于始花期至盛花期的辣椒植株上选取处于单核靠边期的花蕾置于4 ℃冰箱中预处理1~2 d;在超净工作台上将花蕾用70%酒精浸泡30 s,5% NaClO灭菌15 min,无菌水冲洗3~4次,用无菌滤纸吸干花蕾表面水分;用无菌刀片将花蕾剖开取出花药并将花药基部的花丝去除干净,之后接种于装有固液双层培养基的培养皿(直径60 mm)中,每皿接种10~12个花药,每个处理接种3皿,设3次重复;置于9 ℃培养箱中暗培养1周,之后转入25 ℃暗培养3~5周后再转入光照下培养。
具体试验设计如下。(1)基因型:上述32份材料在固体MS培养基中培养。(2)基本培养基处理:以CL-4、CL-8、CL-10、CL-12、CL-14为材料,在MS、Nitsch and Nitsch(NN)、NLN、B5液体培养基加MS固体培养基上采用自然游离培养法进行单倍体培养。(3)外源激素处理:以CL-4、CL-8、CL-14为试材,在Nitsch and Nitsch(NN)液体培养基加MS固体培养基上采用自然游离培养法进行培养,设置4个激素组合处理(ZT 0.5 mg·L-1+IAA 0.8 mg·L-1,ZT 0.5 mg·L-1+IAA 1.0 mg·L-1,ZT 1.0 mg·L-1+IAA 1.0 mg·L-1,ZT 1.5 mg·L-1+IAA 1.5 mg·L-1),以不添加激素作為对照(CK)。(4)活性炭(AC)处理:以CL-4、CL-8、CL-14为试材,培养基与外源激素处理相同,在下层MS固体培养基添加活性炭,浓度设置为0.1,0.5,0.8,1.0 g·L-1,以不添加活性炭处理作为对照(CK)。
从接种30 d开始,每15 d调查1次胚状体发生数,连续调查3次,以胚状体数最多的1次计算胚状体诱导率。胚状体诱导率=(胚状体数/接种花药总数)×100%。
2 结果与分析
2.1 自然游离小孢子培养过程的形态观察
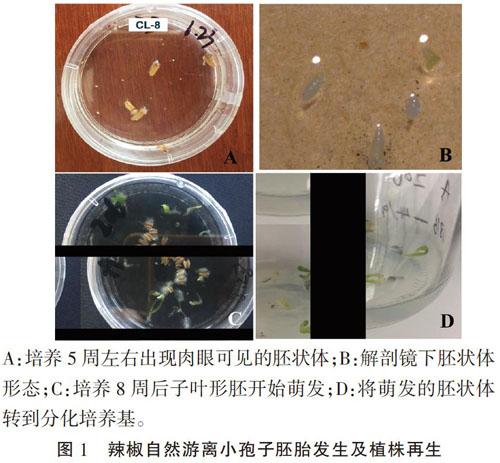
将处于单核靠边期的花药接种于固液双层培养基(固体MS+液体NN)中进行培养,大约5周后可出现肉眼可见的胚状体(图1A);解剖镜下观察发现以球形、鱼雷形胚状体为主(图1B),之后部分胚状体继续发育成子叶形胚状体;培养8周后,子叶形胚状体开始萌发并形成再生植株(图1C、图1D)。
2.2 基因型对胚状体诱导的影响
在多种作物的单倍体培养研究中,基因型均是关键影响因素[18-20],辣椒小孢子胚状体诱导也同样受基因型影响较大。从表2可以看出,在供试的32个基因型中,有18个基因型诱导胚状体,诱导成功率为56.25%;羊角椒诱导成功率66.67%、螺丝椒诱导成功率100%、线椒诱导成功率33.33%;杂交一代诱导成功率为66.67%,自交系未能诱导出胚状体。诱导率最高的基因型为CL-14,诱导率达到29.20%。因此,基因型是辣椒小孢子胚状体诱导的重要因素,不同类型辣椒其诱导结果也不同。
2.3 基本培养基对胚状体诱导的影响
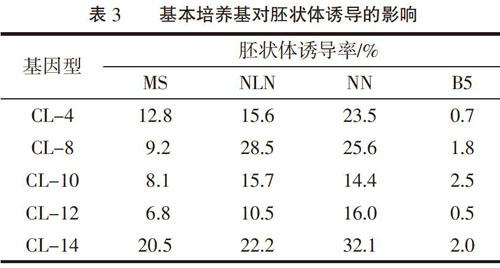
选择5个诱导率较高的基因型继续进行基本培养基的筛选。由表3可知,以MS、NLN、Nitsch and Nitsch(NN)、B5为基本培养基均可诱导胚状体;CL-4、CL-12、CL-14以Nitsch and Nitsch(NN)为基本培养基胚状体诱导效果较好,诱导率较高,并且畸形胚或死亡胚数量较少,而CL-8、CL-10最适培养基为NLN,说明基本培养基的选择会影响辣椒小孢子胚状体诱导,不同基因型辣椒最适培养基不同。
2.4 激素配比对胚状体诱导的影响
以CL-4、CL-8、CL-14为试材,研究在Nitsch and Nitsch(NN)上层液体培养基中添加不同浓度配比的ZT、IAA对胚状体诱导的影响,以不添加激素为对照。由表4可知,添加激素可显著提高辣椒小孢子胚状体的诱导率,其中0.5 mg·L-1 ZT+1.0 mg·L-1IAA的激素组合分别使CL-8、CL-14胚状体诱导率提高1.2和1.4倍,0.5 mg·L-1 ZT+0.8 mg·L-1IAA的激素组合使CL-4胚状体诱导率提高2.2倍,因此,不同基因型最适激素浓度配比也不相同。
2.5 活性炭对胚状体诱导的影响
以CL-4、CL-8、CL-14为试材,在下层固体培养基中添加不同浓度活性炭,研究活性炭对辣椒小孢子胚状体诱导的影响。由表5可知,下层固体培养基中添加一定浓度的活性炭可提高小孢子胚诱导率,随着活性炭浓度增加,诱导率呈先增加后下降的趋势,CL-4、CL-8、CL-14分别以添加0.8,0.5,0.5 g·L-1活性炭诱导效果最好。
3 结论与讨论
目前,有关辣椒小孢子培养方式已有大量研究,主要是采用机械游离[12]和自然释放[14]2种方法获得游离小孢子,结果发现辣椒小孢子在机械积压过程中易造成损伤从而影响诱导率,而采用固液双层培养辣椒花药使小孢子自然游离既减少了对小孢子的损伤,也避免了花药培养过程中易褐化、易形成愈伤等问题[16]。本试验采用固体MS培养基成功获得18个基因型辣椒小孢子胚状体,最高诱导率为29.2%(CL-14),在固液双层Nitsch and Nitsch培养基添加适宜浓度激素,CL-14诱导率可提高至32.6%,说明通过固液双层培养基进行辣椒自然游离小孢子培养可以获得较高的胚诱导率,这一结果与Supena[14-15]、Esin[16]等人的研究报道相符。
培養基中添加激素可提高胚状体诱导率,但其效果因激素种类和浓度不同而不同,甚至不添加激素的培养基也可获得胚状体[17]。本试验结果亦表明,培养基中添加激素可提高胚状体诱导率,但不同基因型最适激素浓度不相同。
活性炭对小孢子培养的影响表现在两方面,一方面有利于吸收有害物质而促进胚状体的形成,另一方面也会吸收激素等有益物质而妨碍胚状体的形成。在单纯固体培养基或液体培养基研究中,有的研究发现活性炭有利于小孢子胚的诱导[21],有的研究报道发现不添加活性炭会获得较多胚状体[22]。本试验将活性炭添加于下层固体培养基中,结果显示在一定浓度范围内有利于胚状体发生。
参考文献:
[1]王玉英,孙敬三,王敬驹,等.小黑麦和辣椒花粉植株的诱导[J].中国科学,1973(16):104-107.
[2]GEORGE L, NARAYANASWAMY S. Haploid Capsicum through experimental androgenesis[J].Protoplasma, 1973, 78: 467-470.
[3]KELL K, SVEN B A. Effects of donor plant temperature, photoperiod, and age on anther culture response of Capsicum annuum L.[J].Euphytica, 1993, 67: 105-109.
[4]MITYKO J, FARI M. Problems and results of doubled haploid plant production in pepper (Capsicum annuum L.) via anther and microspore culture[J]. Acta horticulturae, 1997, 447: 281-288.
[5]ERCAN N, SENSOY F A, SENSOY S. Influence of growing season and donor plant age on anther culture response of some pepper cultivars (Capsicum annuum L.)[J].Sci hortic, 2006, 110: 16-20.
[6]王立浩,张宝玺,郭家珍,等.辣椒花药培养中若干影响因素的研究[J].园艺学报,2004,31(2):199-204.
[7]李春玲,蒋钟仁.甜椒花培新品种‘海花三号的育成[J].园艺学报,1990,17(1):39-44, 82.
[8]张树根,沈火林,蒋钟仁,等.辣椒花药培养单倍体育种技术研究进展[J].辣椒杂志,2006(3):1-5, 8.
[9]PAUK J, LANTOS C, SOMOGYI G, et al. Tradition, quality and biotechnology in Hungarian spice pepper (Capsicum annuum L.) breeding[J]. Acta agron hung, 2010, 58(3): 259-266.
[10]GEMES J A, KRISTOF Z, VAGI P, et al. In vitro anther and isolated microspore culture as tool in sweet and spice pepper breeding[J]. Acta horticulturae, 2009, 829: 61-64.
[11]BUYUKALACA S, COMLEKCIOGLU N, ABAK K, et al. Effects of silver nitrate and donor plant growing conditions on production of pepper(Capsicum annuum L.) haploid embryos via anther[J].Eur j hortic sci, 2004, 69: 206-209.
[12]LANTON C, JUHASZ A G, VAGI P, et al. Androgenesis induction in microspore culture of sweet pepper (Capsium annuum L.) [J].Plant biotechnol rep, 2012, 6: 123-132.
[13]成研,巫东堂,马蓉丽,等.不同游离方式辣椒小孢子的胚胎发生[J].山西农业科学,2012,40(7): 705-708.
[14]SUPENA E D J, SUHARSONO S, JACOBSEN E, et al. Successful development of a shed-microspore culture protocol for doubled haploid production in Indonesian hot pepper (Capsicum annuum L.) [J].Plant cell rep, 2006b, 25: 1-10.
[15]SUPENA E D J, CUSTERS J B M. Refinement of shed-microspore culture protocol to increase embryos production in hot pepper(Capsicum annuum L.)[J].Sci hortic, 2011, 130: 769-774.
[16]ESIN A, TOLGA Y, NEDIM M, et al. Comparison of different androgenesis protocols for doubled haploid plant production on ornamental pepper(Capsicum annuum L.)[J].Turk journal of biology, 2016, 40: 944-954.
[17]黃亚杰,李素文,肖瑜,等.辣椒花药培养的初步研究[J].河南农业科学,2014,43(7):112-115, 125.
[18]曹鸣庆,李岩,刘凡.基因型和供体植株生长环境对大白菜游离小孢子胚胎发生的影响[J].华北农学报,1993,8(4):1-6.
[19]戴希刚,施雪萍,包满珠.基因型与培养条件对羽衣甘蓝小孢子胚胎发生的影响[J].植物生理学报,2012,48(11):1113-1119.
[20]张玉苗.不同茄子材料小孢子脱分化及影响因子研究[D].北京:中国农业科学院,2011.
[21]李春玲,佟曦然,朱至清,等.辣(甜)椒游离小孢子培养中的雄核发育和胚胎发生[J].园艺学报,2008,35(11):1613-1620.
[22]韩阳,叶雪凌,冯辉.大白菜小孢子培养影响因素研究[J].中国蔬菜,2006(7):16-18.
