赤羽病病毒N蛋白单克隆抗体的制备
2019-05-21王冰
王 冰
(黑龙江农垦职业学院,黑龙江 哈尔滨 151025)
赤羽病又名阿卡斑病(Akababe disease),是由布尼病毒科、布尼病毒属、辛波病毒群的赤羽病病毒(Akabane virus,AKAV)所引起的牛、绵羊和山羊的一种多形性传染病,以牛、羊的流产、早产、死产及先天性关节弯曲和积水性无脑症(Arthrogryposis Hydraencephaly,AH 综合症)为特征[1-2]。该病首次于1949年在日本群马县赤羽村发现,1959年才首次从该地采集的金色库蚊和三带缘库蚊体内分离到病毒,因此命名为 AKAV,此后澳大利亚、肯尼亚、南非、以色列、日本等地相继暴发该病[2-3]。我国科学家自1994年开始进行该病流行病学调查,至今已证实陕西、内蒙、湖南、河北、北京、上海、山东、安徽、吉林、甘肃、江苏、浙江、福建、湖北、广东等部分地区均有该病的流行[1]。目前,已经证实赤羽病广泛分布于澳大利亚、东南亚、亚洲东部、中东和非洲的热带和温带地区,主要由蚊虫、库蠓、螨类等节肢动物传播[1-3]。该病在我国被列为二类动物传染病,为重点检疫对象[3]。
AKAV 为单链负股RNA 病毒,其基因组由L(6 868 nt)、M (4 309 nt)、S (858 nt)3 个基因节段组成,分别编码 RNA 依赖的 RNA 聚合酶 L(L 节段)、囊膜糖蛋白 G1、G2、NSm (M 节段)和核衣壳蛋白 N、NSs (S 节段)[4]。N 蛋白作为补体结合反应的抗原,可以直接与体外转录的病毒S 节段RNA 结合以及与被感染细胞的细胞器结合而调节病毒的复制等特性[5-6]。N 蛋白为 AKAV 核蛋白,约 27 ku,氨基酸序列分析显示不同病毒株间N 蛋白相似性为97 %~100 %[6]。此外研究证实N 蛋白在病毒粒子与感染细胞中含量较多,可以作为诊断方法研究的有效靶抗原[6]。本实验利用原核表达系统表达、纯化AKAV N 蛋白并用其免疫小鼠制备单克隆抗体(MAb),为AKAV 检测方法的建立以及相关功能的研究奠定基础。
1 材料与方法
1.1 主要实验材料SP2/0细胞、BHK-21细胞、蓝舌病病毒1型(Bluetongue virus,BTV)、茨城病毒(Ibaraki virus,IBAV)、中山病病毒(Chuzan virus,CV)以及赤羽病病毒均由本实验室保存;E.coliDH5α 与BL21 感受态细胞购自北京中衫金桥生物技术有限公司。6 周龄 SPF 级 BALB/c 雌鼠由北京维通利华实验动物技术有限公司提供。ExTaqDNA聚合酶、限制性内切酶KpnⅠ和SalⅠ、反转录酶、DNA Marker 均购自 TaKaRa公司;T4 DNA连接酶、HRP标记的抗His标签MAb购自NEB公司;MAb亚型鉴定试剂盒购自 Invitrogen 公司;预染蛋白Marker购自Fermentas公司;DAB显色试剂盒、HRP标记的山羊抗鼠IgG(IgG-HRP)购自北京中杉金桥生物技术有限公司;胎牛血清、DMEM 培养基、羊抗鼠 IgG-FTTC 均购自 Gibco 公司;弗氏佐剂、PEG、HAT、HT 和 8- 氮鸟嘌呤(8-AG)、TMB 底物均购自 Sigma 公司;IPTG 购自 Merck 公司;TRIzol试剂与质粒小量抽提试剂盒购自Axygen 公司;胶回收小量试剂盒购自上海华舜生物工程有限公司。
1.2 AKAV N 蛋白的原核表达与纯化 根据Gen-Bank 中登录的 AKAN N 基因序列(AB000851),利用Primer Premier 5.0 软件设计引物,引物由英潍捷基(上海)贸易有限公司合成。其序列如下:F:5'-GG CGGTACCATGGCAAATCAATTCATTTTCAACGA T-3';R:5'-GCCGTCGACGGATCTGGATACCAAAT TGAGCCAGG-3'。利用 TRIzol 试剂从 AKAV 感染的BHK-21 细胞中提取病毒基因组RNA,利用下游引物反转录合成cDNA 后作为模板,利用上述特异性引物对N 基因进行PCR 扩增。胶回收目的片段克隆至 pET-30a 中,构建原核表达载体 pET-N,经PCR 和双酶切鉴定正确后由上海英骏公司测序。将测序正确的重组质粒转化BL21 感受态细胞,利用IPTG 诱导表达。收集的菌液离心,收获细菌沉淀。经 SDS-PAGE 电泳检测 N 蛋白的表达。以 HRP 标记的抗 His 标签的 MAb (1∶2 000)为检测抗体,采用western blot 鉴定N 蛋白及其生物学活性。表达的重组N 蛋白利用包涵体纯化方法纯化并检测纯化效果。
1.3 动物免疫 以纯化的重组N 蛋白经腹腔注射免疫6周龄 BALB/c 雌鼠6只,剂量约为 100 μg/只,每两周免疫一次。首免将重组N 蛋白与弗氏完全佐剂混合,二免和三免将重组N 蛋白与弗氏不完全佐剂混合,三免后一周尾静脉采血,将血清倍比稀释采用间接ELISA 检测血清抗体效价[7],选择血清效价最高的小鼠于融合前 3 d 以 100 μg N 蛋白(不加佐剂)加强免疫,取其脾细胞进行细胞融合。
1.4 AKAV N 蛋白抗体间接ELISA 检测方法的建立按常规间接 ELISA 操作步骤[7],用 ELISA 包被缓冲液对重组N 蛋白做倍比稀释,经方阵法确定最佳检测条件。
1.5 分泌MAb 的杂交瘤细胞株的制备、效价及亚类的测定 在融合前24 h 制备饲养层细胞用于细胞融合,将SP2/0 细胞与效价最高的小鼠脾细胞以1:4混合,加入PEG-6000 融合后经选择性培养基HAT、HT 进行培养[6]。待杂交瘤细胞生长至板底面积1/4~1/3 或培养液变微黄色后,通过建立的间接ELISA 方法筛选阳性杂交瘤细胞株,同时将SP2/0细胞培养上清作为阴性对照。选择阳性杂交瘤细胞进行亚克隆,直到筛选出稳定分泌特异性MAb 的杂交瘤细胞株进行扩大培养,并将细胞冻存。
选取10 周龄的BABL/c 小鼠腹腔注射灭菌液体石蜡,7 d 后腹腔注射杂交瘤细胞,待小鼠腹部膨大收集腹水。MAb 上清分别作21~28倍稀释及腹水分别作101~108倍稀释作为一抗,同时设立阴阳性血清对照,通过1.4 建立的间接ELISA 法测定其效价。采用MAb 亚型鉴定试剂盒进行其亚类鉴定。
1.6 MAb 的鉴定
1.6.1 MAb 特异性的鉴定 将 AKAV、BTV1、IBAV、CV 分别接种于 BHK-21 细胞,培养 24 h 后用预冷的 75 %乙醇 4 ℃固定 30 min,以 MAb 上清(1∶2)为一抗,以羊抗鼠 IgG-FITC (1∶50)为二抗,同时设立未接病毒的细胞为空白对照及阴、阳性血清对照,间接免疫荧光(FFA)检测MAb 的特异性。
1.6.2 MAb 的 western blot 鉴定 将 AKAV 接种BHK-21 细胞,待其完全病变后收集细胞沉淀,同时收集未接毒BHK-21 细胞沉淀、大肠杆菌沉淀,常规处理后,同时将 1.2 原核表达的N 蛋白,一并进行 SDS-PAGE 电泳。分别以 MAb 上清(1∶2)作为一抗,羊抗鼠 IgG-HRP (1∶5 000)作为二抗,经 western blot 分析MAb 的反应性。
1.6.3 杂交瘤细胞的稳定性检测 将冻存3 个月的杂交瘤细胞复苏连续多次传代(20 代),以1.4 建立的间接ELISA 方法检测每代杂交瘤细胞上清的抗体效价,评价其分泌抗体的稳定性。
2 结果与讨论
2.1 AKAV 重组N 蛋白的表达及纯化 将构建的重组质粒pET-N 经PCR 和双酶切鉴定正确后利用大肠杆菌表达系统表达AKAV 重组N 蛋白,通过包涵体纯化方法对其进行了纯化并检测。SDS-PAGE 结果显示,重组N 蛋白得到表达且纯化效果较好,在35 ku 处出现目的条带,与预期相符(图1A)。Western blot 结果显示该蛋白可以与抗His MAb 反应,在35 ku 处出现特异性条带,而空载体表达产物不与抗His MAb 反应(图1B)。表明重组 N 蛋白得到了表达,且具有较好的反应性。
2.2 检测AKAV N 蛋白抗体的间接ELISA 方法的建立 经方阵法优比间接ELISA 最佳反应条件为:N 蛋白 1∶500 稀释即每孔约为 100 ng,5%脱脂乳4℃封闭过夜,阴阳性血清1∶2 000稀释,山羊抗鼠HRP-IgG 工作浓度 1∶5 000 时,作用条件均为 37 ℃孵育1 h,底物显色时间为10 min,可用于阳性杂交瘤细胞的筛选。
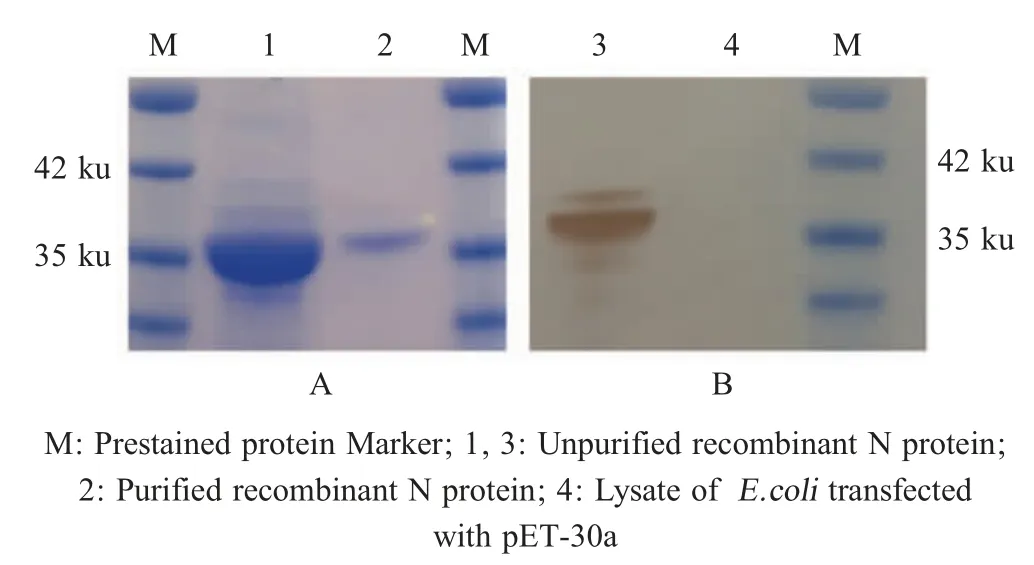
图1 重组N 蛋白的SDS-PAGE (A)和western blot 分析 (B)Fig.1 Analysis of recombinant N protein by SDS-PAGE (A)and western blot (B)
2.3 MAb 的制备及效价与亚类的鉴定 免疫的BALB/c 小鼠脾细胞与SP2/0 细胞融合后,经建立的间接ELISA 法筛选为阳性的杂交瘤细胞经3 次细胞亚克隆纯化后,得到1 株稳定分泌抗AKAV N 蛋白MAb 的阳性杂交瘤细胞,命名为IIG5。经建立的间接ELISA 测定MAb IIG5 杂交瘤细胞上清的效价为1∶2 562,腹水效价为 1∶105。IIG5 亚类为 IgG1/κ 链。
2.4 MAb 的鉴定
2.4.1 MAb 特异性的鉴定 分别用IIG5 MAb培养上清液对接种BTV1、IBAV、CV 和 AKAV 的BHK-21 细胞及未接种病毒的BHK-21 细胞进行IFA检测,结果显示 IIG5 仅与 AKAV 发生阳性反应,与其它病毒呈阴性反应(图2)。表明,MAb IIG5 具有良好的特异性。
图2 MAb 特异性的鉴定结果Fig.2 Specific identification of the MAbs by IFA
2.4.2 MAb 的 western blot 鉴定 将 IIG5 MAbs 的培养上清经western blot 鉴定,结果显示 IIG5 细胞上清与原核表达的N 蛋白、AKAV 感染的细胞沉淀中的 N 蛋白均呈阳性反应,分别于35 ku 与 27 ku处出现特异性条带,而与大肠杆菌菌体蛋白以及BHK-21 细胞蛋白呈阴性反应(图3),表明,IIG5 与原核表达的N 蛋白以及病毒感染细胞中的N 蛋白均具有较好的反应性。

图3 IIG5 MAb 的 western blot 鉴定Fig.3 Identification of the MAb by western blot
2.4.3 杂交瘤细胞的稳定性检测 将冻存3 个月的IIG5 杂交瘤细胞复苏后,连续传20 代收集每代培养上清进行间接ELISA 检测,结果显示每代IIG5 细胞株均能够分泌特异性的MAb,且分泌的MAb 效价无明显变化(数据未提供)。表明该细胞株能够稳定分泌特异性MAb。
N 蛋白是AKAV 的结构蛋白,在病毒粒子以及感染细胞中含量较高且具有较好的免疫原性,此外该基因在AKAV 各分离株间较保守,是一个适用于建立型特异性检测方法的抗原,利用其所制备的MAb 也具有一定的应用价值[8]。本实验基于此开展研究,利用 PCR 扩增本实验室保存的 AKAV N 蛋白基因,构建表达载体,利用原核表达系统表达N蛋白,经过融合以及3 轮筛选后获得一株杂交瘤细胞株IIG5,且该细胞株能够稳定分泌特异性的MAb,该 MAb 的制备为 AKAV 检测及其它相关研究奠定基础。
