迟缓爱德华菌menF基因缺失株的构建及生物学特性研究
2019-05-21张志强李巧玲肖丽荣苏硕青李永慧吴同垒王洪彬王双月朱国强史秋梅
张志强,李巧玲,肖丽荣,苏硕青,李永慧,吴同垒,王洪彬,王双月,朱国强,史秋梅*
(1.河北科技师范学院 河北省预防兽医学重点实验室,河北 秦皇岛 066004;2.秦皇岛市第二医院,河北 昌黎 066600;3.扬州大学,江苏 扬州 225009)
迟缓爱德华菌(Edwardsiella tarda)是水产养殖中的重要病原,能够感染多种鱼类,造成极为严重的损失。值得重视的是,E.tarda还可以通过食源途径感染人,引起胃肠炎、败血症,因此具有重要公共卫生学意义[1-2]。E.tarda为胞内寄生菌,其能够侵染宿主多种细胞并于胞内长期存活,这是其造成长期感染的重要原因[3]。研究E.tarda致病机制,探究其体内存活的关键因子,对于临床上E.tarda病的防控具有重要意义。
莽草酸途径是广泛存在于植物、真菌和微生物中的重要的代谢途径,参与合成多种生物体必须物质,对于生物生存至关重要。莽草酸途径涉及多个酶化过程,需要多种酶的参与,关键酶的缺失会引起生物体表型的改变甚至死亡。前期对沙门菌研究发现,将其莽草酸合成途径关键因子5- 烯醇丙酮酸-3- 磷酸合成酶编码基因aroA 失活后获得的营养缺陷菌株致病力显著下降,该菌株作为疫苗使用具有良好的保护效果[4-5]。MenF 是细菌所编码的一种异分支酸合成酶,也属于莽草酸途径的关键酶,该酶主要参与生物体合成2,3- 二羟基苯甲酸和甲基萘醌类物质,这些物质是细菌铁摄取和呼吸链所必不可少的,那么MenF 是否也影响细菌的致病性呢? 本研究对E.tarda异分支酸编码基因menF进行敲除,并分析其对细菌生物学特性的影响,为E.tarda病防控提供参考依据。
1 材料与方法
1.1 主要实验材料 致病性E.tardaET-CL 分离菌株分离自秦皇岛市某大菱鲆养殖场,由河北科技师范学院动物传染病研究室分离、鉴定和保存。自杀载体 pRE112、DH5α (λPir)以及 WM3064 (二氨基庚二酸DAP 缺陷大肠杆菌)菌株由吉林农业大学单晓枫教授惠赠。实验用斑马鱼(3 cm~4 cm)购自昌黎碣石花鸟鱼市场,实验前在本实验室预养1 周,以适应环境。LATaqDNA 聚合酶购自TaKaRa 公司;限制性内切酶及 T4 连接酶均购自Thermo 公司;DH5 感受态细胞购自北京全式金生物技术有限公司;基因组提取试剂盒、质粒小提试剂盒购自OMEGA 公司;铁螯合剂 2, 2'- 联吡啶(DIP)购自国药集团化学试剂有限公司;小鼠抗MenF 多抗血清由河北科技师范学院动物传染病研究室制备保存;HRP 标记山羊抗小鼠IgG (H+L)抗体购自康为世纪生物科技有限公司。
1.2DmenF融合片段的构建 根据GenBank 中登录的E.tarda参考菌株基因组序列(CP001135.1)设计特异性引物用于扩增menF基因上下游片段F1 和F2(表1)。
利用细菌基因组提取试剂盒提取E.tardaET-CL株基因组,并以其为模板 PCR扩增F1和F2片段,利用胶回收试剂盒回收目的基因后将F1 和F2 片段等量混合,取 1 μL 混合物做模板,利用 P1/P4 引物扩增,获得 F1、F2 相连接的融合片段 DmenF,利用胶回收试剂盒回收融合片段,将其克隆至pMD18-T 载体,构建 pMD18-T-DmenF,由北京生工生物工程有限公司测序鉴定。
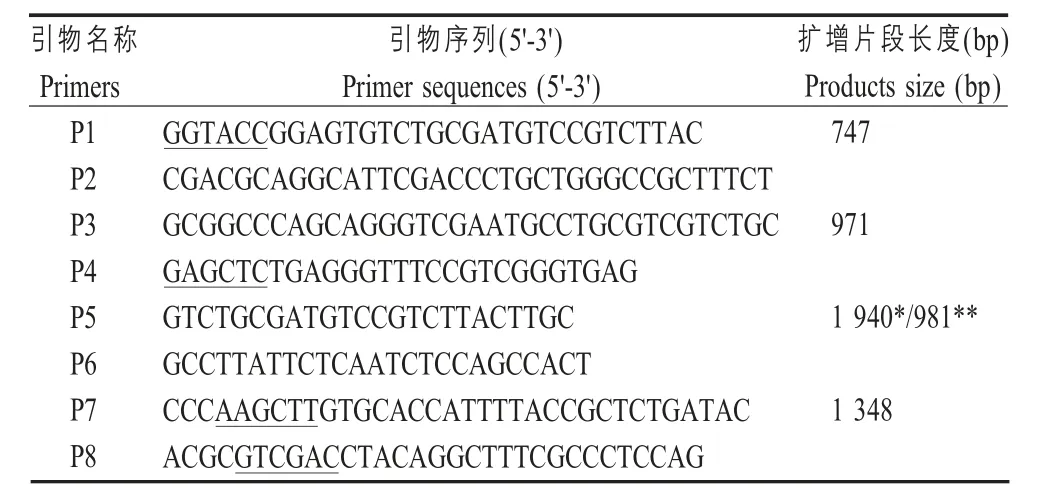
表1 实验所用的引物及序列Table 1 Primers used in this study
1.3 pRE112-menF 重组自杀载体的构建 利用KpnⅠ和SacⅠ分别对 pMD18-T-DmenF和 pRE112 空载体双酶切后回收融合片段DmenF和载体片段按照3∶1 比例连接,转入 DH5α (λpir)感受态细胞中。挑取克隆进行PCR 验证,提取阳性重组质粒双酶切验证,即得到重组自杀载体pRE112-menF。
1.4E.tardaET-CLΔmenF株的筛选与鉴定 将重组载体 pRE112-menF 转化入 WM3064 中(即为供体菌)。将对数生长期的供体菌和E.tardaET-CL 菌株(受体菌)按照 3∶1 比例混合,共培养 24 h;将培养物涂布于含有氯霉素抗性的营养琼脂,长出菌落即含有自杀载体的E.tarda。获得菌株于10 %蔗糖平板上划线,进行自杀载体丢失,对生长菌落进行抗性检测,选取无氯霉素抗性菌落以P5/P6 鉴定引物进行PCR 检测,产物由北京生工生物工程有限公司测序鉴定。通过上述方法获得E.tarda menF基因缺失株,即 ET-CLΔmenF(简写为 KO)。
以ET-CL 基因组为模板,利用P7/P8 引物扩增menF基因片段,将其克隆到 pACYC184 质粒中。将构建的回补质粒 pACYC-184menF转化至 ET-CLΔmenF株中,构建回补菌株 pACYC184menF/ET-CLΔmenF(简写为 RS)。
分别将E.tarda3 个菌株进行SDS-PAGE 电泳,转膜,封闭,以MenF小鼠抗MenF多抗(1∶500 稀释)作为一抗,羊抗鼠 IgG(H+L)为二抗(1∶10 000稀释),western blot 鉴定E.tardaMenF 蛋白表达。
1.5 ET-CLΔmenF的生物学特性检测 分别将E.tarda3 个菌株接种液体 LB 中,30 ℃培养过夜,次日按 1∶50 转接新鲜 LB 或 M9 培养基,30 ℃同步振摇培养;每隔 2 h 吸取菌液样品,测定其吸光度OD540nm值,绘制3 个菌株的生长曲线。
利用梅里埃(ATB)自动生化鉴定系统对E.tarda3 个菌株进行生化特性分析:将待检菌株于营养琼脂上划线培养,刮取菌落重悬于无菌生理盐水,调整菌体浓度至麦氏浊度为0.5,将菌液滴于 ID32E生化鉴定卡检测孔中,40 μL/ 孔。置于湿盒中 30 ℃培养24 h 后上机检测。
1.6 ET-CLΔmenF株对铁利用的测定 参照文献[6]配制铁限制性培养基,即含10μmol/L~150 μmol/L DIP 的 LB 培养基,确定 60 μmol/L DIP 的浓度恰好不影响ET-CL 菌株生长,以该浓度进行后续试验。分别测定E.tarda3 个菌株在 LB 培养基和LB+DIP 培养基中的生长情况,绘制生长曲线。
配制含终浓度为5 mmol/L FeSO4的M9 培养液,分别测定E.tarda3 个菌株在M9 培养基和M9+FeSO4培养基中的生长情况,绘制其生长曲线。
1.7 ET-CLΔmenF对环境应激抵抗力的测定 参照文献[7],分别检测E.tarda3 个菌株在酸性应激条件(pH3.5)和过氧化氢处理条件(10 mmol/L H2O2)下的生存能力。对应激条件下的细菌培养物计数。试验重复3 次,试验数据统计采用Prism 5.0 软件分析。
1.8 E T-CLΔmenF株在Raw264.7 细胞中存活能力的测定 参照文献[8],测定E.tarda3 个菌株在巨噬细胞系Raw264.7 内的存活能力,计算各菌株增殖率(23 h/3 h),即感染后23 h 与3 h 胞内菌数比值。
1.9 ET-CLΔmenF株致病力的测定 参照文献[9]分别接种E.tarda3 个菌株于TSB 液体培养基中过夜培养,以 PBS 洗涤细菌 3 次并悬浮,调整细菌浓度。将 160 尾斑马鱼随机分为 4组,包括 3 个实验组和一个对照组,实验组每组 50 尾,分别以1×104cfu、1×105cfu、1×106cfu、1×107cfu、1×108cfu 的剂量腹腔注射E.tarda3 个菌株,每一剂量 10 尾;对照组10 尾,接种等体积PBS。连续观察2 周并统计死亡情况,根据Karber-Behrens 法计算细菌的半数致死量(LD50),测定菌株对斑马鱼的致病力。
2 结 果
2.1 DmenF融合片段及pRE112-menF重组自杀载体的构建 以E.tarda基因组为模板,分别利用P1/P2、P3/P4 引物扩增menF基因上下游片段 F1 和F2,PCR 产物经1 %琼脂糖凝胶电泳检测,结果显示在750 bp 和1 000 bp 处出现特异性片段,与预期相符。将产物切胶回收,等比例混合作为模板,利用P1/P4 引物扩增融合产物,结果显示在1 800 bp处出现特异性片段,与预期相符,将融合片段产物回收克隆于pMD18-T 载体中,由北京生工生物工程有限公司测序,测序结果表明融合片段DmenF正确构建(图1)。进一步将融合片段DmenF克隆于自杀载体pRE112 中,测序结果表明构建了重组自杀载体pRE112-DmenF。
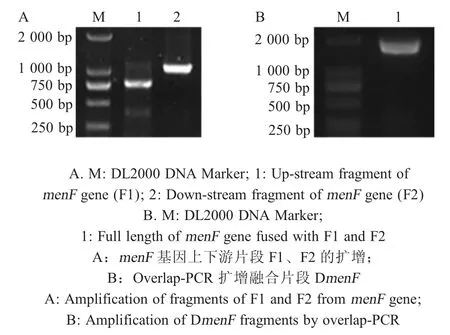
图1 DmenF融合片段的构建Fig.1 Amplification of DmenF gene from the genome of E.tarda by PCR
2.2E.tarda menF基因缺失株的鉴定 将重组自杀载体pRE112-DmenF通过结合转移方式导入野生型ET-CL 菌株中,通过抗性筛选和蔗糖复筛获得menF基因缺失株,利用特异性鉴定引物 P5/P6 对ΔmenF菌株进行鉴定,结果显示野生型菌株扩增片段大小为1 900 bp,menF基因缺失菌株扩增片段大小为 1 000 bp (图2A)。PCR 扩增产物经测序,结果显示menF基因被缺失;进一步采用western blot 鉴定,结果显示缺失菌株正确构建(图2B)。
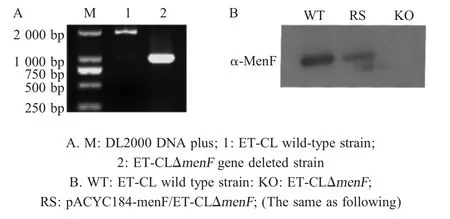
图2 E.tarda ET-CLΔmenF 基因缺失菌株鉴定Fig.2 Identification of ET-CLΔmenF mutant by PCR (A) and western blot (B)
2.3menF基因缺失对E.tarda生物学特性的影响E.tarda3 个菌株经培养后分别测定菌液吸光度OD540nm值,绘制生长曲线。结果显示,在普通 LB培养基中,37 ℃培养条件下,ET-CLΔmenF株的生长速度略低于野生型菌株和回补菌株,但在M9 培养基中ET-CLΔmenF株生长迟缓的特性更为明显(图3)。结果表明,menF基因的缺失降低了E.tarda的生长速率。
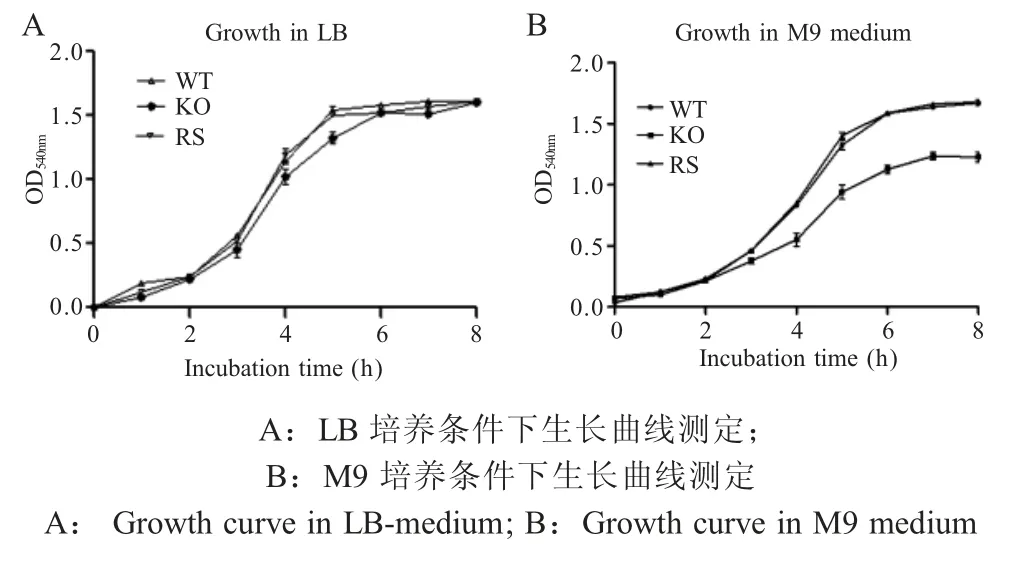
图3 E.tarda ET-CL 相关菌株生长曲线测定Fig.3 Growth characteristics of ET-CL isogenic deletion strains
利用ATB 全自动生化鉴定系统对E.tarda3 个菌株的生化反应谱进行测定,结果显示:三者生化反应谱无区别,表明menF基因缺失不影响E.tarda生化特性。
2.4menF基因缺失对E.tarda铁饥饿耐受的影响向LB 培养基中添加适量浓度(该浓度为不影响野生型菌株生长的最高浓度)铁螯合剂 DIP,测定ET-CLΔmenF株在其中的生长情况,结果显示,在铁限制性培养基中ET-CLΔmenF株的生长明显受到抑制;向 Minimal 培养基中添加过量 FeSO4,测定ET-CLΔmenF株的生长情况,结果显示,铁元素的补充使 ET-CLΔmenF株在M9 中的生长得到恢复,相比之下,实验模拟的铁饥饿和富铁环境对E.tarda野生型菌株和回补菌株影响不大(图4)。上述结果表明,MenF 参与E.tarda的铁摄取利用过程。
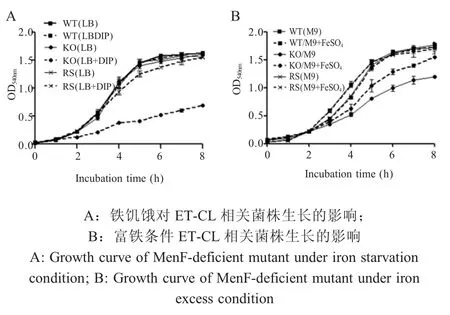
图4 铁离子对ET-CL 相关菌株生长特性的影响Fig.4 Growth characteristics of ET-CL isogenic deletion strains under iron starvation or excess
2.5menF基因缺失对E.tarda应对环境应激的影响 将E.tarda3 个菌株分别进行酸性和氧化应激处理,测定三者在应激环境下的生存能力。结果显示,与野生型菌株相比,menF基因缺失菌株在酸性和H2O2氧化条件下的生存能力明显下降(图5)。表明,MenF 蛋白在E.tarda耐受酸性应激和氧化应激中发挥作用。
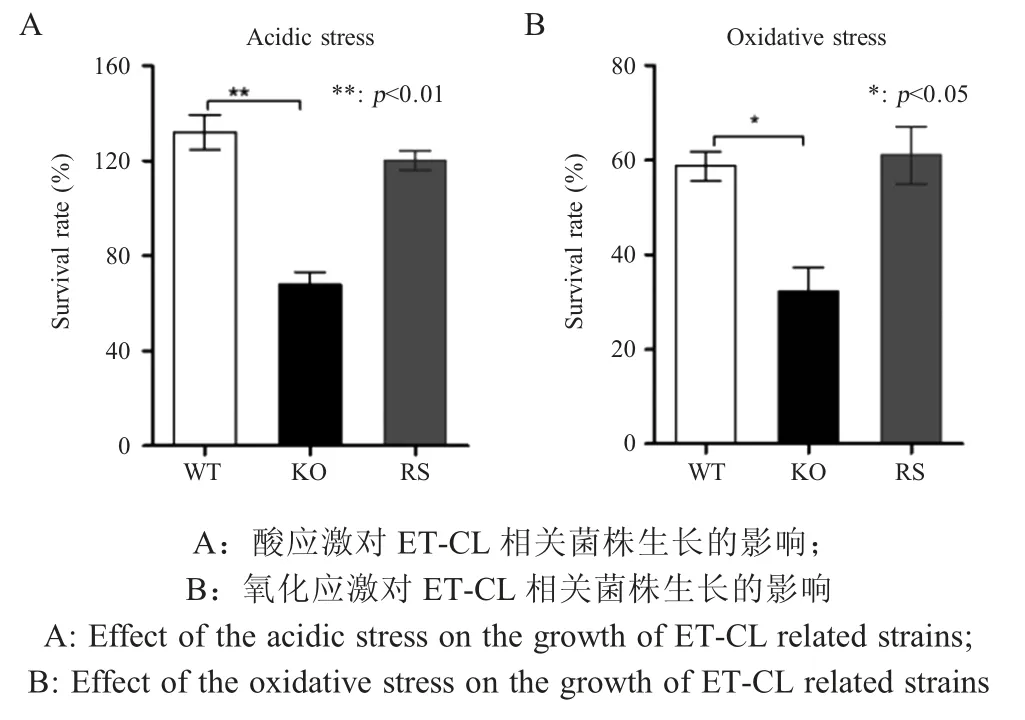
图5 环境应激对ET-CL 相关菌株生长的影响Fig.5 Effects of environmental stress on the growth of ET-CL related strains
2.6menF基因缺失对E.tarda胞内生存的影响分别测定E.tarda3 个菌株在巨噬细胞 Raw264.7 内的存活能力,结果显示,ET-CLΔmenF株在巨噬细胞内的增殖率相比野生型菌株降低0.6 倍(p<0.01)(图6),表明MenF 缺失影响E.tarda的胞内生存能力。
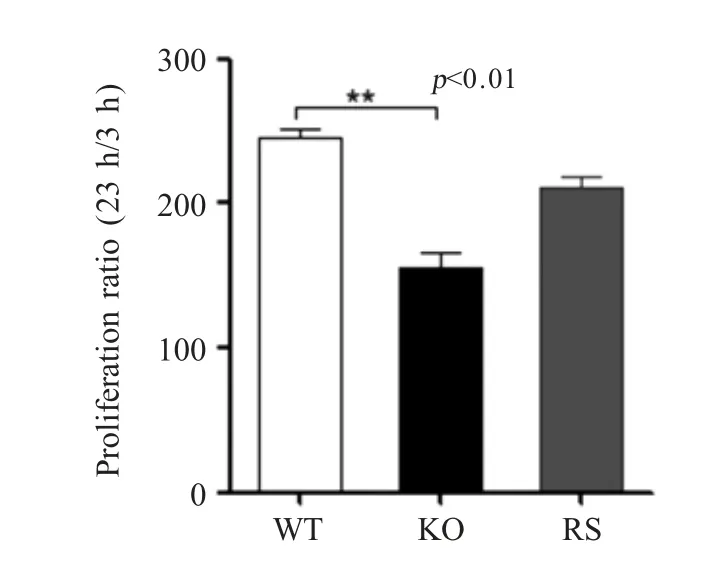
图6 E.tarda ET-CL 相关菌株在巨噬细胞内生存能力测定Fig.6 Intracellular viability assay of ET-CL related strains
2.7menF基因缺失对E.tarda致病力的影响E.tarda3 种菌株对斑马鱼的致病性试验显示,对照组无死亡,统计实验组斑马鱼死亡情况,根据改良寇式法计算,E.tardaET-CL 野生菌株对斑马鱼的LD50为1.26×106cfu,ET-CLΔmenF菌株对斑马鱼的 LD50为1.43×107cfu,有 10 倍左右差异,回补菌株对斑马鱼的 LD50为 3.98×106cfu,表明menF基因缺失会引起E.tarda毒力下降。
3 讨 论
MenF 是E.tarda所编码的一种异分支酸合成酶,其能够催化合成细菌生存关键分子- 异分支酸[10]。细菌通过自身合成和体外获取两种途径获得异分支酸,在宿主细胞内,仅能通过自身合成途径合成该物质,一旦被阻断,则细菌无法生存[11]。本研究对E.tarda menF基因进行缺失,并进一步评估其生物学特性发现,menF基因缺失并未影响E.tarda的生化特性,menF基因缺失株同野生型菌株具有完全相同的生化反应谱,表明MenF 并未影响E.tarda对糖和氨基酸的利用。而生长速度测定结果显示,menF基因缺失后E.tarda在LB 中的生长速度略有下降,而在M9 培养基中缺失菌株生长明显劣于野生型菌株。M9 培养基是仅由无机盐和碳源配制的限制性培养基,背景清晰,menF基因缺失株在其中生长受阻,证明培养基中缺乏menF基因缺失株菌株生长所需原料。铁是微生物生存所必须的元素,在宿主体内铁饥饿条件下,摄取足够铁是致病菌感染的先决条件,而在铁摄取中发挥关键作用的是铁载体[11]。有研究发现,在大肠杆菌、耶尔森菌和铜绿假单胞菌中分支酸合酶MenF 参与细菌铁载体的合成,与细菌应对铁饥饿环境相关[12-13]。那么是否因为MenF缺失影响铁摄取进而导致E.tarda生长受阻呢? 为回答这一问题,本研究利用特定浓度铁螯合剂模拟铁饥饿条件,证实了E.tarda menF基因缺失后应对铁饥饿的能力显著下降。进一步在M9 培养基中添加充足的铁离子,发现menF基因缺失株的生长得到部分恢复,证实了前面的猜想。E.tarda可以侵染机体多种细胞,并能够在胞内生存和增殖,这对于其感染致病十分关键,低pH 和活性氧是细胞清除胞内病原的有效手段[14],因此本研究利用体外模型模拟胞内应激环境以探索MenF 在迟缓爱德华菌胞内存活中的作用,结果表明,menF基因缺失株应对酸性和过氧化氢处理能力下降,揭示MenF 可能参与E.tarda胞内存活。铁摄取利用能力对于细菌胞内生存十分关键,MenF 能够影响E.tarda对铁饥饿的耐受,也揭示该蛋白能够影响E.tarda胞内存活。本研究对比了menF基因缺失株和野生型菌株在鼠源巨噬细胞细胞内的生存能力,结果表明,menF基因缺失株够显著降低E.tarda的胞内存活。莽草酸途径对于微生物生存来说至关重要,该途径所涉及的某些酶类也被证实与细菌生长、代谢以及致病性密切相关[4-5],有研究在E.tarda中将莽草酸途径关键酶aroA 缺失后,细菌毒力下降 10 万倍[15]。作为 莽草酸途径的关键酶异分支酸合酶是否与细菌毒力相关尚未见研究报道,为此本研究进一步利用经典的斑马鱼模型来评估 ET-CLΔmenF的致病力,结果显示,MenF 缺失能够降低E.tarda毒力。
本研究成功构建E.tarda menF基因缺失株,并对其生物学特性进行研究,为E.tarda致病机制研究以及疫苗研制奠定基础。
