鸡源弯曲菌Ⅰ型整合子-耐药基因盒结构分析及接合消除研究
2019-05-21唐梦君张小燕唐修君陆俊贤高玉时
周 倩,唐梦君,张小燕,张 静,唐修君,陆俊贤,高玉时
(江苏省家禽科学研究所,江苏 扬州 225125)
弯曲菌(Campylobacter)是重要的人兽共患肠道病原菌,其中空肠弯曲菌(Campylobacter jejuni)和结肠弯曲菌(Campylobacter coli)最为常见,它们广泛存在于温血动物体内,如家禽、猪、牛和野生鸟类肠道,其中禽类带菌率最高[1]。弯曲菌具有活而不可培养状态(Viable but nonculturable,VNC),通过食物链传播,在食品中的分布和传播情况不稳定,加热和彻底煮熟食物能够杀死该菌。在预防和控制家禽疾病的过程中,大量抗生素使用导致了多重耐药弯曲菌的产生[2-4]。当人类感染了具有抗性的弯曲菌时,将严重影响自身健康。
整合子是一种可移动元件,通常存在于质粒和转座子中,因其能够捕获、整合和表达耐药基因而被广泛重视。整合子由 3 个部分组成,包括 5' 和3'保守末端以及两者之间的可变区,一个整合子能够捕获多种耐药基因,基因盒的移动是细菌实现自我进化的重要方式[5]。整合子- 耐药基因盒不仅可以垂直传播耐药基因,而且可以借助结合性质粒、转座子、噬菌体等可移动基因元件,在同种和不同种属细菌间水平传播耐药基因,诱导新的耐药菌株出现[6]。已发现的100 多种基因盒大都与耐药基因相关[7]。
本研究以2016年~2017年收集的弯曲菌为研究对象,检测其Ⅰ型整合子流行情况和耐药基因盒结构;采用自然转化法和化学消除法探究整合子的移动稳定性,以便深入了解Ⅰ型整合子介导的弯曲菌耐药性的产生和传播途径,为控制耐药性细菌的产生和传播提供科学参考。
1 材料与方法
1.1 主要实验材料 2016年5月~2017年8月,从江苏徐州、南通和扬州等7 个县市农贸市场、超市和养殖场参照文献[8-9]分离鉴定得到228 株空肠弯曲菌和84 株结肠弯曲菌,共计312 株。弯曲菌标准菌株NCTC11168 和大肠埃希氏菌ACTC25922 由本实验室保存。CCDA 培养基、MH 培养基、BHI培养基、琼脂、酵母提取物、胰蛋白胨和27 种药敏纸片购自英国OXOID 公司。SpeedSTARTMHS DNA Polymerase、MiniBEST DNA Fragment Purification Kit Ver.4.0、pMD20-T载体和E.coliDH5α Competent Cells 购自宝生物工程(大连)有限公司;细菌基因组DNA 提取试剂盒购自天根生化科技(北京)有限公司。
1.2 弯曲菌的药敏试验 采用WHO 推荐的Kirby-Bauer (K-B)法,利用购买的 10 类 27 种抗生素药敏纸片,根据美国临床实验室标准化协会(The Clinical and Laboratory Standards Institute,CLSI,2015)标准方法进行药敏试验并判定。
1.3 弯曲菌Ⅰ型整合子- 耐药基因盒的检测 根据Ⅰ型整合子(DQ149925.1) 5' 保守末端(整合酶int1)和 3' 保守末端(qacEdelta1-Sul1)基因序列,利用 Premier5 设计两对特异性引物(表1)。引物均由上海生工生物工程技术服务有限公司合成。
利用试剂盒提取312 株弯曲菌基因组DNA 为模板,采用 PCR 分别扩增int1和qacEdelta1-Sul1基因,PCR 扩增条件为:95 ℃ 1 min;95 ℃ 30 s、55 ℃30 s、72 ℃ 1 min,共30个循环;72 ℃ 10 min。PCR 产物经1 %琼脂糖凝胶电泳后随机选取PCR 扩增产物由上海生工生物工程技术服务有限公司测序。
根据int1和qacEdelta1-Sul1基因测序结果设计Ⅰ型整合子- 耐药基因盒引物(表1),以 I 型整合子阳性弯曲菌基因组DNA 为模板进行PCR 扩增整合子 - 耐药基因盒,PCR 反应条件为:95 ℃ 1 min;95 ℃ 30 s、58 ℃ 30 s、72 ℃ 4 min,共 35 个循环;72 ℃ 10 min。PCR 产物纯化后克隆至 pMD20-T 载体后转化至E.coliDH5α 感受态细胞,37 ℃培养后于含氨苄青霉素(Amp)的LB 平板上,筛选阳性菌落由上海生工生物工程有限公司测序。

表1 靶基因引物序列及片段长度Table 1 Primer sequence and gene length
1.4 弯曲菌自然转化试验 参照文献[11]采用自然转化法,将对数生长期的弯曲菌标准菌株NCTC11168 菌液稀释至 0.5 麦氏浓度,取 100 μL 菌液均匀涂布于 2 个 MH 血平板内径 2 cm 的区域,微需氧 42 ℃培养 6 h~8 h 后取 20 μL 经检测为耐药基因盒阳性的菌株基因组 DNA 滴加于NCTC11168 菌苔的内部区域,阴性对照滴加20 μL无菌PBS,每次试验设一个空白对照(仅接种菌液但不滴加任何溶液)。微需氧培养后根据1.2 和1.3 进行药敏试验及整合子- 耐药基因盒检测。
1.5 弯曲菌化学消除试验 将整合子- 耐药基因盒阳性弯曲菌复苏于CCDA 平板和MH 血平板,挑取适量MH 血平板菌落加入含0.1 % SDS MH 肉汤培养基(含 5 %无菌马血清),取 50 μL 肉汤培养菌液涂布于MH 血平板,空白对照为阳性菌株接种于不含SDS MH 肉汤培养基(含5%无菌马血清),质控对照为接种弯曲菌NCTC11168。微需氧培养36 h 后根据1.2 和1.3 进行药敏试验及整合子- 耐药基因盒检测。若整合子未能消除,重复上述化学消除步骤。
1.6 数据处理 分析int1、qacEdelta1-Sul1和耐药基因盒测序结果,利用BioEdit 和SeqMan 软件对序列拼接后进行BLAST 比对分析;耐药率变化数据采用SAS 9.2 进行卡方检验。
2 结 果
2.1 Ⅰ型整合子- 耐药基因盒流行特征
2.1.1 Ⅰ型整合子在鸡源弯曲菌中的流行情况 通过PCR 方法扩增312 株鸡源弯曲菌中的Ⅰ型整合子的int1基因和qacEdelta1-Sul1基因。PCR 及测序结果显示128 株弯曲菌携带int1基因,阳性率为41%。在128 株int1基因阳性弯曲菌中,仅有58 株弯曲菌携带Ⅰ型整合子qacEdelta1-Sul1,阳性率为18.6 %。表明312 株弯曲菌中,携带int1基因的菌株不一定携带Ⅰ型整合子qacEdelta1-Sul1,但是携带Ⅰ型整合子qacEdelta1-Sul1的菌株一定携带int1基因。部分弯曲菌int1基因和qacEdelta1-Sul1基因 PCR 扩增结果见图1。
2.1.2 Ⅰ型整合子- 耐药基因盒检测结果及其结构58 株含完整Ⅰ型整合子弯曲菌株中,经PCR 扩增测序,结果显示15 株菌株(5 株结肠弯曲菌和10 株空肠弯曲菌)可变区均检出耐药基因aadA1,其余菌株的整合子可变区未检测到耐药基因盒(图2)。aadA1耐药基因编码对氨基糖苷类抗生素耐药。本研究中整合子- 耐药基因盒结构图谱见图3,5' 和 3'保守末端分别为int1基因和qacEdelta1-Sul 1基因,外源耐药基因aadA1通过识别整合子重组位点attI插入到整合子可变区中,从而使该菌株表现出对氨基糖苷类抗生素的耐药性。
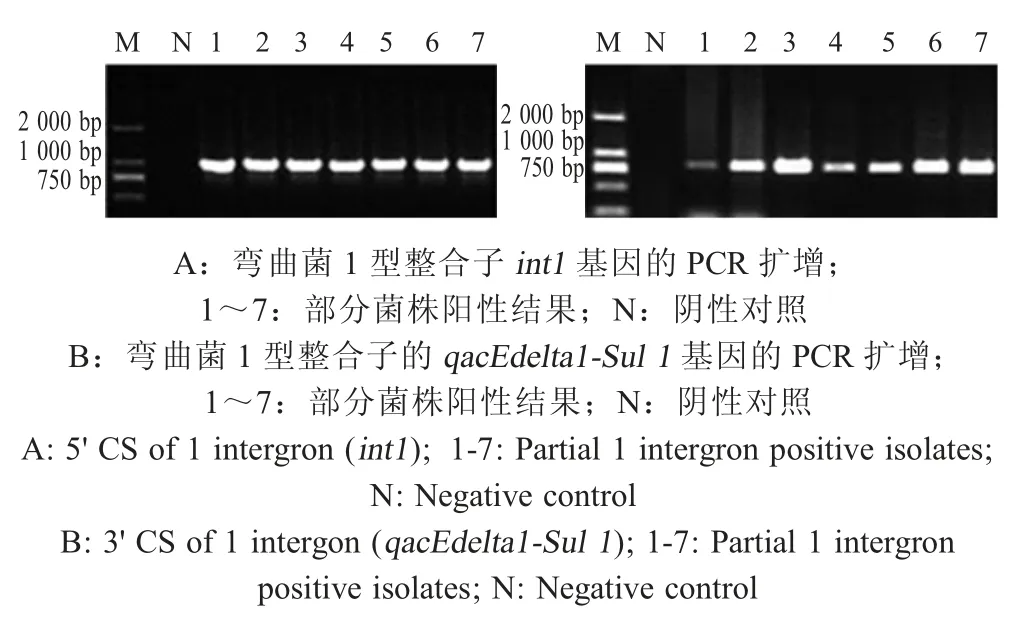
图1 弯曲菌I型整合子的PCR扩增Fig.1 The identification of the class I integron in Campylobacter by PCR
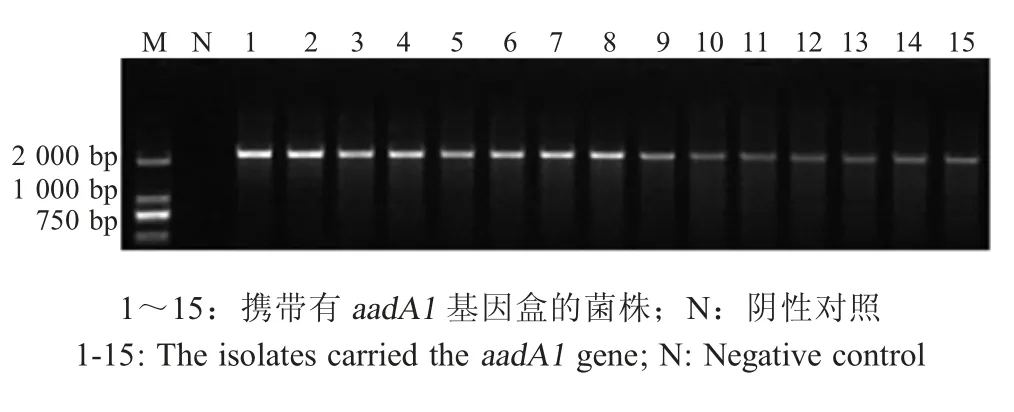
图2 弯曲菌整合子-耐药基因盒的PCR扩增Fig.2 The amplification of gene cassette in the variable region by PCR

图3 弯曲菌Ⅰ型整合子携带aadA1 基因模式图Fig.3 The schematic diagram of the class 1 integron carrying the aadA1 gene
2.2 弯曲菌的自然转化试验结果及分析 以15 株aadA1阳性弯曲菌基因组为供体,以遗传背景清晰的敏感菌株空肠弯曲菌NCTC11168 为受体菌进行自然转化实验,结果显示本实验获得6 株aadA1基因阳性的自然转化子,转化率为40 %。
对27 种抗生素的药敏检测结果显示,6 株自然转化子与阴性对照组弯曲菌相比,其对大多数抗生素的抑菌圈缩小,表明自然转化子获得整合子结构后能够产生耐药性;而9 株接合失败的菌株显示对这些抗生素的抑菌圈增大或不变(表2),表明大多数弯曲菌仍然保持对药物的敏感性。
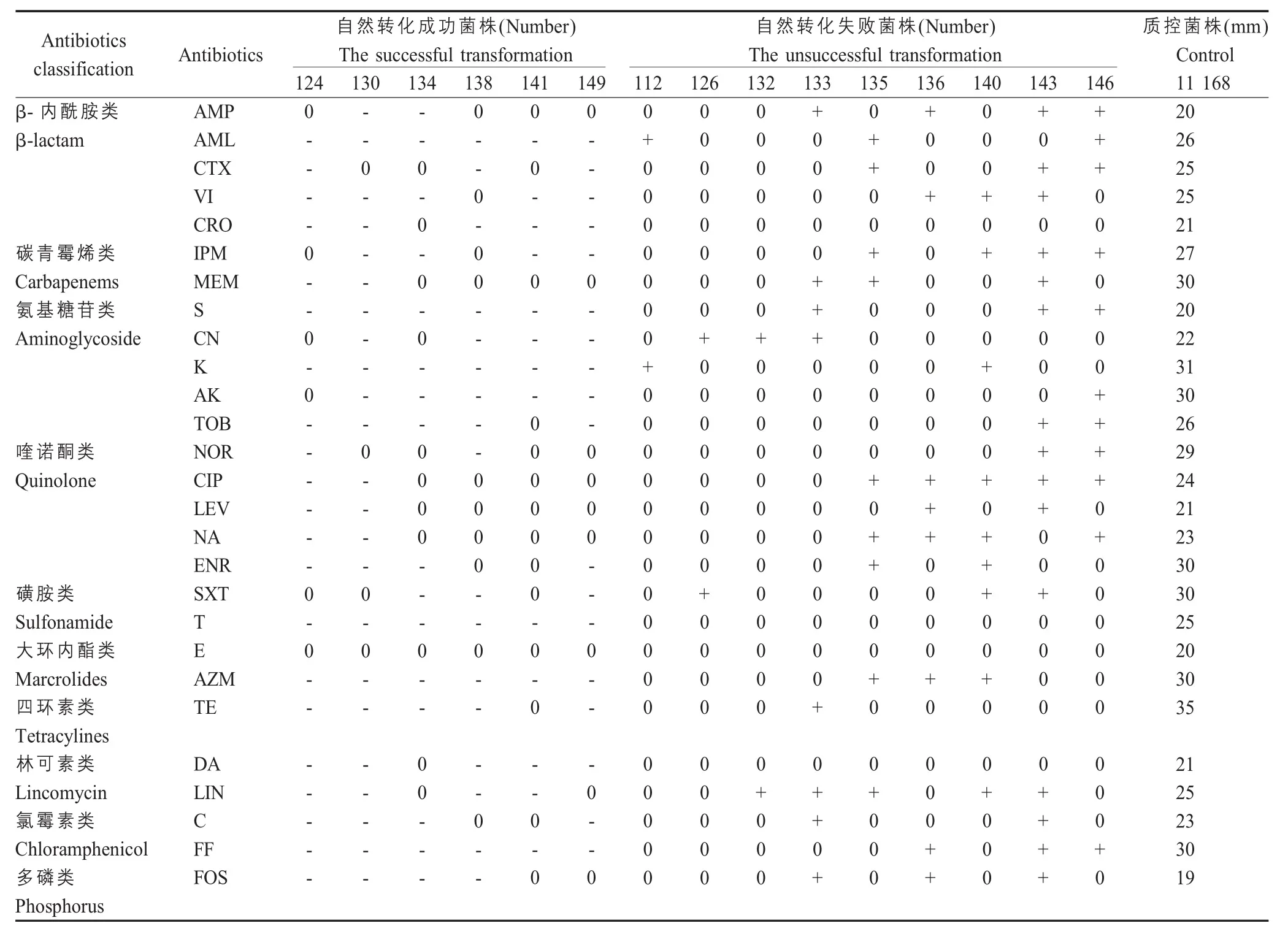
表2 弯曲菌自然转化前后耐药表型变化Table 2 The phenotypic change of drug resistance of the Campylobacters after natural transformation
2.3 弯曲菌化学消除试验结果及分析 将携带aadA1基因盒的耐药弯曲菌进行整合子- 耐药基因盒消除试验。15 株弯曲菌经过0.1 % SDS 化学处理,5 株弯曲菌能够一次化学消除整合子结构,所有菌株经5 次处理以后,PCR 未检测到整合子。表明经0.1% SDS 化学处理能够成功消除整合酶int1基因。部分弯曲菌株消除整合酶int1基因前后的PCR 检测结果见图4。
经0.1% SDS 化学处理后,部分抗菌药物耐药率在消除整合酶int1基因前后发生改变。其中对氨基糖苷类抗生素的耐药率变化最大,其它药物均未发生明显变化(表3)。表明随着整合子- 耐药基因盒的消除,部分菌株对氨基糖苷类药物耐药性发生逆转。

图4 部分弯曲菌菌株整合酶基因消除前后的PCR鉴定Fig.4 The identification of the isolates with the int1 gene before and after eliminating by PCR
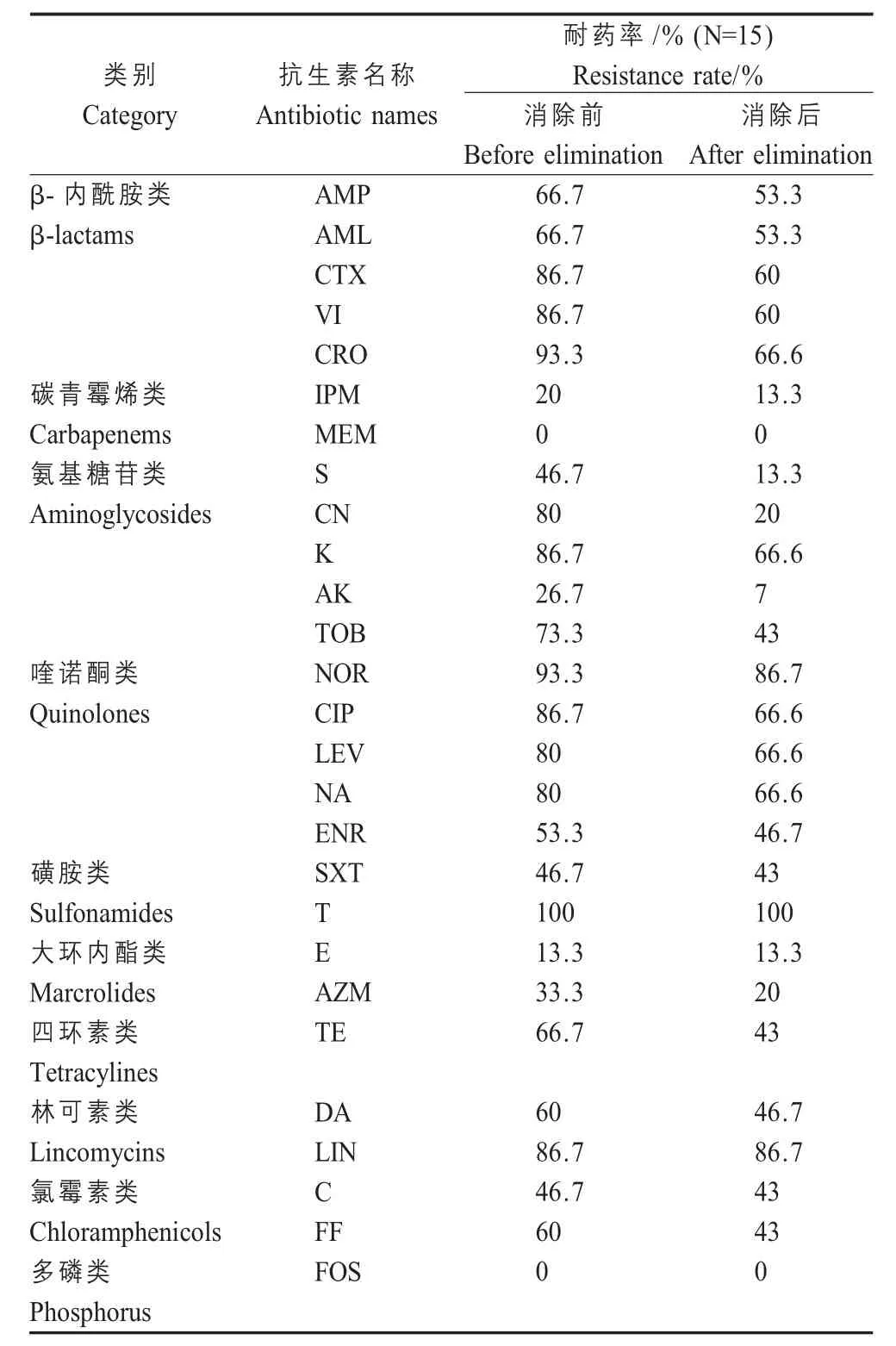
表3 化学消除试验前后弯曲菌耐药性变化Table 3 The change of antibiotic resistance rate before and after chemical eliminating
3 讨 论
弯曲菌作为一种重要的人兽共患病病原菌,不仅能够引起人类和动物细菌性腹泻,还可以引起格林- 巴利综合征[12]。本研究中弯曲菌的Ⅰ型整合子阳性率为18.6 %,采用PCR 扩增Ⅰ型整合子的可变区,测序比对结果显示15 株弯曲菌均扩增出1 825 bp大小相同的条带,为氨基糖苷类抗生素耐药基因aadA1,基因盒单一。
在自然条件下,细菌摄取外源DNA 并转化为自身遗传物质,该过程称为自然转化[11]。通常情况下,耐药基因可以通过转座子和整合子等可移动元件在质粒或是染色体间迁移扩散[13]。本研究表明在实验室条件下,I 型整合子能够由供体菌DNA 自然转化到受体弯曲菌NCTC11168 中,转化率为40 %。而邓凤如证明在实验室条件下aadE-Sat4-aphA3及其氨基糖类耐药基因岛(type I、type II 和 type III)均能够通过自然转化的方式由耐药供体菌C.coli转移到敏感受体菌C.jejuniNCTC11168,发生了跨弯曲菌亚种的传播,转化率达100 %[11]。基于现有的研究和自然转化试验的结果,本研究推测弯曲菌中的aadA1基因盒是通过自然转化的方式传播,但弯曲菌不同于其它的大多数细菌,苛刻的培养环境导致了其传播过程的稳定性。此外,弯曲菌中整合位点的多样性和选择性也影响自然转化的转化率。获取外源DNA 的细菌通常能够获得抗药性和致病性[14-15],整合子的成功转化表明受体菌株获得整合子后获得部分耐药性。以此推断,多重耐药弯曲菌可以通过食品源动物将细菌耐药性传递给人类,造成其耐药性增加。自然转化成功表明整合子能够通过同源重组的方式使耐药基因盒在弯曲菌中发生水平传播。
在实验室条件下,采用化学消除法能够消除耐药基因盒从而消除细菌耐药性,本研究消除氨基糖苷类抗生素耐药基因盒前后,弯曲菌耐药率变化明显,表明整合子- 耐药基因盒消除能够部分逆转弯曲菌的耐药性。而化学消除虽然操作便捷,但消除率低。有研究显示用中药(如三黄片和艾叶草)对临床分离的大肠杆菌耐药质粒的消除率为31 %和60 %[16-17],本研究利用SDS 对弯曲菌第一轮的消除率为33 %,与三黄片消除效果相当。
综上所述,虽然化学消除能够一定程度消除细菌对抗生素的耐药性,但随着接合的发生使耐药消除菌株又重新获得耐药性,给疾病防治和耐药性阻断带来很大困难。单纯消除整合子耐药基因盒结构在致病菌耐药性流行的防控中难以取得明显效果,因此,在家禽养殖中需要强化科学用药、精准用药,以提高禽产品质量安全控制水平,加强食品安全风险管理。
